国庆长假开始,辛苦了大半年的人们都在收拾心情。不过,数字疗法行业可能心情会格外的好——毕竟,节前传出的几个消息对于数字疗法来说或许将是一个里程碑。
9月26日,中国食品药品检定研究院(NIFDC)在官网上发布了一条简单的新闻,随后引发了行业关注。
根据这条标题为《中检院器械所组织召开数字疗法医疗器械产品技术讨论会》的简单新闻介绍,9月16日,中检院器械所(人工智能医疗器械标准化技术归口单位秘书处)组织召开了数字疗法医疗器械分类界定指导原则技术研讨会。参会单位包括国家药监局医疗器械标准管理中心、医疗器械检验机构、临床机构和企业代表等近30家单位。
中检院相关新闻(截图自中检院官网)
随着技术的不断发展,新的医疗器械产品也在不断问世。这其中,一些新兴的产品在现有医疗器械分类中并没有相应的分类,或者横跨多个现有产品分类,使得审评机构在实际操作中难以明确具体的分类。在这种背景下,分类界定指导原则也就应用而生,一般用于指导产品,尤其是新兴产品的管理属性和管理类别判定。
如今如火如荼的人工智能也曾经历过这一发展阶段。当时,医疗人工智能软件相关的监管规则尚不完善,尤其人工智能软件的归类和界定较为模糊,包括了作为医疗器械管理和不作为医疗器械管理两种情况。
这造成了人工智能医疗器械的审批上出现了一些“擦边球”行为。
举例来说,在2020年之前,一些企业申报的器械产品虽有深度学习算法作为辅助,但报批时并未使用“人工智能”四字作为关键点进行报批。所以,这类三类医疗器械虽有深度学习、机器学习等算法助力,但仅是按正常程序通过的医疗器械产品,并不能算作人工智能医用软件。
2021年4月,NMPA《人工智能类医用软件产品分类界定指导原则》(征求意见稿)。当年7月,经过征求各方修改意见后,NMPA发布了正式的《人工智能医用软件产品分类界定指导原则》。半年以后的2022年3月,NMPA进一步发布了《人工智能医疗器械注册审查指导原则》。
通过这些指导原则,人工智能医疗器械的审评得到了标准化和规范化。企业则可在研发阶段就遵循指南的相应要求,避免走弯路。
数字疗法的发展与人工智能颇有类似之处。数字疗法属于医疗器械软件(SaMD)的一部分,但在下属分类中存在相当的争议。比如,根据具体情况,数字疗法究竟按照三类器械还是二类器械管理,某些类别软件医疗器械究竟是否属于数字疗法等。类似当时人工智能医疗器械审批的“擦边球”也不在少数。因此,急需明确数字疗法的分类界定原则。
根据动脉网的了解,16日的会议主要对人工智能医疗器械标准化技术归口单位秘书处前期起草的《数字疗法医疗器械产品分类界定指导原则》(草案)。这意味着各方已基本认同数字疗法作为一种新兴的医疗器械,相应的标准制定流程已经开始启动。对于此前并未明确被官方认可的数字疗法来说意义重大。
不过,根据动脉网从消息人士处的了解,行业对于当前《草案》的意见较多,包括产品的分类界定、循证依据等都有争议。
“比如,疾病管理究竟算不算做数字疗法,什么样的疾病管理才可以算?这些都存在一定的争议。如果分类过于宽松,就有可能出现劣币驱逐良币的问题。”消息人士向动脉网介绍。
在9月29日举办的《人工智能医疗器械标准宣贯与质量评价学术论坛》上,中检院的专家也就数字疗法产品的技术问题探讨进行了公开演讲,从演讲中也可以看出一些官方的看法。
在演讲中,相关专家也就数字疗法定义中的“疾病预防、管理和治疗”发表了看法。该专家认为,“疾病管理”定义如何界定还需商榷。或许,用“疾病控制”进行定义会更为符合医疗器械的定义。
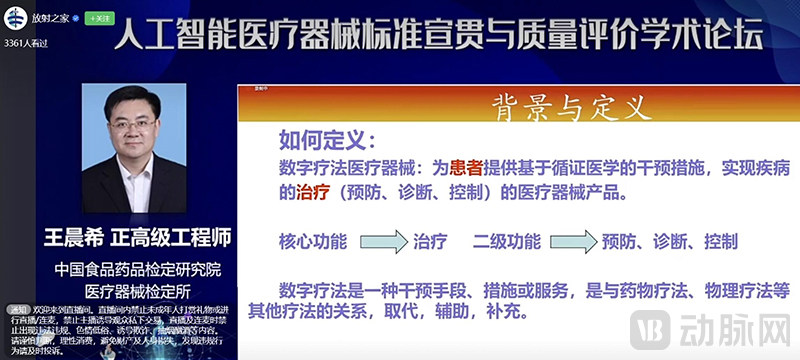
同时,专家也给出了对数字疗法的定义,即“为患者提供基于循证医学的干预措施,实现疾病的治疗(预防、诊断、控制)的医疗器械产品”。其中,数字疗法的核心功能应该是治疗,预防、诊断和控制应该归为数字疗法的二级功能。
中检院相关专家公开演讲中对数字疗法定义的描述(截图自视频直播)
此外,在相应的特性上,该专家也给予了一定的补充,提出了数字疗法的产品质量特性:数字疗法应该是基于医学模型的治疗和干预手段、输入对象应为患者数据;在干预方式上则应具有实时性的人机交互,及可提供个性化干预和治疗方案等特点;在产品风险程度上应以产品适应症和算法成熟度作为主要的判定因素。
根据消息人士的介绍,按照计划,数字疗法分类界定指导原则原本计划在年底或者明年初发布。不过,由于争议点较多,后续或许还将进一步就此进行讨论修改。
根据之前人工智能的情况,从分类界定原则(征求意见稿)到注册审查指导原则最终将经过接近一年的时间。这意味着,即使按照原计划在今年底发布分类界定原则的征求意见稿,最快也要到2023年年底才会发布相应的注册审查指导原则。
一波未平一波又起,就在大家还没有完全消化有关数字疗法分类指导原则的消息时,9月29日,圈内又传出一则消息——电气电子工程师学会(IEEE)成立数字疗法工作组,并正式开始召集国内外专家参与起草。
IEEE数字疗法相关标准立项申请书

这意味着数字疗法的第一个国际标准已经正式立项。
IEEE在电气及电子工程、计算机及其他技术领域中有着极强的影响力,在相应领域的标准制定中也有不菲的成绩。其中,最为知名的莫过于IEEE 1394和IEEE 802等系列标准。
IEEE标准理事会是IEEE中涉及标准制定的重要组织,主要工作是鼓励和协调IEEE标准的开发和修订,包括批准IEEE标准项目的启动,并对其进行审查以确保共识、正当程序、开放性和平衡性。
IEEE标准理事会理事,同时也是重庆大学生物工程学院副院长的钟代笛教授向动脉网证实了数字疗法的标准立项申请已获得批准,并向动脉网介绍了IEEE标准制定的相应流程。
第一步是标准立项申请。根据IEEE规定,任何个人或实体都可以启动一个项目,但每个项目都需获得IEEE一个标准技术委员会的审核以及支持。随后,等待项目授权文件(PAR)通过IEEE标准协会下属新标准委员会的批准后,项目才可启动。
目前,数字疗法标准工作组正处于这一阶段,即项目已获批准并已立项,标准编号为3183。根据立项申请书显示,本次标准主要是为应用于精神行为治疗的数字疗法设立相应的框架,将需要30名专家的加入。
IEEE相关立项申请书中关于标准愿景的解释

第二步是成立标准工作组并完成草案的制定。在完成标准工作组组建后,工作组需要确立相应的章程,在主席的带领下进行标准文本的开发工作。标准起草将在工作组内部完成,通过召开标准工作组会议并经过多次反复修订完善。
第三步则是同行评审投票。所提交的标准草案需要经过不断的校订和投票,直至赞成票达到75%的比例,且没有产生新的反对票,方才能完成完成标准制定,并提交标准董事会批准并出版。“这是一个漫长的过程,关注度越高的标准,同行评审的意见就越多。一般来说,至少也要两年的时间。”钟教授介绍道。
“数字疗法在全球的关注度都很高,一些国际组织早在2015年前后就开始在讨论数字疗法,且欧美已有不止一个数字疗法产业联盟。另外,IEEE的标准是侧重工程技术的,与医疗服务还是有一定的边界。”钟教授补充道。
毋庸置疑,虽然距离标准草案为时尚早,但IEEE的加入无疑也将对行业提供强力的推动。
由于标准制定需要行业各方参与,协调妥协后统一执行。因此,标准可以被认为是行业发展的催化剂。通过制定标准,往往可以使各方技术彼此兼容对接,也使得企业可以在最初研发就明确相应的要求。
坦白而言,无论是中检院的数字疗法分类界定指导原则,还是IEEE标准立项,距离最终标准的产生仍有不短的时间。不过,这至少代表了数字疗法初步获得了认可。这些规则的设立也将会为数字疗法行业提供指导参考,进而推动行业的进一步发展。
动脉网也将持续关注事态的进展,并带来第一手的报道,也欢迎相关人士不吝赐教,为我们提供相应的新闻素材。





























