创建于2018年的Frontier Medicines是一家精准医疗领域的创新医药公司,聚焦蛋白质组学药物研发。Frontier开发了一个专有化学蛋白质组学开发平台,可用于发现“不可成药”蛋白质上的可靶向位点,进而开发靶点药物。
Frontier的首款小分子共价药物FMC-376已经进入临床前阶段。数据表明,FMC-376的疗效有效性高出上一代抑制剂1000倍。
今年1月5日,Frontier宣布其与AbbVie合作下的第二、三管线已进入潜在研发阶段(Lead generation),将利用新型E3 Ligases进行靶向蛋白质降解。
4月6日,Frontier宣布预计下半年启动FMC-376的新药临床试验申请(IND)计划。
蛋白质组学的未来在向人类招手,FMC-376前路漫漫,但Frontier平台正是Frontier在蛋白质组学技术里挖下的护城河。这让其手握多个待开发管线和超过15万个蛋白质热点残基。
生物医药创新早已迈入了分子生物学时代。
随着研究深入,基因组学呈现的信息已无法完全解释人类复杂疾病的形成。越来越多证据表明,mRNA表达与蛋白质表达之间的相关度有限。蛋白质的翻译后修饰、裂解、复合物的形成定位等关键功能都缺乏应有关注。在此背景下,蛋白质组学应运而生,成为生物科学领域的新高峰。
使用蛋白质组学可以对生物体蛋白质的表达水平、细胞定位、蛋白翻译后修饰和蛋白相互作用进行系统性研究。在疾病研究领域,蛋白质组学与生理生化、细胞生物学、生物信息学等结合,深入认识生物体基因编码蛋白质的实际情况和异常情况,阐明疾病发生机制、提供新的治疗思路。
作为精准医疗的深水赛道,蛋白质组学应用横跨科研发现、药物转化、诊断应用等多个方面。相应的技术市场和医药市场也成为一块大蛋糕。
根据弗若斯特沙利文报道,到2025年,全球蛋白质组学服务市场规模将达到68亿美元,复合年增长率将达到17.6%。Cowen Equity行业研究数据显示,2021年全球蛋白质组学市场规模高达280亿美元,增长超过10%。
Frontier基于其专有的化学蛋白质组学平台,瞄准了那些“不可成药”的致病蛋白质,开发突破性治疗药物。
目前90%的人类蛋白质表面未发现可结合位点,因而不能被小分子瞄准,研发出有效靶向的小分子药物,即被称为“不可成药”的致病靶点。而Frontier认为,蛋白质是恒定运动的三维分子结构,在天然生理状态下具有可塑性。当它们构象变化或移动时,会出现“临时口袋”,即可被靶向的位点。
化学蛋白质组学(chemoproteomics)是基于靶点的一种间接发现策略,能够直接识别化合物可组合位点,为后续药物靶点结合、药物选择性、药物作用机制和致病机理等分子机制研究和应用提供支持。
因此,Frontier研发了一个由化学蛋白质组学、共价化学和机器学习提供动力的药物发现平台Frontier。
数据集Druggability AtlasTM
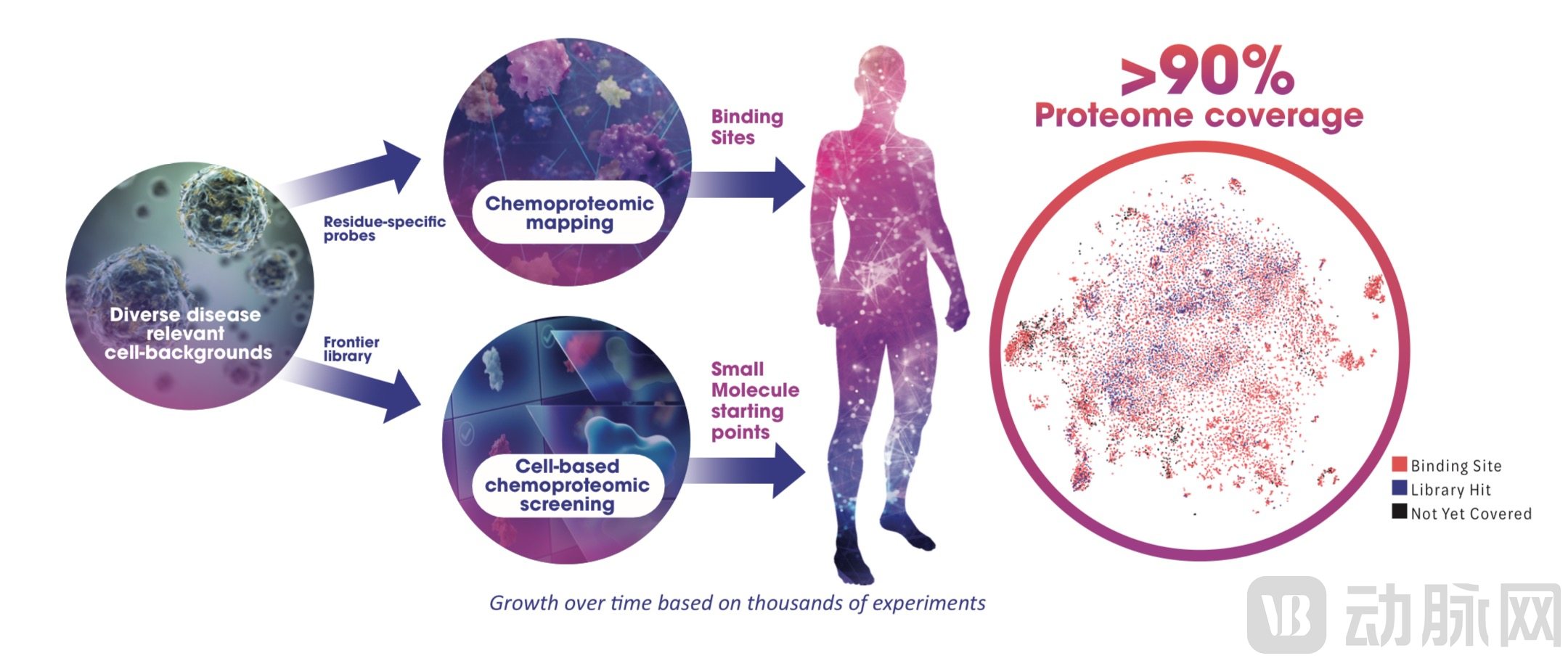
Frontier平台搭建逻辑
图源:Frontier Medicines
Frontier平台将数十亿个实验化学蛋白组学数据点、共价修饰的位点和定制化的AI算法集成为数据集Druggability AtlasTM。Druggability AtlasTM是了解潜在治疗目标药物的起点,可以无缝集成和访问90%的人类蛋白质组及超过15万个蛋白质热点(hots pot)。
Frontier开发了特有的机器学习算法,利用Druggability AtlasTM库中的热点数据,对蛋白质相对反应区域的综合潜力进行优先级分类,并进入有效的机器筛选策略。
共价化学
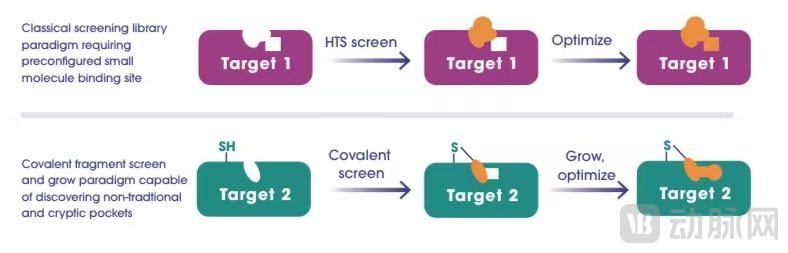
传统分子结合(上)与共价片段固定(下)制备比较
图源:Frontier Medicines
相比传统高通量筛选库的分子,共价片段复杂程度更低,因此更有可能与蛋白质上的“临时口袋”相结合。
共价药物与靶标结合形成化学键。当具有不明确的“临时口袋”或无序结构域时,化学键结合将为构建有效的药物分子提供锚点。当确定目标靶标的精确位点后,结合的共价药物将可以抑制蛋白质的疾病相关活性。
共价片段库
基于化学蛋白质组学的发现和共价化学的固定,Frontier定制专有的共价片段库,并搭载人工智能算法。共价片段库中将对小分子片段进行筛选,以识别那些可优先与研发重点蛋白质结合的片段。
利用高吞吐量的生物物理、生化和生物技术,Frontier的高通量蛋白质质谱平台每天可以运行数千个完整的蛋白质样本。根据蛋白质样本质谱结果,共价片段库采用高分辨率质谱法研究选择性结合的片段,以确定结合动力学、修饰位点和蛋白质组范围的选择性。一旦经过算法验证,特定片段命中率和药物设计将迅速推进。
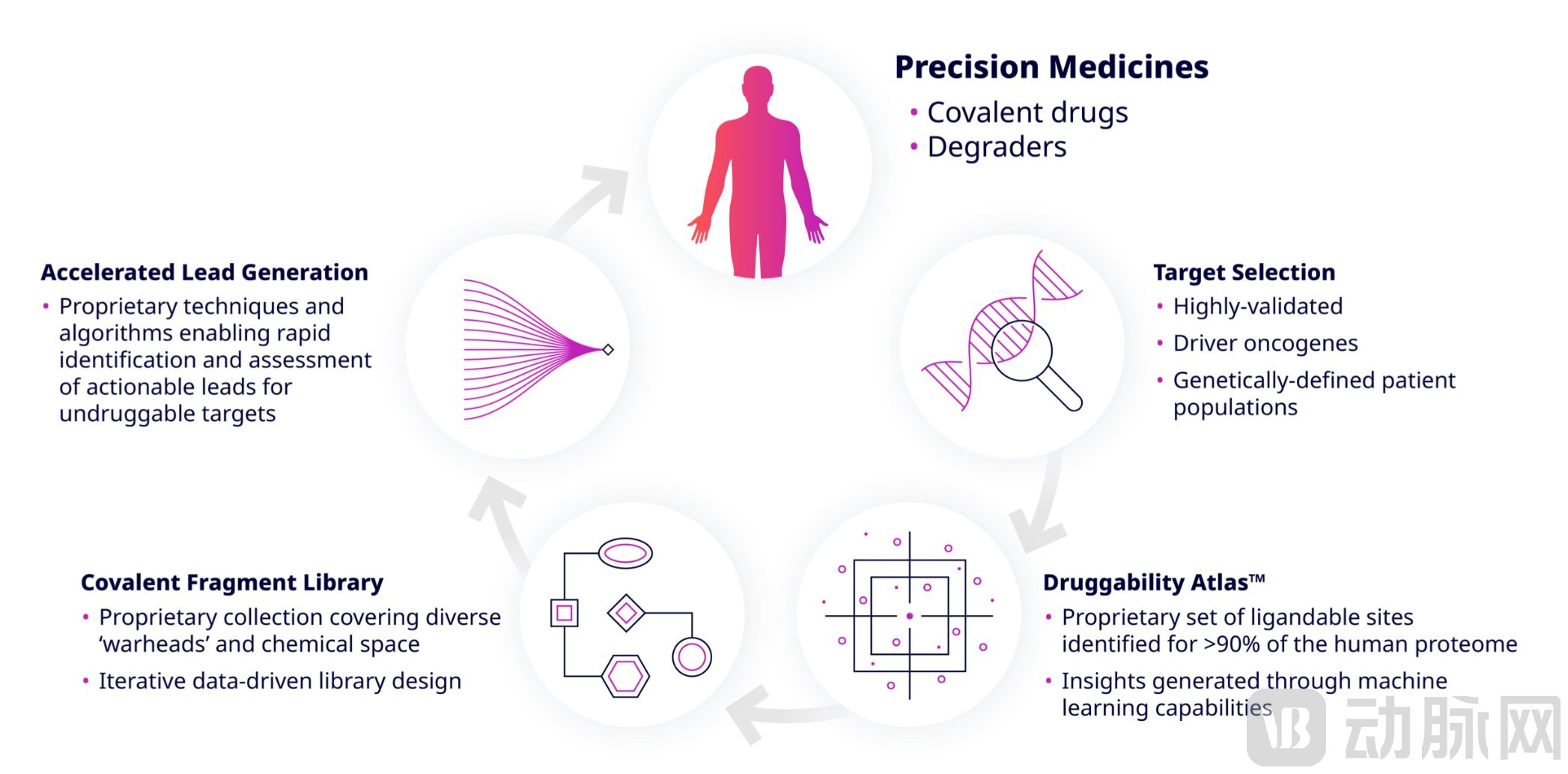
Frontier平台药物发现流程
图源:Frontier Medicines
基于其专有发现平台,Frontier布局了多条药物研发管线。首个靶点选在了KRAS(Kirsten大鼠肉瘤病毒癌基因同源物)——第一个被发现的人类肿瘤基因。
KRAS属于RAS超蛋白家族,其突变则在1982年被发现,目前已知与14%的人类癌症有关。KARS基因编码的蛋白是一种小GTP酶(small GTPase),参与多种癌细胞的信号传导功能。
在细胞内,KRAS蛋白在不活跃和活跃状态之间转变。当KRAS与鸟嘌呤核苷二磷酸(GDP)结合时,它处于不活跃状态;当与鸟嘌呤核苷三磷酸(GTP)结合时,它处于活跃状态,可激活下游信号通路。下游信号通路在促进细胞生存、增殖和细胞因子释放方面具有重要作用。
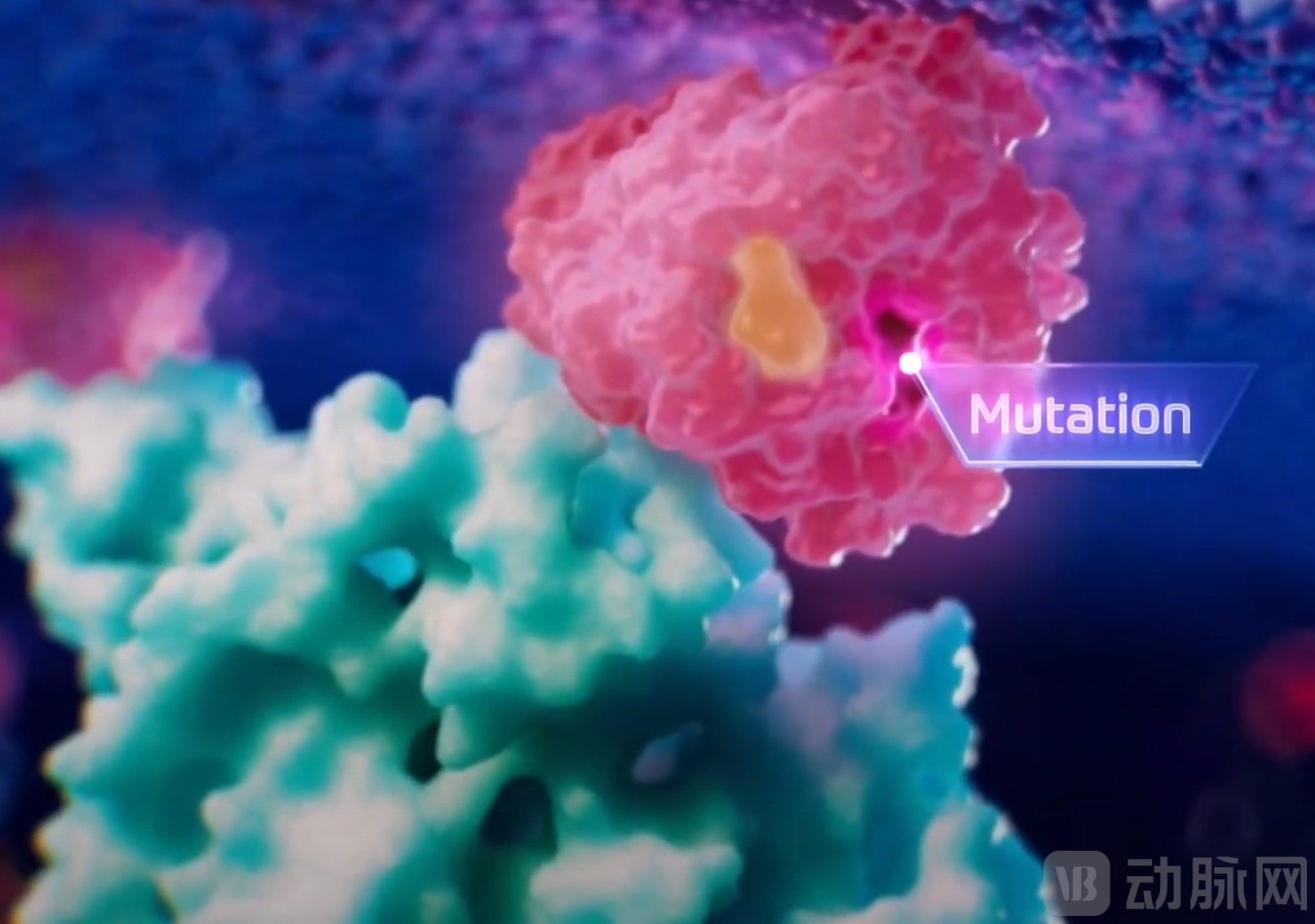
KRAS突变模拟
图源:Frontier Medicines
当KRAS发生突变后,KRAS会一直保持与GTP结合,将KRAS锁定在受体酪氨酸激酶活跃状态,并不断激活下游信号通路。下游通路的持续信号刺激将刺激细胞增殖、迁移,最终促成肿瘤发生。
理论上,用小分子靶向KRAS与GTP结合的位点可以抑制KRAS和GTP的相互作用。但是KRAS与GTP的亲和力非常强,而且细胞中GTP浓度非常高。这让直接靶向KRAS的GTP结合位点的抑制剂很难生效。
随着研究深入,使用异构位点(“临时口袋”)靶向KRAS突变体成为可能。药物FMC-376靶向的KRASG12C突变体就是KARS突变中的“临时口袋”。在KRASG12C突变体中,与胱氨酸共价结合的小分子更倾向与GDP结合的KRAS蛋白相结合。
FMC-376是一种共价小分子抑制剂:
1-具有高度蛋白质组选择性
2-限制非目标毒性
3-直接作用活性与非活性的所有KRASG12C突变
4-能够快速和持久抑制KRASG12C信号
5-克服受体酪氨酸激酶驱动的耐药性
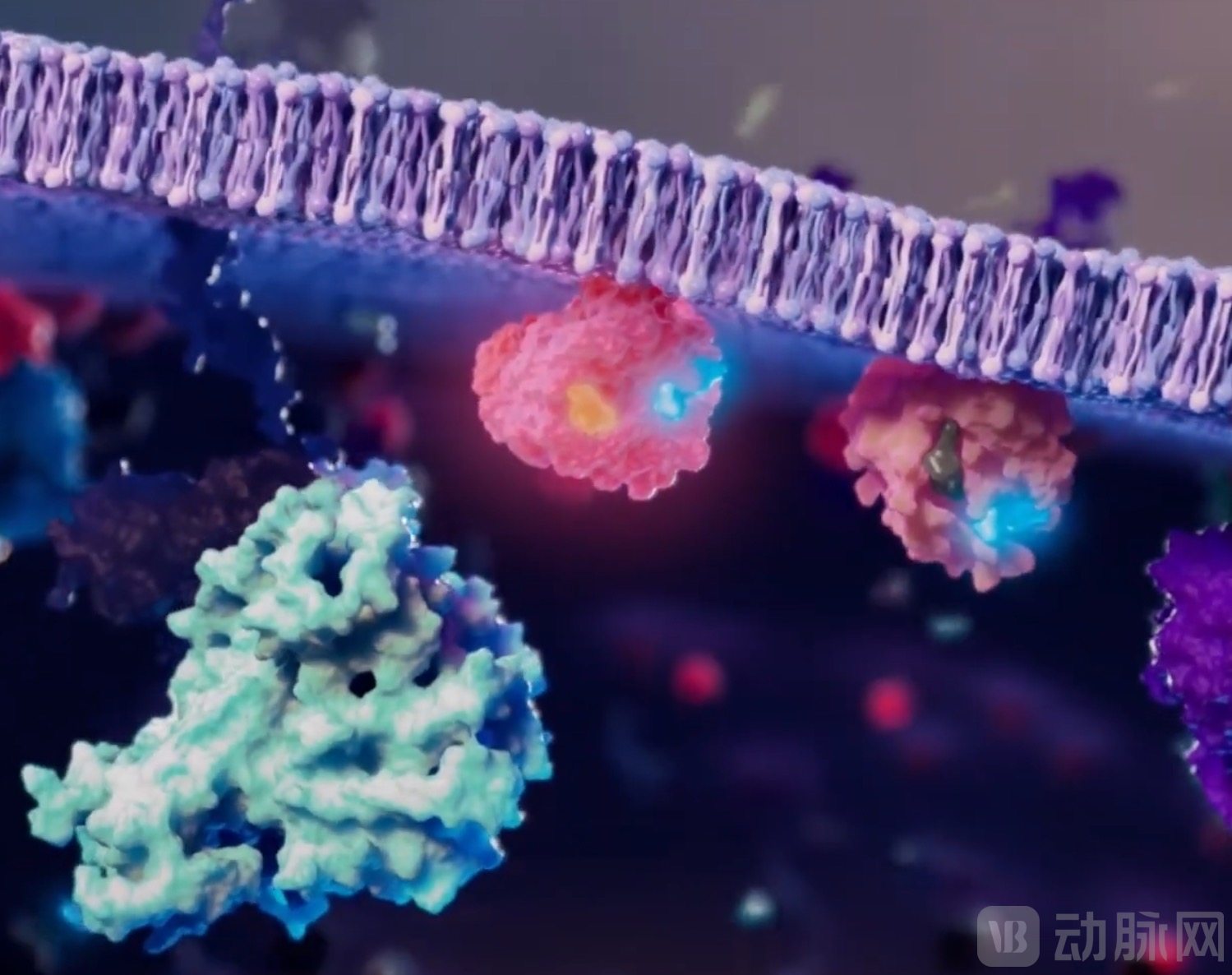
FMC-376同时作用于活性与非活性的KRASG12C突变
图源:Frontier Medicines
FMC-376的突出优势在于可直接作用活性与非活性的所有KRASG12C突变。这为克服治疗无反应和耐药性提供了新方案,且有效性更为显著。临床前数据表明,FMC-376在阻断关键效应蛋白相互作用中的有效性高出上一代抑制剂1000倍,并对上一代抑制剂耐药的模型表现出强大的活性。
FMC-376表现出广泛的活性和有效性,在非小细胞肺癌、胰腺癌和结直肠癌的多个CDX和PDX模型中表现出体内疗效。
2020年,Frontier与制药巨头AbbVie建立全球战略合作,以发现、开发和商业化针对“不可成药”蛋白质的创新小分子疗法管线。在这项合作中,Frontier平台技术将应用于免疫学,开发具有新型E3连接酶的下一代靶向蛋白质降解剂。靶向蛋白质降解剂将利用细胞自身机制,针对病理性蛋白质进行物理破坏和选择性去除。
在成功完成规定的临床前开发阶段后,AbbVie将承担全球发展和商业化活动以及项目成本的全部责任。除了商业化产品的特许权使用费外,Frontier将有可能获得超过10亿美元的开发和商业里程碑付款。
值得一提的是,AbbVie保留了将来扩大合作的权利,同时Frontier保留了其内部研发管线的全球独家权利。一方面,双线并进分散了独立研发的风险。另一方面,双线并进也为其研发团队和公司资金带来了更大的挑战。
2021年,Frontier完成8850万美元的B轮融资。同时,Frontier在波士顿建立分部,用于培养员工的研发专业支持,包括发现、临床前开发、转化医学和早期临床开发。Frontier的部门和团队将被拆分,同时在旧金山总部和波士顿分部工作。这一拆分计划包括从基础科学家到高级管理层的全部员工。资金注入与团队拆分将为其多管线同步开发提供支持。
目前,Frontier已有五条在研独立管线和三条合作研发管线。
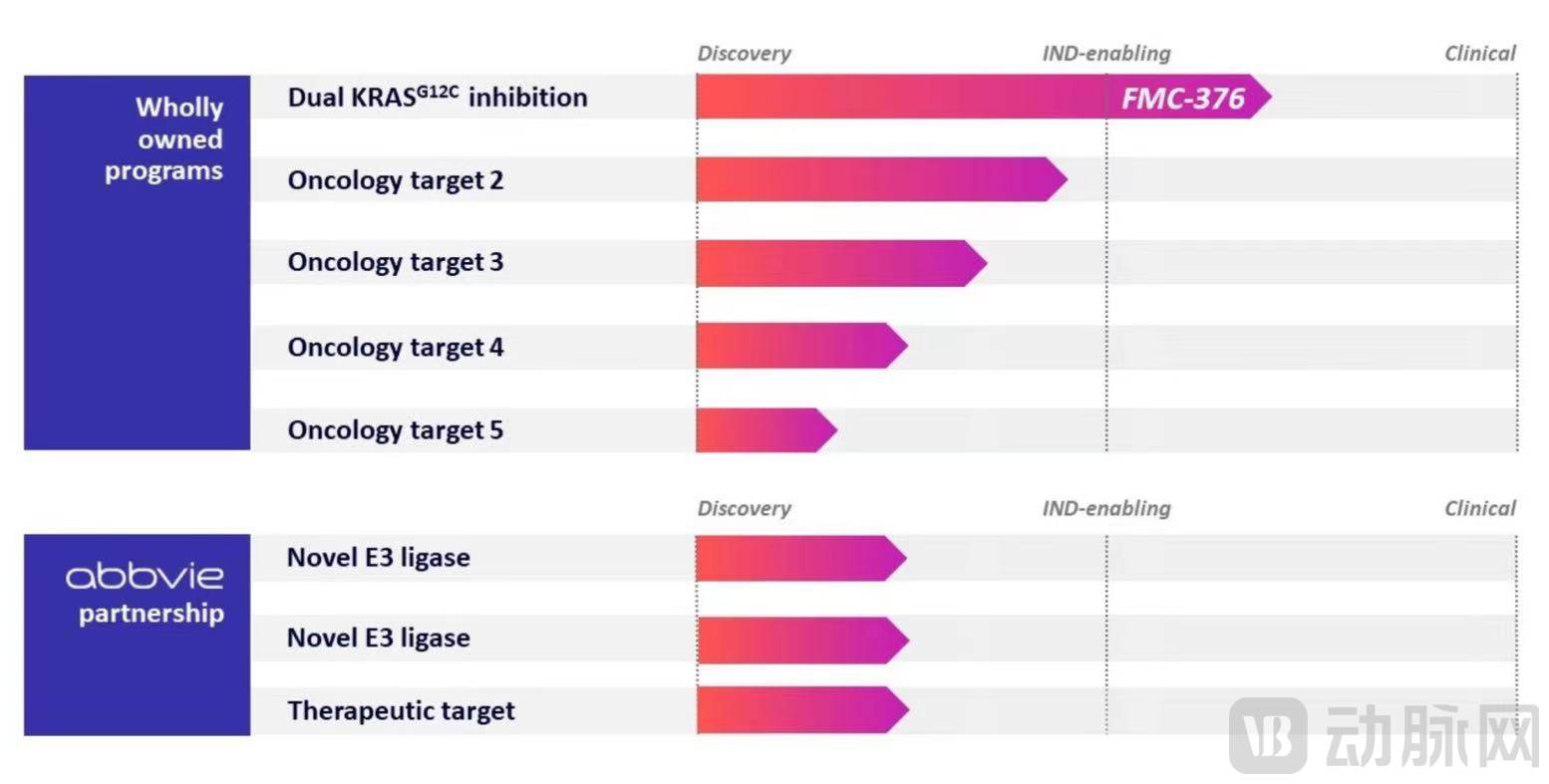
Frontier管线分布
图源:Frontier Medicines
这支长期扎根研发又不断灵活变通的团队,开始于一位资深VC投资者和两位分子和细胞生物学家的创始人组合。
董事长兼首席执行官Chris Varma博士是一名连续创业者和资深VC从业者。Chris Varma博士创立的Blueprint Medicines(纳斯达克代码:BPMC)也是一家靶向癌症的生物医药公司,其产品阿法替尼已在国内获批上市。
Daniel K. Nomura博士是加州大学伯克利分校分子和细胞生物学、化学生物学教授。他领导的野村研究小组一直专注于使用化学蛋白质组学平台寻找“可配对位点”,已开发下一代药物。
Roberto Zoncu博士为加州大学伯克利分校分子和细胞生物学、结构生物学副教授。Zoncu博士的研究重点是正常状态和癌症状态下生长调节的基本机制、细胞中营养素感知及其衍生信号的调节作用。他曾获得NIH创新者奖、Pew Stewart癌症研究奖学金、Edward Mallinckrodt, Jr.基金会奖学金和Damon Runyon-Rachleff创新奖。





























