今年代谢领域高潮迭起,不仅在MNC季报中可以看到GLP-1帮助持续释放佳绩,与代谢相关的Biotech也屡屡获得市场青睐。
GLP-1药物虽好,但安全性问题仍然悬起:EMA表示GLP-1类药物可能导致患甲状腺癌风险升高,要求礼来、阿斯利康、赛诺菲必须在7月26日之前提供GLP-1类药物补充信息;随后由于被报告患者在用药后出现自杀念头,EMA又公告启动对诺和诺德旗下三款产品的审查,包括Ozempic、Saxenda和Wegovy。
此外,各家公司都在积极研发依从性更高且疗效更好的口服剂型,而一天一粒的口服剂型比一周一针的注射剂型更需要注意安全性问题,以司美格鲁肽为例,口服版本比注射版本的剂量要大将近一百倍。
目前来看长期用药仍不可避免,但随着干细胞疗法、小核酸药物、基因编辑技术的进步,行业在追求代谢疾病的“一劳永逸”解法。
今年6月,CellTrans公司的细胞治疗药物Lantidra获美国FDA批准上市,这是全球获批上市的首款由胰腺细胞制成的同种异体胰岛细胞疗法,用于治疗一型糖尿病。
就在昨天,罗氏28亿美元引进Alnylam高血压RNAi疗法Zilebesiran,将1天要吃2次的降压药用药模式变为2次可以管1年。“肥胖+siRNA促使MNC回归代谢领域。”一位业内人士指出。
礼来通过已有的上市GLP-1药物与多款在研药物已经拔得市值头筹,但深知创新疗法对现有药物的潜在冲击,因此在密集加码相关代谢资产:包括以19.25亿美元收购Versanis Bio,一家专注于开发治疗心脏代谢疾病新药的Biotech;3亿美元收购Sigilon Therapeutics,加码糖尿病细胞疗法开发;以总价5.25亿美元押注与Verve Therapeutics在Lp(a)体内基因编辑疗法的合作等。
在代谢领域的漫长赛道上,这些创新疗法能够跑得出来吗?哪种方法更具优势或更值得关注?国内是否有公司在参与竞争?
胰岛细胞疗法,努力摆脱免疫抑制剂
干细胞疗法利用干细胞在特定条件下可多向分化和增殖的能力,可将其诱导分化为分泌胰岛素的β样细胞,再生和提高胰岛细胞的功能,达到治愈的目的。同时,干细胞还参与免疫调节、诱导免疫耐受,可重建胰岛的免疫平衡。众多药企都希望在该领域占据一席之地。目前,礼来、诺和诺德、赛诺菲,以及一些Biotech如Vertex、ViaCyte、Sernova、AltuCell、Semma Therapeutics、Beta-O2等在这一领域均有布局。
其中最受关注的在研产品之一是Vertex的VX-880,一种由同种异体干细胞衍生的、完全分化的、分泌胰岛素的胰岛细胞疗法。Vertex报告已有6名1型糖尿病患者在I/II期研究中接受了VX-880治疗后均产生内源性胰岛素,其中两名患者在接受VX-880治疗至少一年后可以脱离胰岛素治疗。
但是,VX-880需要长期的、防止细胞排斥反应的免疫抑制治疗。这也是胰岛细胞治疗的一大问题,即使疗效出众,患者仍然需要服用免疫抑制剂来防止免疫排斥,而且免疫免疫抑制剂可能会增加感染、肿瘤、肾脏损伤等不良反应的风险,需要定期进行检查和监测。一个长期的糖尿病患者即使经过40年,仍在遭受免疫抑制的预后风险威胁。
因此,Vertex公司还开发了VX-264,胰岛细胞被封装在“通道阵列装置”中,旨在保护细胞免受人体免疫系统的影响,VX-264设计通过手术植入,于今年3月获得IND批准。但封装装置材料又可能会限制细胞对血糖水平的反应能力。
已被FDA批准的Lantidra,在上市前也经受了FDA的多重质疑。Lantidra的临床试验包括两期非随机、单臂的研究,共有30名患者参与,其中5名受试者效果不佳,无法摆脱胰岛素;另外,大多数受试者都出现了至少一次与免疫抑制剂相关的严重不良反应。因此,FDA专家们针对Lantidra临床数据的有力性和其安全性,开过一场专家咨询委员会。
“干细胞来源的细胞疗法还可能造成畸胎瘤。”临港蓝湾资本的严顺飞博士指出,“糖尿病并不会导致病人直接死亡,只是平时生活比较麻烦。但未完全分化的干细胞疗法引起的畸胎瘤是一个严重风险,此前有过案例报告,这种代价未免过于高昂。”
“同时,注射胰岛素的方法也越来越先进。比如美敦力等公司在做的人工胰腺(CGM+胰岛素泵闭环系统),提供了高效、安全且具有性价比的解决方案。而胰岛细胞疗法价格不菲,安全性和有效性还需要长期验证,患者肯定会考虑经济性上以及风险获益上是否划算。”
Lantidra的治疗费用预计平均每年超过30万美元,还不包括免疫抑制剂的费用。
但这些都未阻挡胰岛细胞疗法的发展势头,就在Lantidra被批准的转天,礼来宣布斥资逾3亿美元收购Sigilon Therapeutics,Sigilon将与礼来合作开发用于治疗1型糖尿病的封装细胞疗法。
国内也开始有公司涉足这一领域,成立于2021年的意胜生物已建立了多能干细胞分化胰岛药物管线(ESN5800),并配套开发了与生物材料相结合制作胰岛或其他类细胞产品的包裹技术。
基因编辑仍处于非常早期
细胞治疗与基因编辑有着紧密的关系,2022年2月,CRISPR Therapeutics和ViaCyte的VCTX210创造了历史,首次进行了基因编辑、干细胞来源的胰腺细胞的人体移植,以治疗1型糖尿病。ViaCyte目前已被Vertex收购。
VCTX210通过CRISPR的基因编辑技术,敲除T细胞攻击有关蛋白表达,进而达到保护移植细胞免受免疫排斥的目的,这意味着患者接受VCTX210细胞产品移植无需使用免疫抑制剂。目前VCTX210评估治疗1型糖尿病的安全性和耐受性的I期临床试验已经完成给药。
另一家Biotech,Genprex公司在2023年2月发表的一项动物研究结果,介绍了其管线GPX-002在探索治疗1型糖尿病的基因编辑方法。
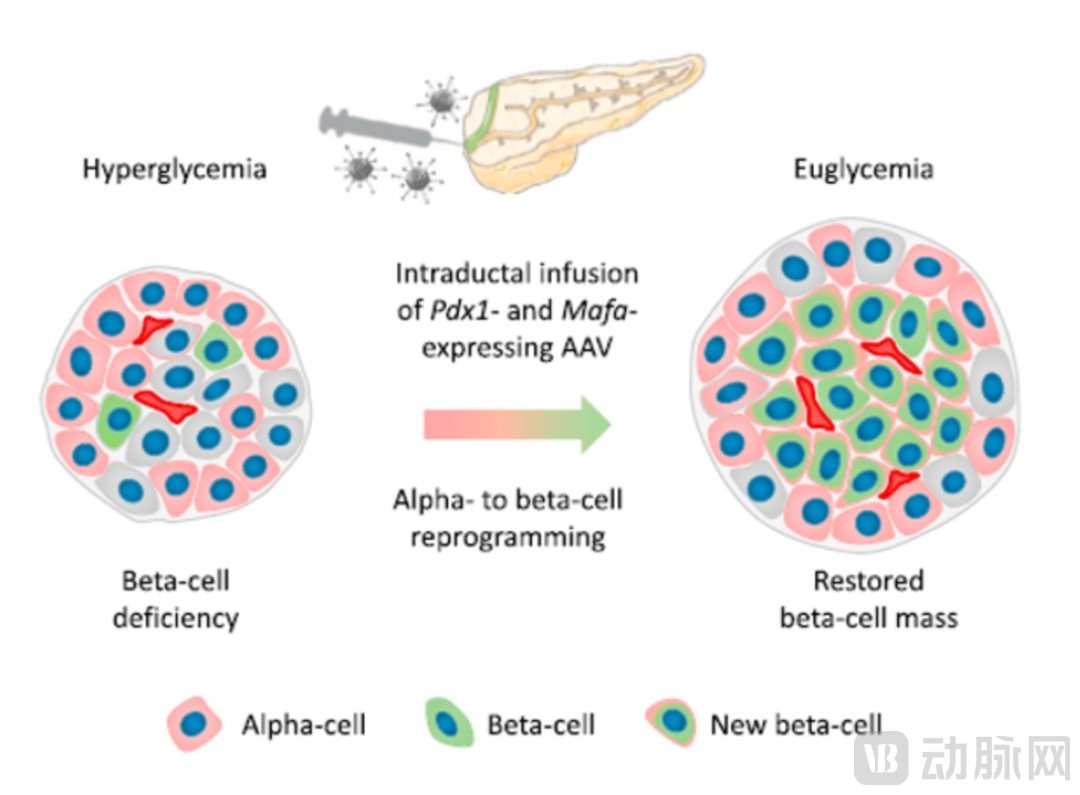
GPX-002机制示意
GPX-002使用AAV载体将Pdx1和MafA基因传递到胰腺,这两个基因表达的蛋白可以将胰腺中的α细胞转化为功能性的β样细胞,β样细胞可以产生胰岛素,但与β细胞有明显区别,可以逃避人体的免疫系统。在动物试验中,GPX-002可将糖尿病小鼠的血糖恢复至正常水平,并维持4月之久。
在降脂领域基因疗法中,近期的重要消息来自礼来,公司以总价5.25亿美元押注与Verve在Lp(a)体内基因编辑疗法的合作。Verve将通过完成1期临床开发来推进Lp(a)项目的研发。礼来将负责Lp(a)项目的后续开发、制造和商业化。
此前最受关注的降脂领域管线之一是Verve的VERVE-101,该疗法靶向PCSK9,用于治疗杂合子家族性高胆固醇血症,于2022年7月完成了首例患者给药。按照公司说法,该药可以“一针预防心脏病”,但在去年12月被FDA暂停。VERVE-101兼具体内编辑与碱基编辑的双重属性,使得FDA要求Verve提供更多安全数据。
基因编辑疗法更加强大,但改变基因组构造后有多种突变或致癌风险,包括。目前多款代谢相关基因疗法仍处于非常早期,距离上市以及FDA要求的治疗后15年随访相差甚远。针对不会直接威胁患者生存的代谢疾病,一劳永逸但潜在风险和费用都更高的基因疗法是否受青睐还要打一个问号。
小核酸,更加“踏实靠谱”?
对慢性病来说,小核酸药物具备明显优势:由于其在人体的的半衰期长,通常可以做到半年到一年给药一次,极大提升患者依从性。目前已经有5款siRNA疗法获批上市,治疗罕见和常见肝脏驱动的代谢疾病。
Inclisiran作为第一款面向常见病高血脂的小核酸新药,进入美国市场后2022年收入大涨833%至1.12亿美元,这款PCSK9靶点的siRNA药物,注射一剂疗效可维持半年。近日更有Alnylam与罗氏的RNAi治疗药物zilebesiran,以变革高血压治疗模式。小核酸药物的吸引力可见一斑。
“小核酸药物的模式是非常不错的,靶向性与选择性都非常好,另外小核酸药物已有多款药物获批,药物安全性也相当不错。从有效性上来看,以Inclisiran长期跟踪数据为例,4年平均LDL-C降幅达44.2%,对多数患者来说够用。目前上市和数据较好的小核酸药物主要针对脂代谢与胆固醇代谢等领域,未来获批药物也可能拓展至减肥、降血糖领域,甚至尝试与GLP-1联用。”严顺飞博士表示。
小核酸药物龙头Ionis目前正在开发一种靶向胰高血糖素受体的ASO疗法IONIS-GCGRRx。胰高血糖素是胰岛α细胞分泌的激素,它对抗胰岛素的作用,增加肝脏葡萄糖的合成。在2型糖尿病患者中,胰高血糖素水平提高,导致在空腹情况下的高血糖。胰高血糖素还可能在脂质代谢中起到重要作用。
在接受二甲双胍治疗的2型糖尿病患者中进行的Ⅱ期临床试验显示,IONIS-GCGRRx可以显著降低患者糖化血红蛋白(HbA1c)水平。
目前这款药物在国内由瑞博生物获得该产品在中国的独家研发和商业化权利。今年2月,瑞博生物宣布针对2型糖尿病的两项II期临床试验顺利完成,两项临床研究均达到主要研究终点。
据瑞博生物,该产品可通过双重作用机制发挥降糖作用,即在降低肝葡萄糖生成量的同时,又可升高GLP-1产生胰腺保护功能,有望满足对仅能通过对胰岛素通路进行干预但疗效不佳患者的临床需求。
“几个新的方向中,我个人还是比较看好小核酸赛道,无论是从风险与性价比来看,还是目前的成熟度和成药性,小核酸都更像典型意义上的药物。”严顺飞博士总结道。




























