编者按:本文来自上海生物医药基金,作者陈宇城、刘雅安,动脉网获权转载。
蛋白质组学作为蛋白质组实验和数据分析的结合,从整体上概括了蛋白质的组成、结构、表达、修饰状态以及蛋白质之间的相互作用和联系,为基因组学和转录组学提供重要补充信息。本文章主要浅析了不同的蛋白质检测技术流派(不局限于高通量)在蛋白质研究中的应用,并且根据科研和临床诊断等不同的应用场景分类讨论,展望未来的发展趋势。
目录
一、蛋白质组学分析技术发展的“两条腿”
二、“既要又要”,超灵敏的多重检测
三、蛋白质组PTMs检测质谱仍是主流,纳米孔测序有潜力成为黑马
四、蛋白质组学下游应用处于早期开发阶段,市场潜力巨大
五、国内外蛋白质组检测公司发展对比
六、蛋白质组学的发展空间巨大,更看好有开发新标志物能力的平台
蛋白质组学是包括从基础科学角度或临床角度分析蛋白质的研究领域。其中,对蛋白质丰度、翻译后修饰(PTM)引起的蛋白质形式多样性,以及稳定或瞬时的蛋白质-蛋白质相互作用的探索,对疾病研究和相关临床转化尤为重要。蛋白质组的信息对于明确机体复杂、相互关联的分子信号网络也至关重要,这些分子信号网络直接控制细胞增殖、分化、衰老和凋亡等主要生命活动。
尽管测序技术已经十分成熟,但mRNA转录丰度仅提供细胞状态的间接测量,并不能可靠地预测蛋白质丰度差异。这些数据未能揭示PTMs的变化,包括磷酸化和蛋白质降解,也无法全面了解疾病机制[1]。因此,蛋白质组学检测技术的发展,对于揭示疾病背后的分子机制以寻找新的治疗靶点,发现用于诊断及疾病预后的新型生物标志物至关重要。
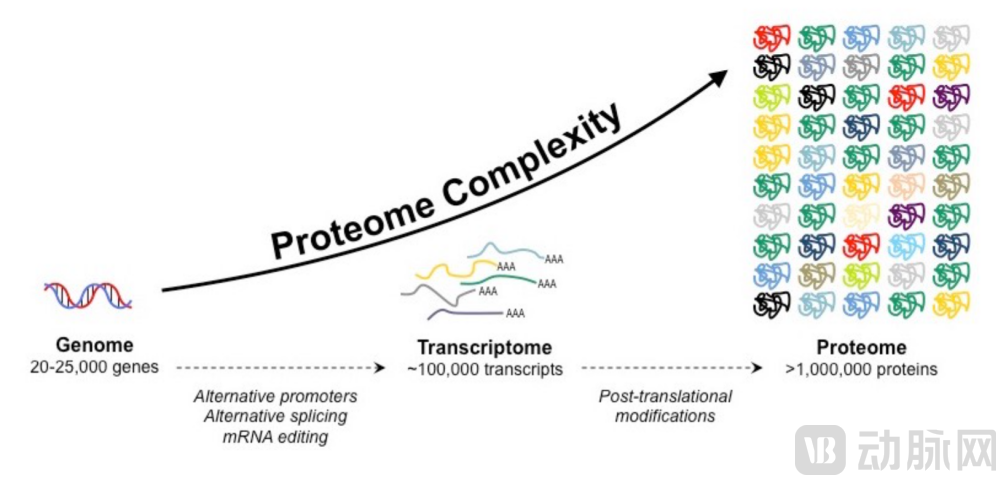
▲蛋白质组学的信息多样性[3]
一、蛋白质组学分析技术发展的“两条腿”
蛋白质组学的传统检测方法包括免疫组织化学染色(IHC)、蛋白质印迹(WB)和酶联免疫吸附测定(ELISA)等,但Elisa等技术的性能已经不能满足日益精细的科研和临床需求。继而各类新兴技术应运而生。
▲不同蛋白质组学技术的发展
1、提高检测下限
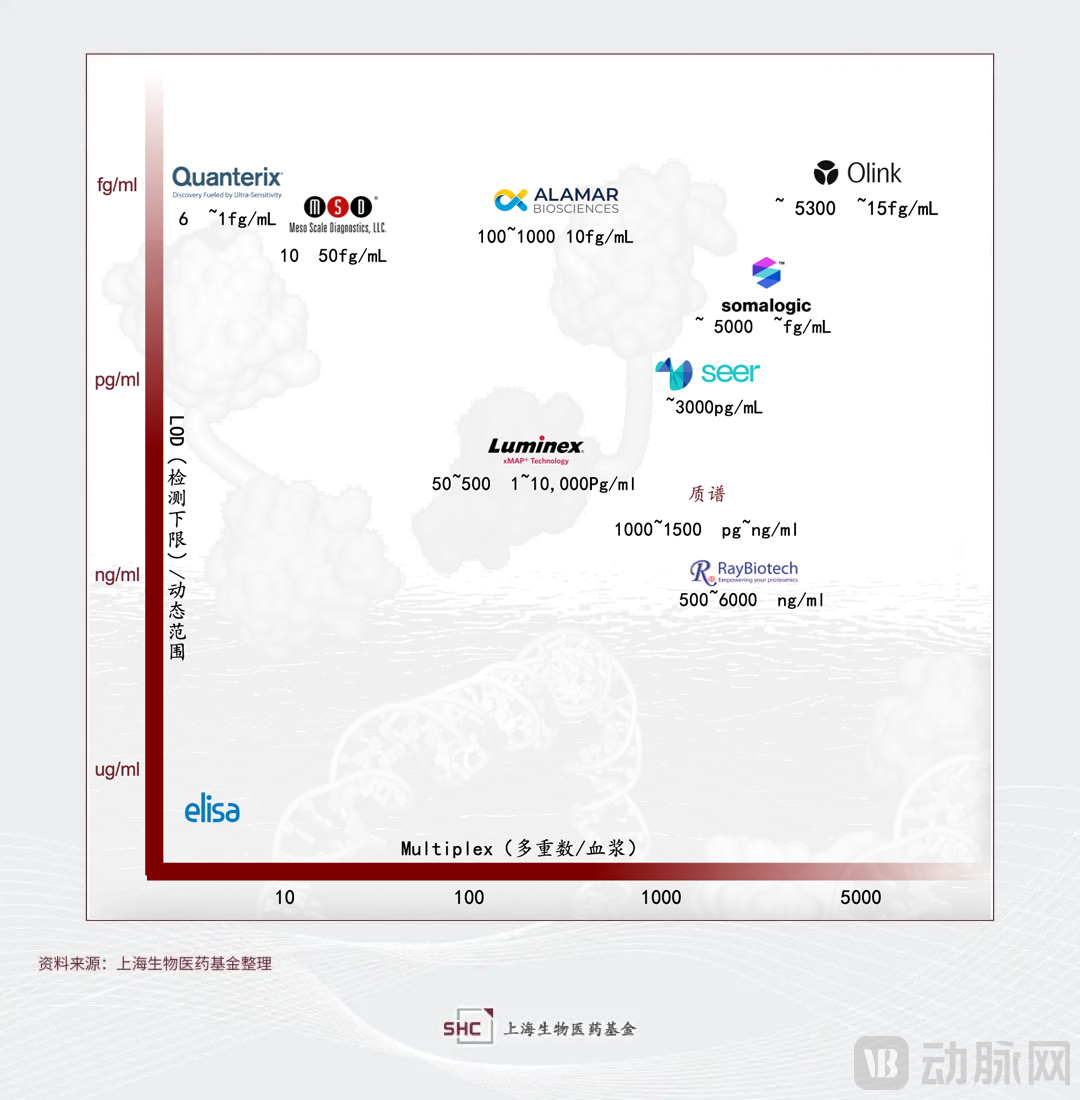
“单分子” Quanterix技术以及Meso Scale Discovery (MSD)电化学等技术的出现显著提升了蛋白组学研究的检测下限和灵敏度。其中Quanterix的技术平台Simoa通过改进传统的夹心ELISA技术,在微孔中对单个分子进行酶反应,微孔比传统ELISA的孔径小25亿倍,检测灵敏度极大提高。MSD也是基于ELISA基本原理的升级,在MULTI-ARRAY和MULTI-SPORT微孔板的电极表面通电后,表面的SULFO-TAGTM标记物由于电化学作用被激发并发出强光,通过点阵技术在96孔石墨电极板里可实现10个指标/每孔的检测。
2、提高检测重数
随着固相蛋白芯片技术和液相芯片技术(又称流式荧光)等检测技术的出现,蛋白组研究的检测重数实现了大幅提升。值得重点提出的是液相芯片,尤其是Luminex系统的xMAP®技术平台,用不同配比的两种或三种红色分类荧光染料将直径为5.6微米的聚苯乙烯微球染成不同的荧光色,从而获得多达100~500种荧光编码的微球。该微球编码的技术壁垒非常高,需要在实现多重编码的同时,保证荧光编码的稳定均一性。Luminex在2021年被意大利诊断集团DiaSorin以18亿美元的价格收购,据财报显示2022年收入为3.86亿欧元。早年透景生物将其技术引进并开发下游应用产品如肿瘤标志物多联检等,近年国内在细胞因子多联检方面的市场也有所增长。
二、“既要又要”,超灵敏的多重检测
超高通量白质组的分析方法主要有全系统和无偏倚的串联质谱法(LC-MS/MS)和高灵敏度的靶向免疫测定技术邻近延伸分析(PEA,OLINK)及基于适配体的SOMAscan(SOMALOGIC)[2]。
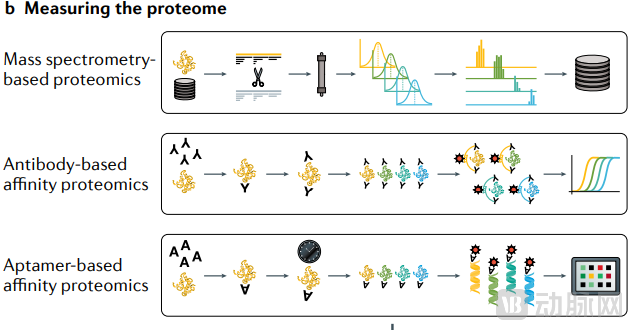
▲超高通量蛋白组的检测方法[2]
1、基于MS的方法:质谱的使用已经拥有庞大的用户群体且拥有可靠的蛋白质鉴定和翻译后修饰等优势,缺点是样本通量且灵敏度不够,不适用于大规模组学分析以及低丰度蛋白的分析。
2、基于抗体亲和的方法:样本通量和蛋白通量显著提升,但是存在潜在脱靶(特异性不足)、可重复性差和对于翻译后修饰检测难等问题。以Olink公司为代表[9],其发展十分迅速,2022年营收1.4亿美元,同比增长47%。2023年10月,Thermo Fisher以每股普通股26美元现金收购Olink,比最后一个收益日的收盘价高出约74%,总收购价高达31亿美元。
3、基于aptamer亲和的方法:样本通量和蛋白通量显著提升,相比于抗体亲和,aptamer的优势在于亲和力更高,更容易实现高重复性。而且aptamer的开发筛选比抗体的开发更快,难度更低。缺点是aptamer基于结构适配的特异性只有73%[7]。该技术以SomaLogic公司为代表,2021年的营收仅为8160万美元。除了科研领域,SomaLogic还在开发的LDT测试超过100项,主要针对临床试验应用,寄希望于能够借助下游应用打开格局。

▲不同高通量蛋白质组学分析技术对比
2020年Stefanie M. Hauck团队利用来自德国南部173人的循环血浆蛋白样本,测试了LC-MS/MS在数据依赖(DDA)和数据独立采集(DIA)模式下的性能以及与PEA Olink的对比[8]。总结来说,当重点关注血浆中的小部分蛋白(往往是低丰度的蛋白)时,需要借助高灵敏的PEA技术,或者进行panel search进行匹配,但如果只是关注较高丰度的蛋白(ug/ml~ mg/ml)则也可以应用基于DIA、DDA的质谱技术进行血浆蛋白的检测。
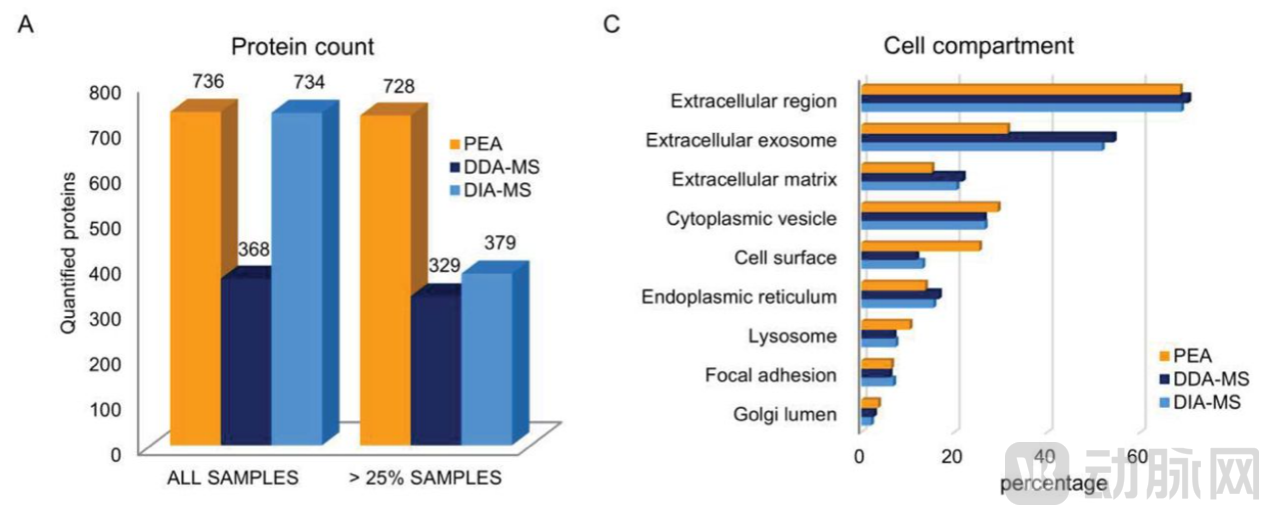
▲PEA、DDA-和DIA-MS鉴定的蛋白质的重叠分析[8]
三、蛋白质组PTMs检测是重要方向,纳米孔测序有潜力成为黑马
翻译后修饰(Post-translational modification,PTMs)将化学基团以共价方式附着在蛋白可修饰残基的侧链上作为分子开关,并导致修饰位点的化学性质发生变化。PTMs通常出现在具有重要结构/功能的蛋白质中并广泛地影响蛋白质行为和特征,包括酶功能和组装、蛋白质寿命、蛋白质-蛋白质相互作用、细胞-细胞和细胞-基质相互作用、分子运输、受体激活、蛋白质溶解度、蛋白质折叠和蛋白质定位[14]。因此,这些修饰涉及多种生物过程,如信号转导、基因表达调控、基因激活、DNA修复和细胞周期控制,在众多生物过程中发挥关键作用。
迄今为止,Uniprot数据库中记录了400多种不同类型的PTM,其中磷酸化被认为是蛋白质最重要的PTM并被广泛研究[13],其中包括肿瘤、线粒体能量代谢和激素信号的反应及酶功能测定等。
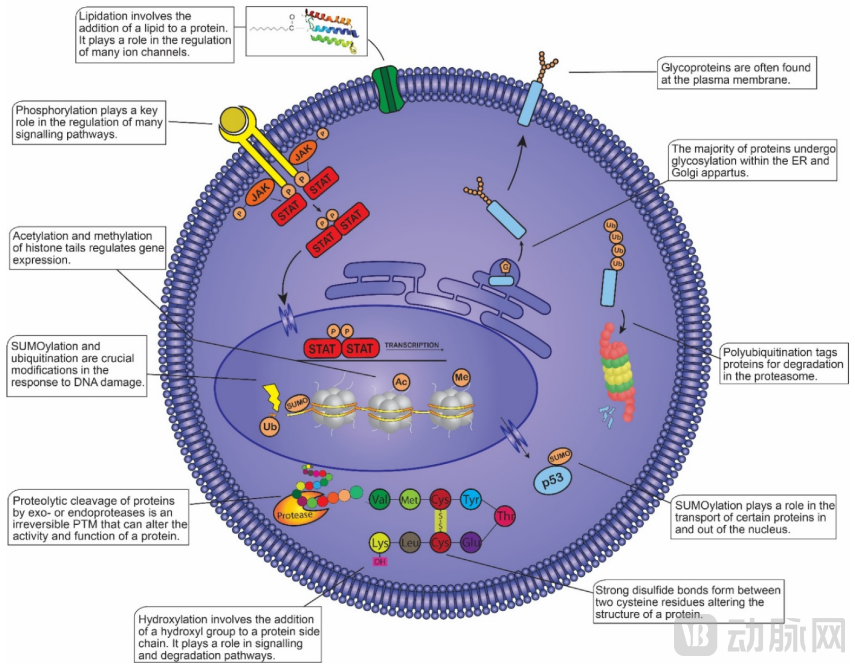
▲哺乳动物细胞内的翻译后修饰及其功能[4]
对蛋白质翻译后修饰进行大规模、高度特异性的定量分析,目前最强大的分析技术仍是质谱。但由于浓度过低,在质谱分析前往往需要对感兴趣的PTM进行修饰特异性富集,如离子交换层析、固定金属离子亲和层析和免疫亲和层析,以提高分析效率和可靠性[4]。但质谱分析PTM也存在痛点,除了需要富集以外,在前处理过程中的修饰丢失和碎片化都会影响结果的准确性。
由于翻译后修饰的差异小,化学结构也较为相似以及抗原性差等问题,用于特定蛋白PTM检测的特异性抗体的亲和力往往较低。目前,泛PTM特异性抗体通常用于LC-MS/MS以及蛋白质印迹、蛋白质微阵列、免疫组织化学和流式细胞术等前处理过程的免疫亲和富集。
基于纳米孔的蛋白测序是非常有潜力的方法,然而纳米孔蛋白测序面临着与蛋白质复杂性相关的挑战,包括蛋白异质性和氨基酸侧链残基以及未折叠蛋白质通过纳米孔运输的限制。相比于核酸测序,蛋白质不仅折叠得更紧密,破译20种氨基酸也比读取4种碱基更具挑战性。纳米孔蛋白传感器技术目前仍处于起步阶段,实现准确检测的前提是需要赋予氨基酸更具体的特征或提高生物纳米孔的空间分辨率。
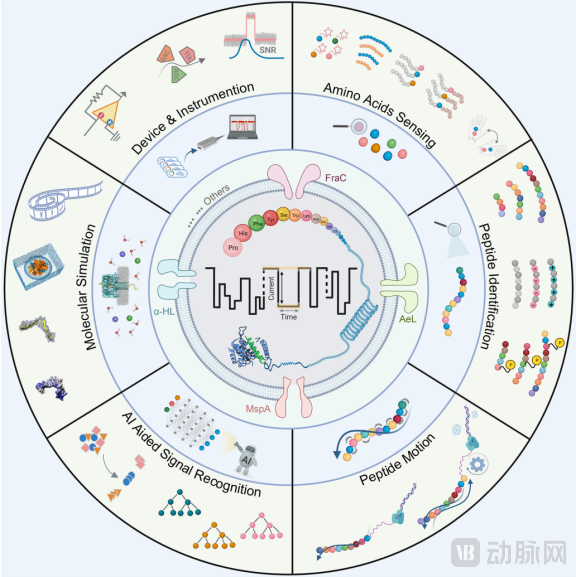
▲生物纳米孔技术实现蛋白测序需要的工程化方法[6]
尽管最近的研究进展表明可以通过纳米孔传感直接或结合PTM特异性标记来实现PTM鉴定,但目前成功的应用仍然局限于磷酸化和糖基化检测[6]。首先,数百种PTMs在纳米孔内产生的信号的重叠,不可避免会降低识别的准确性。其次,一些PTMs的分子质量大大超过氨基酸,难以通过纳米孔转运。再者,蛋白质测序所必需的某些酶也可能影响或改变PTMs,干扰检测结果[5]。但如果能在工程上解决上述问题,能够以直接读取的方式快速获取蛋白的序列和PTM信息,将打开蛋白质组研究的新格局。
四、蛋白质组学下游应用处于早期开发阶段,市场潜力巨大
目前蛋白质组学的下游开发探索从临床切入,同时布局在药物研发全链条和诊断标志物开发。
1、新靶点发现
血液中循环的蛋白来源于多种器官和细胞类型,由主动分泌和被动运出的蛋白质组成。循环蛋白可以使用传统的小分子或大分子如单克隆抗体直接干预,是非常有价值的潜在药物靶点。
2020年辉瑞牵头,对90种心血管相关蛋白进行了全基因组荟萃分析,其中许多是已确定的预后生物标志物或药物靶点。使用Olink心血管(CVD)panel对15项研究中的30931名个体进行了测量,鉴定了85种循环蛋白的315个初级和136个次级pQTL[10]。
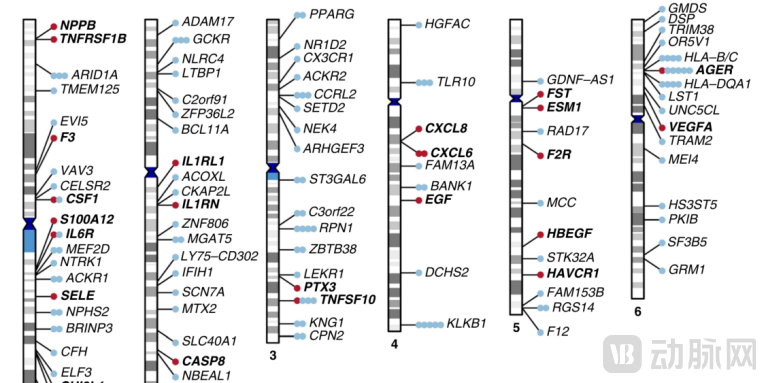
▲顺反式pQTL的挖掘及关联的染色体定位[10]
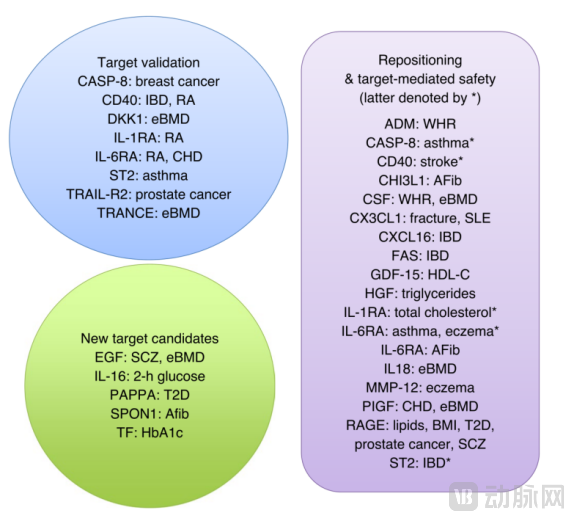
▲蛋白质-性状关系以及药物开发的新候选靶点[10]
对已确定的蛋白质数量性状基因位点(pQTL)进行孟德尔随机化,并使用38种常见疾病的生物库遗传数据进行pQTL数据的因果关系评估。最终发现了25种蛋白质与疾病的因果关系,其中11种是新的,涉及类风湿性关节炎、骨质疏松症和糖尿病等适应症。
基于蛋白质组学及pQTL的框架解决了与药物开发相关的几个关键挑战:
a) 蛋白质调控信号通路的绘制;
b) 新候选靶点的鉴定;
c) 药物的重新定位;
d) 靶点相关的安全性;
通过蛋白质生物标志物将靶点机制与患者匹配。
2、辅助临床入组和患者管理的伴随诊断标志物的开发
根据QLS对Informa 和Trialtrove数据库的统计数据显示,采用了标志物做患者筛选的临床二期成功率可以显著提升[11]。
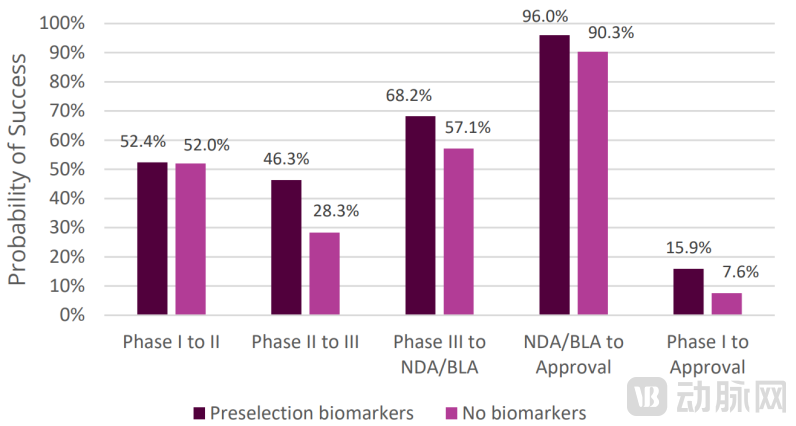
▲不同临床阶段采用标志物干预患者入组对临床成功率的影响[11]
2021年Rucevic等利用蛋白组学技术[12],前瞻性纳入诊断为I期或III期NSCLC并计划进行治疗性放疗的患者,并筛选出免疫相关蛋白释放较多的患者会是PD-1联用的潜在受益群体。在I期NSCLC患者中,CD244(免疫调节跨膜受体家族的信号淋巴细胞激活分子SLAM)被确定为negative预后生物标志物。在III期NSCLC患者中,CR2(补体C3的受体)和IFNGR2(IFN-γ受体的其中一个单体)被确定为positive预后生物标志物。
由于使用传统风险因素评估方法的医生在计算和应用患者管理风险评分方面存在困难。2022年Somalogic开展了一项随机对照研究,招募了248名医生并测试SomaLogic的SomaSignalTM检测是否能帮助医生对患者的心血管疾病进行风险分层,探究个体化蛋白质组心血管风险评估是否可以发挥积极作用,使药物更有效地分配,改善患者的预后。比如医生可以根据检测结果,给予高风险患者SGLT2抑制剂或GLP-1受体激动剂等控制血糖的药物。
3、临床诊断新标志物开发
临床诊断的应用一直是更容易放量的市场,各个蛋白组学公司也争先在该领域布局。其中Somalogic开发了LDTs场景下的19项SomaSignalTM检测(仅需55 μl血液样本),涵盖脂肪含量、葡萄糖耐受、心脏疾病风险、NASH相关炎症和心力衰竭等。该检测是通过使用SomaScan Assay分析数千名患者的数千种蛋白质而开发,将SomaScan检测显示的蛋白质特征与标准临床测量结果进行比较,以便使用机器学习识别与当前健康状况和未来预后相关的蛋白质变化模式。
Quanterix的Simoa诊断试剂开发更集中在神经系统相关疾病,其中包括pTau217(Lilly及Janssen合作)、pTau181、GFAP、NfL(Biogen合作)和VEGF(NOVARTIS合作)等项目都已经分别与不同的药企在药物开发临床阶段展开合作。
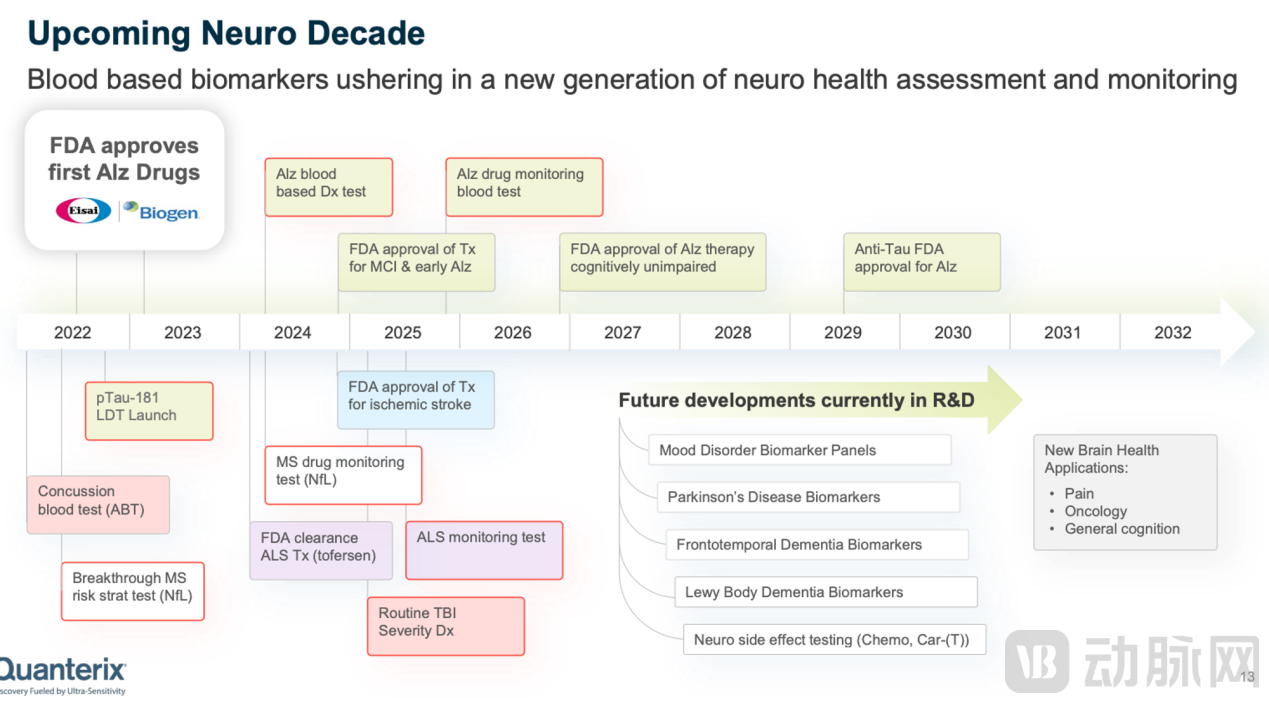
数据来源:Quanterix官网
▲Quanterix的诊断标志物开发规划
血清神经丝轻链(sNfL)是神经元损伤的一种生物标志物,在与轴突损伤或变性有关的中枢神经系统和周围神经系统疾病中,已经发现脑脊液(CSF)和血液中的神经丝轻链(NfL)浓度增加。对轴突损伤情况的定量测量,如NfL水平的检测对掌握各种神经系统疾病的预后有重要价值。2022年Jens Kuhle团队[12]发表了利用NF-light assay (Quanterix)检测血浆NfL,在欧洲美国入组健康对照人群用于建立sNf Z-score(调整后的sNfL与对照群体值的偏差)值参考数据库,从5390人中获得了10133份血液样本。从多发性硬化(Multiple sclerosis)的1313名患者中获得了7769个样本。
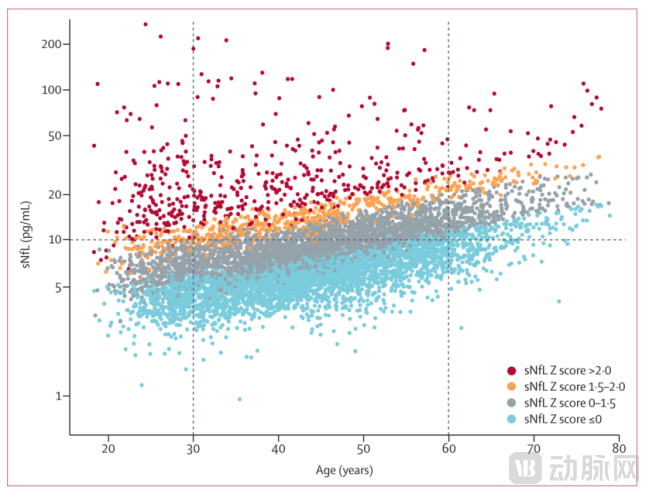
▲多发性硬化组中不同年龄段患者的sNfL Z scores[12]
经过修正后的sNfL cutoff为10 pg/mL(mean CV=5.2%),sNfL浓度随年龄呈指数增长并在约50岁后增速更快,未来急性(如复发和病变形成)和慢性(残疾恶化)疾病活动的风险逐渐增加。在所有多发性硬化症患者中,sNfL Z-score高于1.5与未来临床疾病活动的风险增加相关(P<0.0001),并且在没有疾病进展证据的人群中被认为是稳定的(p=0.034)。研究通过对影响因素的分析还发现,与未经治疗的患者相比,单克隆抗体治疗比口服治疗更有效,而口服治疗(芬戈莫德、西尼莫德)比干扰素等更有效。
Luminex的诊断产品并不多,集中在呼吸和胃肠道的核酸检测。授权技术集团(LTG)模式是Luminex的重要收入来源,截至2020年12月Luminex拥有82家战略合作伙伴,其中54家发布了基于xMAP系统的商业化产品。由于其独特的授权及合作伙伴驱动的商业模式,加之以透景为代表的企业在2003年就进入下游应用开发领域,国内的蛋白多重检测开展的如火如荼,且有集中在细胞因子多联检方向的趋势。
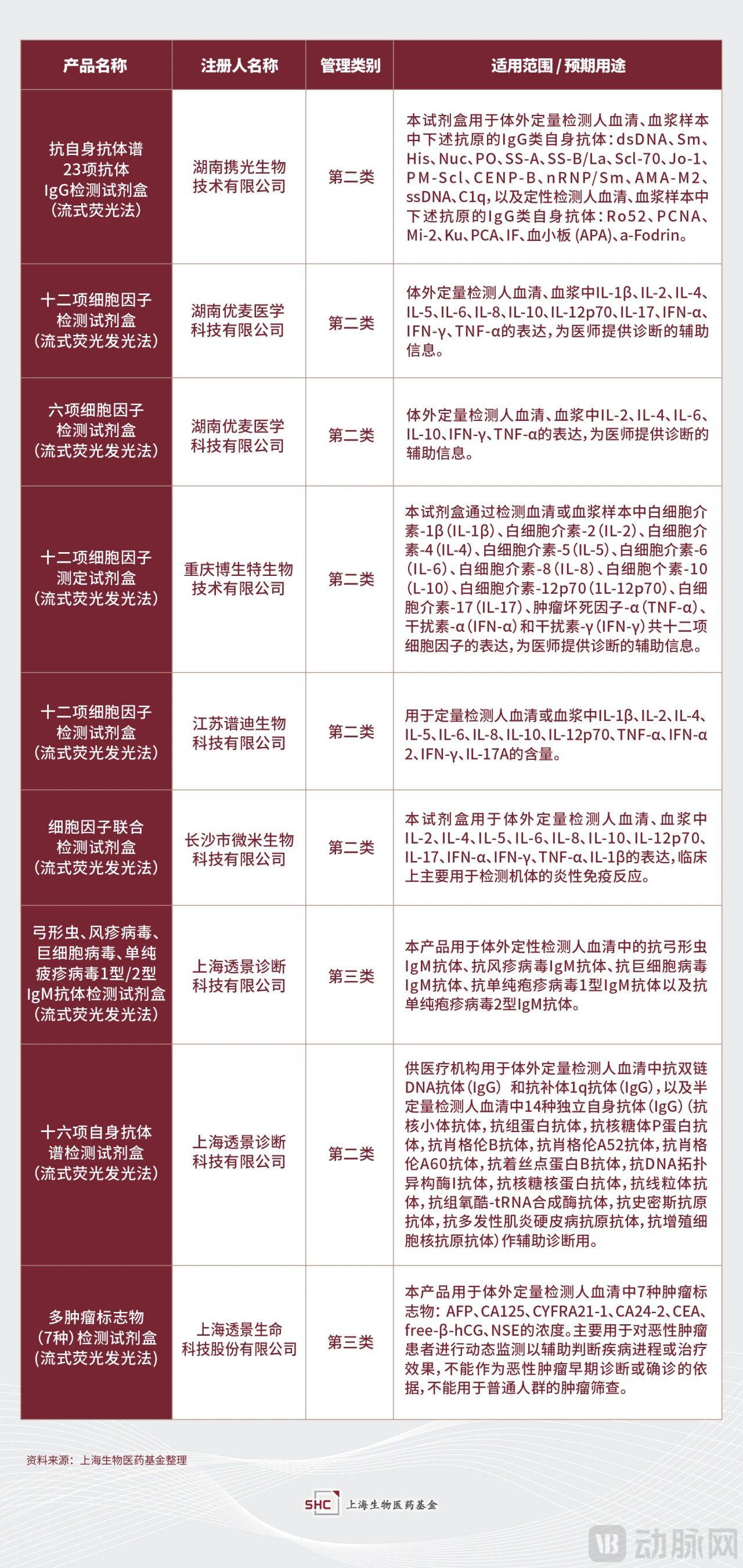
▲部分流式荧光临床检测项目
五、国内外蛋白质组检测公司发展对比
从发展角度来看,国外的蛋白质组学公司起步较早,发展得好的公司已经陆续上市。在超灵敏方面有Quanterix和Meso Scale Discovery等,在多重方面有Luminex,兼备超多重和超灵敏的有Olink、Somalogic和Alamar。从目前发展结果和营收来看Luminex和Olink是相对成功的,显然在不牺牲灵敏度的情况下,科研市场更青睐于超多重的检测指标。
国内大部分蛋白质组行业的公司主要以进口质谱平台做检测服务,有比较可靠的低成本的出报告能力。少数拥有独家技术的,是在样本前处理方面重点解决质谱检测蛋白组中重现性差、低丰度蛋白检出率低和翻译后修饰检出能力差的不足,能够满足不同用户对于数据不同程度的要求。也有以单分子免疫为开发方向的公司,更偏向做低丰度低重数蛋白标志物检测的临床转化,比如血浆中检测退行性疾病的低丰度相关标志物。类似Olink的基于核酸体系放大亲和信号的超灵敏超多重检测技术,在海外已有至少3家,而国内突破专利的底层技术创新仍十分稀缺,整体技术思路多跟进海外,更致力于向下游应用拓展,以获得更大的市场空间。国内大部分公司的融资集中在2020年前后,相信未来几年蛋白质组学在国内会有更迅速的发展。
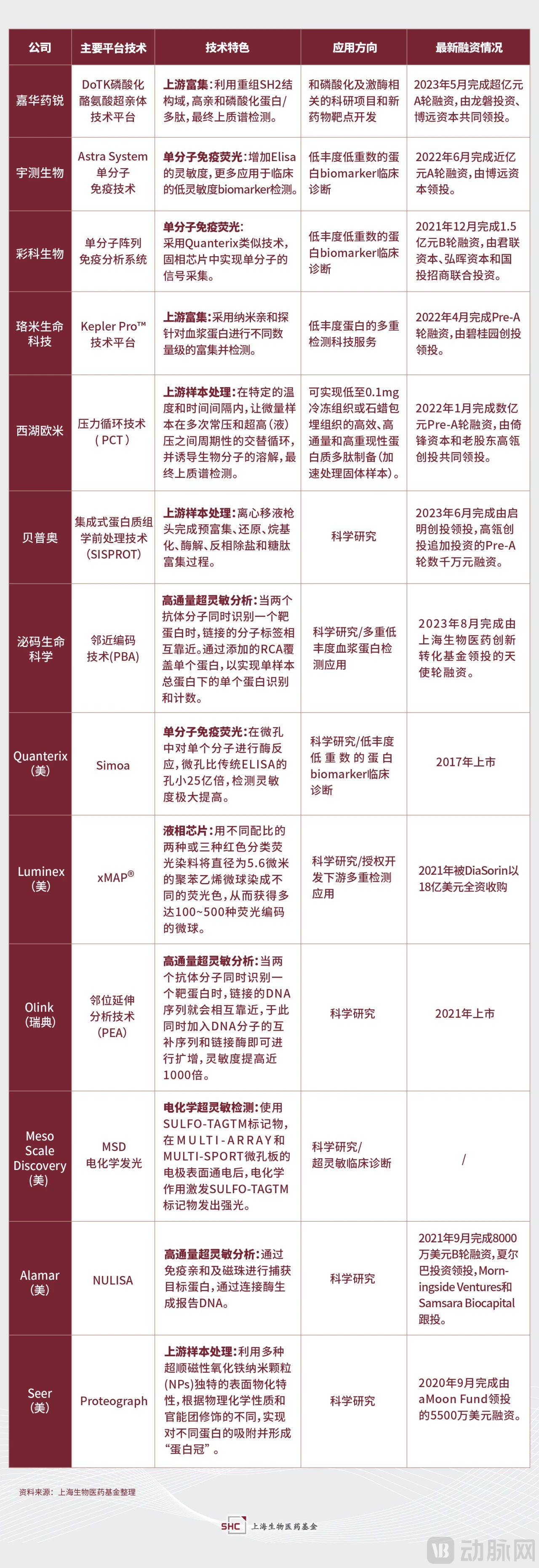
▲国内外部分蛋白质组学公司(不完全统计)
六、蛋白质组学的发展空间巨大,更看好有开发新标志物能力的平台
组织蛋白组技术相对比较成熟,血浆蛋白组的难点在于血浆中有大量高丰度蛋白,宽动态范围对样本前处理提出了极高的要求。而血浆微量蛋白的生物学价值很高,且是未来开发临床相关标志物的主要样本来源,血浆蛋白组的方向是极具潜力的。血浆蛋白组的需求是高通量的、可重复的、多重的、检测下限低的、可负担的,这个方向目前Olink遥遥领先,但昂贵的价格限制了该技术的下游应用。在蛋白质翻译后修饰的检测能力急需进一步提高,纳米孔测序技术、抗体/其他亲和技术及新兴标记技术等的发展至关重要。
从下游的角度看,市场最大的是临床诊断应用。不同的技术适用于不同的平台且由于诊断领域的细分和复杂性,极难出现某个平台垄断或者一家独大的情况。未来的预期,大致会同时出现以下几个发展方向:
a) 传统蛋白检测如基于免疫的化学发光免疫分析;
b) 少指标、超灵敏:单分子免疫技术;
c) 多指标、灵敏:液相芯片/流式荧光等技术;
d) 多指标、超灵敏:PEA(Olink)等技术;
e) 多指标、灵敏、新蛋白:质谱和纳米孔等技术。
尽管检测技术蓬勃发展,临床诊断的上限还是在医学理解的进步和新标志物的开发,因此能够开发与疾病相关的新标志物的平台更具备进入蓝海的潜力,下一个市场爆发应该会集中在手握平台且能够提前布局下游应用的公司。
上海生物医药基金是经上海市人民政府批准,总目标管理规模为人民币500亿元的市级产业基金,由上实集团发起设立。基金将利用上海市发展生物医药的综合优势,依托产业资源,打造一个“立足沪港、联动长三角、面向全球”的生物医药领域创新投资平台。基金以金融资本和产业资源相结合、境内和境外运作相结合的方式,重点投向符合上海生物医药产业发展战略的关键领域,包括高端生物制品、创新化药及制剂、高端医械及诊断、医疗健康领域的创新业态等各大主要项目领域。
上下滑动查看




























