2023年8月,Fierce Biotech发布2023年业内最强劲15家的生物技术公司(Fierce Biotech’s 2023 Fierce 15)榜单。该榜单已经连续发布多年,旨在展现业界具有创新性和前景的生物技术公司,在全球生物制药产业界都颇具“含金量”。让人眼前一亮的是,2018年刚成立的Epic Bio(以下简称“Epic”)位列其中。

Fierce Biotech’s 2023 Fierce 15(图源:Epic官网)
Epic是一家位于美国加利福尼亚州的基因编辑公司,通过缩小CRISPR工程蛋白的尺寸等技术提高药物治疗潜力,已经引起了投资者和大型制药公司的兴趣。2022年7月,Epic宣布完成5500万美元A轮融资,获得Horizons Ventures(维港投资,李嘉诚旗下投资基金)等投资者的支持,次年4月又获SOLVE FSHD投资。
是什么让Epic出现在此榜单上?2021年,公司缩小CRISPR工程蛋白尺寸的核心技术在《Molecular Cell》上发表,2023年Epic就基于该技术提交了一份IND申请。如此强劲的发展势头和高关注度,与作为创始人的亓磊不无关系。

亓磊(图源:Epic官网)
遗传医学先驱亓磊出生于山东省潍坊市,是斯坦福大学的副教授。亓磊拥有清华大学数学和物理学学士学位,在加州大学伯克利分校读硕士期间师从诺贝尔物理奖得主朱棣文教授。后从物理学转入生物工程领域,师从CRISPR基因编辑先驱、诺贝尔化学奖得主Jennifer Doudna教授。
亓磊也是获诺贝尔奖的CRISPR专利的共同发明人之一,研究重点是开发在不改变底层DNA的情况下调节基因表达的工具,将CRISPR基因编辑扩展到了表观遗传领域。他带领实验室成员进一步开发了CRISPR技术工具箱,用于精确调控基因,包括表观基因组编辑(CRISPRa和CRISPRi)、活细胞DNA/RNA成像(LiveFISH)、三维基因组操作(CRISPR-GO)、针对RNA病毒的CRISPR抗病毒药物(PAC-MAN),以及CasMINI(在人体细胞中工作的最小的Cas蛋白)的开发。
Epic从斯坦福大学的独家许可获得供人体使用的超紧凑DNA结合蛋白CasMINI的授权。CasMINI是迄今已知的在人类细胞中发挥作用的最小CRISPR系统,目前基于Cas9和Cas12a CRISPR相关蛋白的系统,由大约1000到1500个氨基酸组成,而CasMINI只有529个氨基酸。CasMINI可以驱动与Cas12a相关的高水平基因活性,并允许进行稳健的碱基编辑和基因编辑。而且,它具有高度特异性,不会产生可检测的脱靶效应。此外,CasMINI mRNA可以很容易地包装到脂质纳米颗粒或其他RNA递送方式中,扩展了其进入细胞的路径。
表观遗传编辑平台动态控制基因表达,
建立最大转录和表观基因组调节剂库
基因可能对生物体内部起着决定性的作用,但并不能决定所有外部表象。即便是具有相同DNA的同卵双胞胎,身高和脸型也可能存在差异,其中的原因可以用表观遗传学阐释。
表观基因组是一种控制基因表达的天然系统,它广泛存在于人体细胞的染色质中,决定基因的表达水平。表观遗传标记与遗传密码的区别在于,它在不同组织和不同时刻都是动态的,而非像遗传密码一样具有高度稳定性。表观基因组无需对DNA进行永久性编辑,为改变细胞活性带来了巨大的治疗前景。
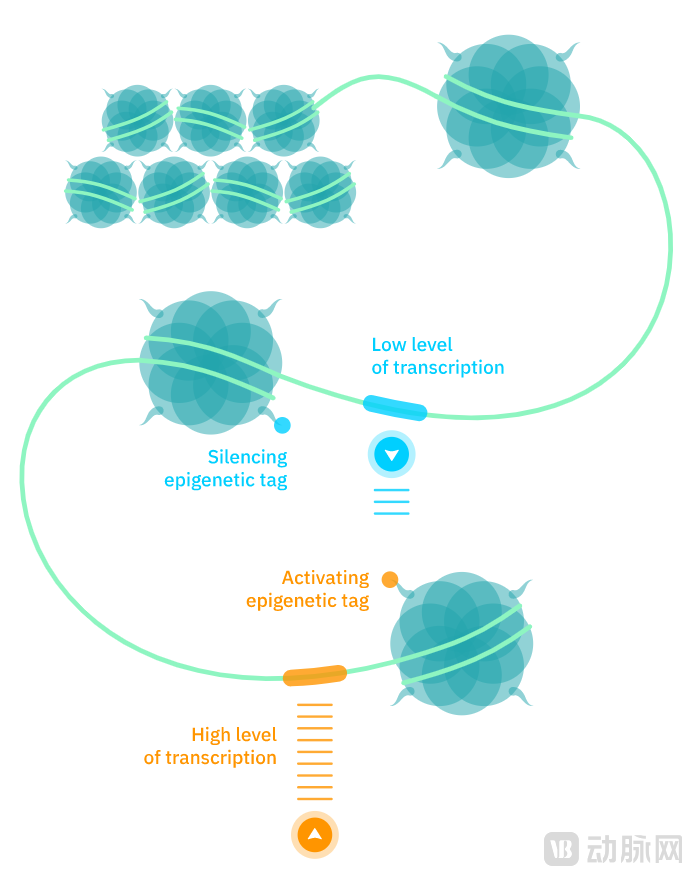
表观遗传标记(图源:Epic官网)
Epic利用表观遗传编辑技术建立治疗平台,开发动态控制基因表达的治疗方法。在不改变DNA序列的情况下,在体内和体外精准上调或下调基因表达。此平台被称为基因表达调控系统(GEMS),它将DNA结合蛋白、一种或多种定制的引导RNA和一种或多种调节剂结合在一起,开发出一种新型基因药物。
DNA结合蛋白与定制的引导RNA配对后,就能识别并结合到目标序列上。此后,调制剂就能以多种方式定制基因的表达,包括激活或抑制基因转录,或在基因座上添加或移除表观遗传标记。
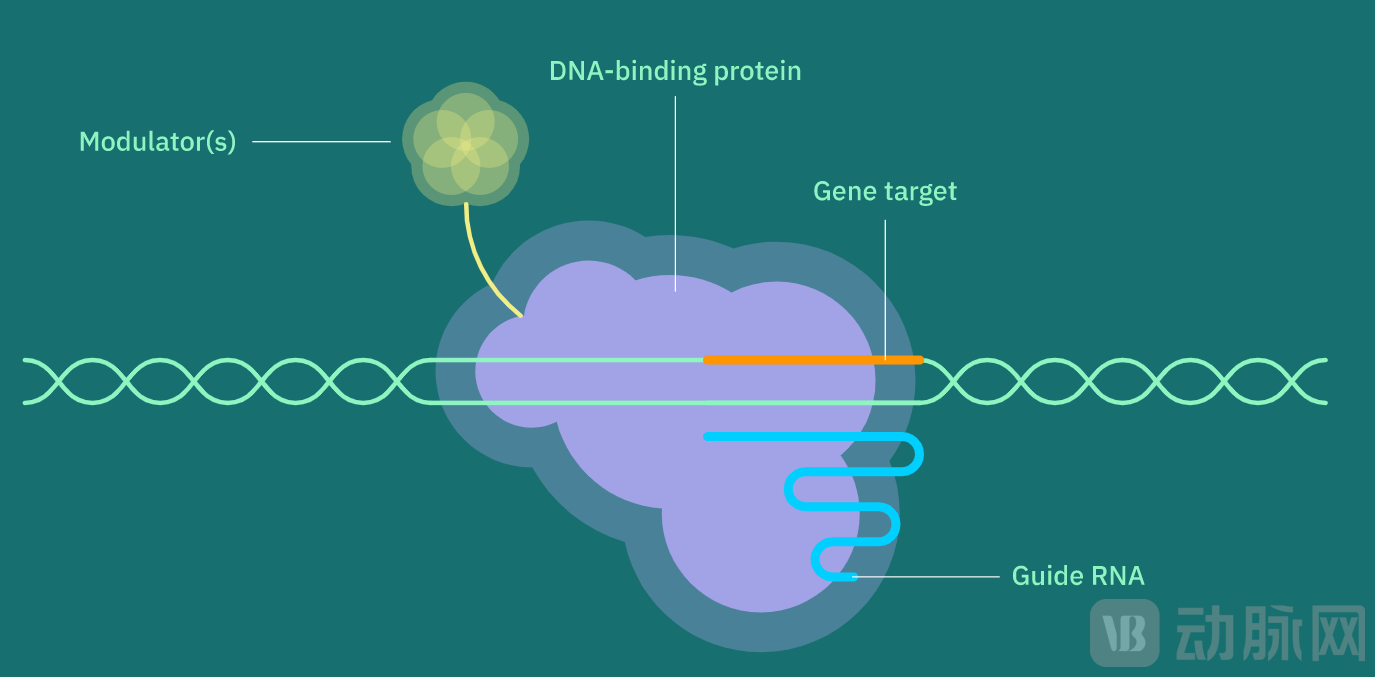
GEMS(图源:Epic官网)
·DNA结合蛋白
Epic利用基因和蛋白质工程优化Cas DNA结合蛋白,以提高效力和特异性、降低免疫原性、改善可传递性并扩展至新的应用领域。
·引导RNA
Epic建立了一个创新的功能筛选平台,用于快速识别引导RNA。定制的引导RNA可在适应症中实现精确、特异的基因靶向,并最大限度地降低脱靶效应的可能性。
·调节剂
调节剂工具包包括新型激活剂和抑制剂,可精确控制目标基因的剂量。还包括能够书写或擦除新型表观基因组调节剂的酶效应器,如组蛋白调节剂、DNA(脱)甲基化器和染色质重塑器,以引入基因表达的持续变化。
现有的调节剂种类有限,而且并不针对所有靶点。而Epic称,公司建立了现有最大的转录和表观基因组调节剂库,并通过发现筛选平台和设计新型调节剂的专项研究工作不断扩大该库。有了庞大的调节剂库,就可以设计出无穷无尽的调节剂组合,以驱动目标基因的特定行为。
GEMS结合先进的功能和计算基因组学能力,增强基因编辑药物的模块化与灵活性。药物能够在不受突变类型限制的情况下(因为它们靶向基因的调控区域),对转录进行微调,精确调节生物体内外的基因表达。一种GEMS药物就能覆盖疾病的大多数或所有基因亚型,即单一GEMS疗法可能治疗特定疾病的大多数遗传变异。
Epic目前公布了5条研发管线,面向的治疗领域分别是:面肩肱型肌营养不良症(FSHD)、杂合子家族性高胆固醇血症(HeFH)、α-1抗胰蛋白酶缺乏症(A1AD)、色素性视网膜炎4型(RP4)和色素性视网膜炎11型(RP11)。其中,EPI-321的进展最快。
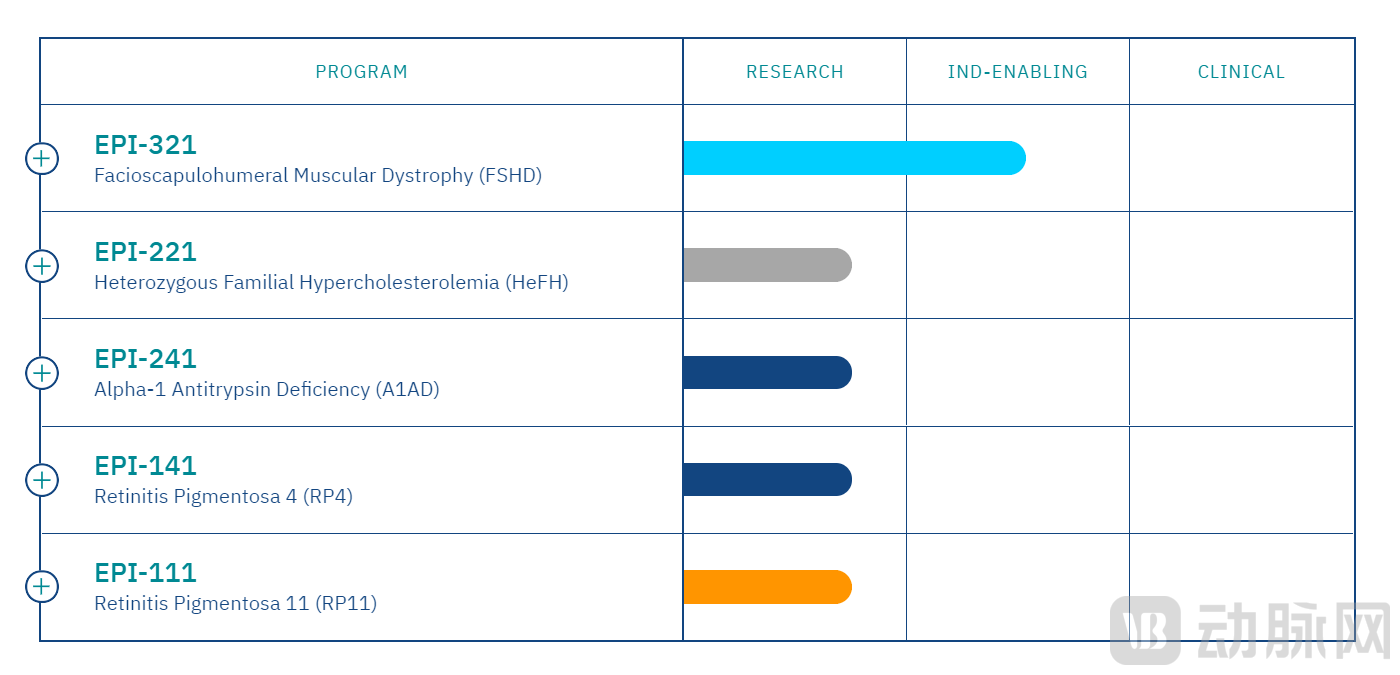
药物管线图(图源:Epic官网)
EPI-321已被美国食品和药物管理局(FDA)授予"孤儿药"称号,若该疗法最终获得批准,它将获得经济利益和七年的市场独占权。公司计划在2024年上半年启动EPI-321的1/2期临床试验,以评估该疗法在FSHD患者中的安全性、活性和初步疗效。
FSHD目前尚无治愈方法,其致病原因是4号染色体上D4Z4区域的低甲基化导致DUX4基因的毒性表达(正常情况下,D4Z4区域超甲基化并抑制DUX4基因表达)。而EPI-321可以重新甲基化D4Z4区域并抑制DUX4的表达,从而防止肌肉细胞进一步死亡,具有治疗潜力。
除体内基因疗法(治疗眼睛、肌肉或肝脏的遗传疾病)外,微型CasMINI还可以应用于体外(例如设计更好的肿瘤杀伤淋巴细胞或重编程干细胞),有望成为治疗遗传疾病、治愈癌症和逆转器官退化的方法。
2023年10月,吉利德(Gilead)旗下专门从事CAR-T(嵌合抗原受体T细胞)疗法的子公司Kite和Epic达成合作协议,使用Epic专有的基因调控平台开发下一代CAR-T细胞疗法以对抗多种类型的癌症。根据合作协议,在产品方面,Epic将通过表观遗传学编辑技术来调控基因表达对T细胞进行设计,开发Kite所选择靶标的载体。在资金方面,Epic将自Kite获得预付款,并在未来根据开发、监管和销售里程碑来获得相应款项。

(图源:Kite官网)
CAR-T细胞疗法目前在治疗血液系统恶性肿瘤具有极大的优势,利用表观遗传调控来助力其研发,有望覆盖更广泛的肿瘤人群。从体内基因疗法到体外应用,从治疗遗传疾病到治疗癌症,Epic利用表观遗传学不断发掘基因编辑治疗领域的更多可能性。
近年来,在表观遗传学领域也出现诸多合作和收购案例。
自1991年主治血友病的国内首个基因产品临床试验开始,基因治疗领域就备受关注。基因编辑细胞疗法具有诸多优势,如导入效率高和富集靶细胞等。因此,国内也出台了不少扶植政策。《“十三五”国家科技创新规划》提出发展先进高效生物技术,开展免疫治疗、基因治疗、细胞治疗、干细胞与再生医学等关键技术研究,2021年国家药品监督管理局药品审评中心发布《基因治疗产品长期随访临床研究技术指导原则》。

基因编辑细胞疗法的优势(图源:沙利文《基因药物行业现状与发展趋势蓝皮书》)
随着政策的利好,以邦耀生物、瑞风生物等为代表的中国CGT(细胞与基因治疗)公司,积极布局CRISPR在研疗法中的中国公司管线。如邦耀生物针对输血依赖型β-地中海贫血的CRISPR基因编辑治疗产品BRL-101,成为全世界首次通过CRISPR基因编辑技术治疗β0/β0型重度地贫的成功案例。
据沙利文分析,中国的细胞和基因治疗COM/CDMO市场将是增长最快的市场,2020年至2025年的复合年增长率为51.1%,以CRISPR以及更前沿的基因疗法为基础逻辑的创新性医药产品具有广阔市场潜力。





























