今日,抗体细胞因子第一股盛禾生物-B(2898.HK)在港交所正式上市,独家保荐人为中金公司。根据公告显示,盛禾生物本次IPO计划全球发行3415.18万股,每股定价13.50港元,其中90%为国际发售、10%为香港公开发售,未有超额配股权。
扣除全球发售已付及应付的包销费用及其他估计开支后,本次IPO募资净额约为3.92亿港元。其中,28.2%募资金额将用于IAH0968在中国正在进行及计划进行的临床试验;35.8%募资金额将用于IAP0971在中国正在进行及计划进行的临床试验;36.0%募资金额将用于资助IAE0972在中国正在进行及计划进行的临床试验。
根据老虎证券显示,盛禾生物首挂开报14.46港元,较招股价高7.11%,盘前成交104.2万股,成交额1540.9万港元。截至发稿时间13时58分,盛禾生物股价维持在14.920港元每股,涨幅达到10.52%,总市值涨至23.37亿港元。
在本次IPO之前,盛禾生物曾完成过两轮融资,2023年8月2日,盛禾生物获得2.1亿元A轮融资,投资机构包括倚锋安盛、倚锋安禾,投后估值为14.1亿元(约合15亿港元)。根据港股《主板上市规则》第18A章的规定,公司上市时市值至少为15亿港元,同时运营资金足以应付公司由上市文件刊发日期起至少12个月所需开支的至少125%。
完成此轮融资,盛禾生物刚好“撞线”申请上市的财务指标。获得A轮融资的第二天,盛禾生物就向港交所递交了招股书。
一个月后,即2023年9月27日,盛禾生物又获得6018万元A+轮融资,引入了投资人北京越禾,公司投后估值为14.7亿元。随着数位投资机构先后入股,盛禾生物的现金及现金等价物获得由2022年末的182.1万元增至2.20亿元,既解决了现金流难题,也解决了申请IPO的估值问题。
盛禾生物到底有何亮点,能够在递交招股书前夕密集完成两轮融资,引入知名机构,进而在今天成功走向资本市场?
根据招股书显示,盛禾生物成立于2018年,是一家专注于发现、开发和商业化用于治疗癌症和自身免疫性疾病的生物制剂的临床阶段生物制药公司。其核心业务模式包括内部发现、开发和商业化抗体细胞因子和透过直接调节先天性及适应性免疫系统来调节免疫微环境的其他免疫疗法,以解决肿瘤学和自身免疫性疾病领域的市场需求。
盛禾生物的管理团队在生物制品开发及工商管理方面平均拥有超过15年的行业经验,涵盖抗体发现和工程、工艺开发、GMP生产、临床运营和监管事务等领域。
其董事会主席兼执行董事张峰负,在业内拥有逾20年经验,精通研发、临床开发、产品上市及营销。值得一提的是,张峰已成功获得近20种药物的上市批准,30多种药物的生产证书,并参与了50多种临床和临床前产品的开发,根据国家药监局发布的药物分类标准,其中有15种属于1类或2类新药。除出任制药行业领导职位外,张峰还在学术界和行业组织中担任多个职位。
执行董事、首席执行官兼首席科学官殷刘松,在抗体及细胞因子开发和管线管理方面拥有超过16年的经验,并领导了超过600个抗体药物的发现和优化项目,进入临床试验的项目多达数十个。此外,盛禾生物的研发部门负责人姜晓玲,亦拥有超过15年的药物(包括生物类似药和抗体药物)研发经验,领导了约20种创新生物制剂和六种生物仿制药的开发;制造团队负责人姜东成拥有10年的GMP制造经验,直接参与了十多种候选药物的GMP制造、扩产和验证工作。
除了管理团队研发和产业化经验丰富之外,根据Frost & Sullivan数据显示,盛禾生物还是全球开发抗体细胞因子产品的领军者之一,更是少数几家在抗体细胞因子领域拥有临床进展最快候选产品的先驱公司。值得一提的是,盛禾生物还是抗体细胞因子领域在港交所上市的首家公司。这或许是资本肯定盛禾生物重要的一个理由。
瞄准年增长率超30%市场,
快速建立三大平台
盛禾生物聚焦的细胞因子,是一类广泛而松散的小分子蛋白质,在细胞信号传递中非常重要,亦在调节免疫系统中发挥着重要作用。近年来,抗体细胞因子因其强大的靶向肿瘤和延长细胞因子半衰期的能力以及其对多个靶点的协同抗肿瘤作用而成为开发以细胞因子为基础的疗法的一种流行方法。
根据弗若斯特沙利文资料显示,2018年至2022年,细胞因子-抗体药物的全球市场规模从579亿美元增加到729亿美元,复合年增长率为6.0%。预计2026年将达到953亿美元,2030年将达到1196亿美元,2022年至2026年及2026年至2030年的复合年增长率分别为6.9%和5.8%。
2018年至2022年,中国细胞因子-抗体药物市场规模从人民币26亿元增加到人民币72亿元,复合年增长率为28.4%。预计2026年将达到人民币248亿元,2030年将达到人民币741亿元,2022年至2026年及2026年至2030年的复合年增长率分别为36.4%和31.4%。
瞄准这一需求巨大的市场,盛禾生物快速建立了三大技术平台,以此作为产业化的源泉,包括AIC™平台,一个主要专注于抗体—细胞因子融合蛋白开发的可扩展平台;ADCC增强抗体平台 (AEA™平台),一个为增强抗体的细胞毒性而构建的FUT8敲除细胞系;强化天然免疫细胞多抗平台(AIM™平台),一个专注于开发基于先天免疫刺激物的双特异/多特异抗体的平台。
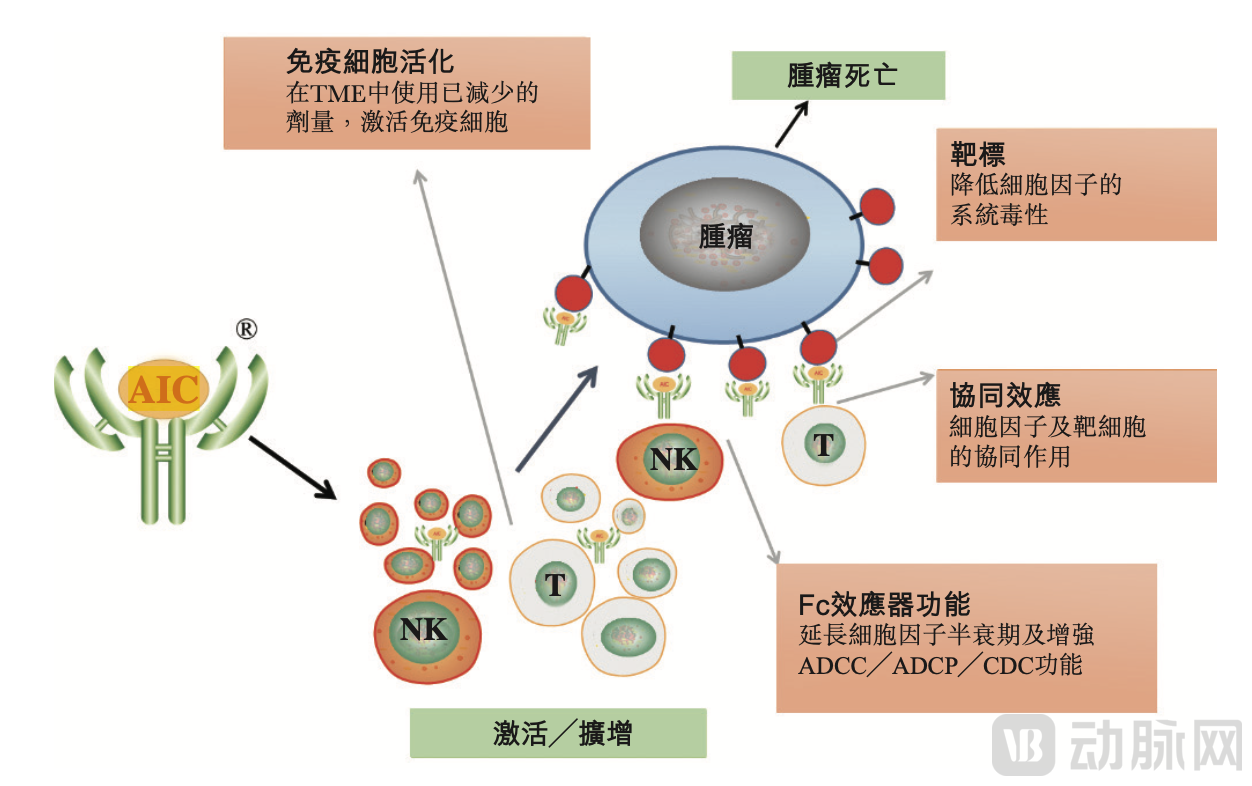
盛禾生物强化抗体细胞因子平台AIC™,图源盛禾生物官网
①AIC™平台:在细胞因子选择与优化、抗体选择与工程、结构设计与工程以及细胞系定制生产等抗体细胞因子开发领域中的多个方面具有突出优势。 该平台是综合性的研究引擎,不仅包括完整的免疫球蛋白G(IgG)抗体及细胞因子库,还包括功能性抗体片段及其他类型的免疫系统调节剂,可生成从抗体细胞因子到其他双功能融合蛋白的各种产品。
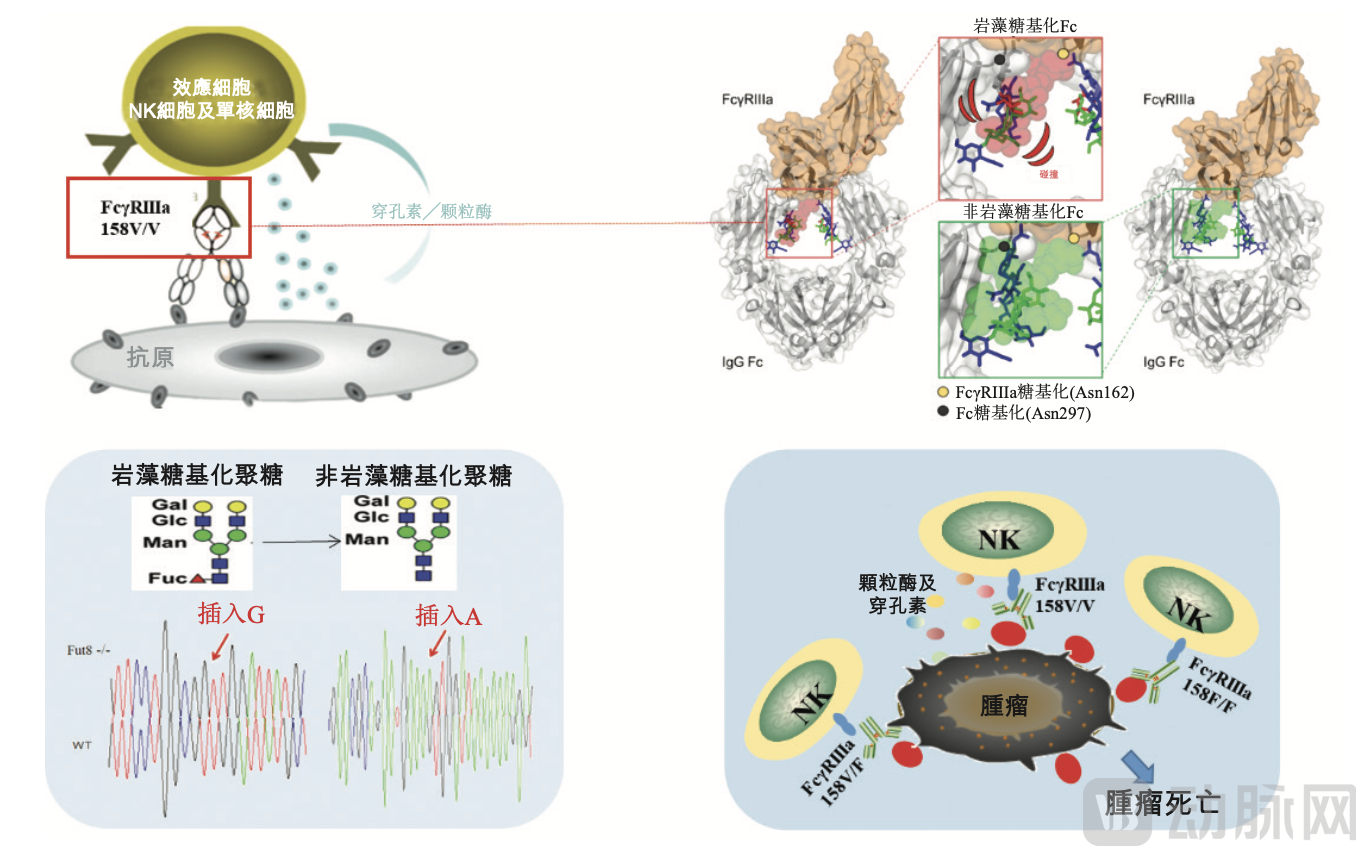
盛禾生物ADCC增强抗体平台AEA™,图源盛禾生物官网
②AEA™平台:是一种生物工程改造的CHO细胞系 ,其中的FUT8片段被敲除,以产生具有增强型ADCC及更高抗肿瘤活性的抗体。AEA™平台预期将产生不含任何岩藻糖的抗体,可快速、稳定、彻底地增强抗体的ADCC,并简化产品的质量控制。因此,AEA™平台能够将生物制剂的任何抗体或抗体部分(包含Fc区域)设计成ADCC增强型产品,以增强免疫效应细胞活性。
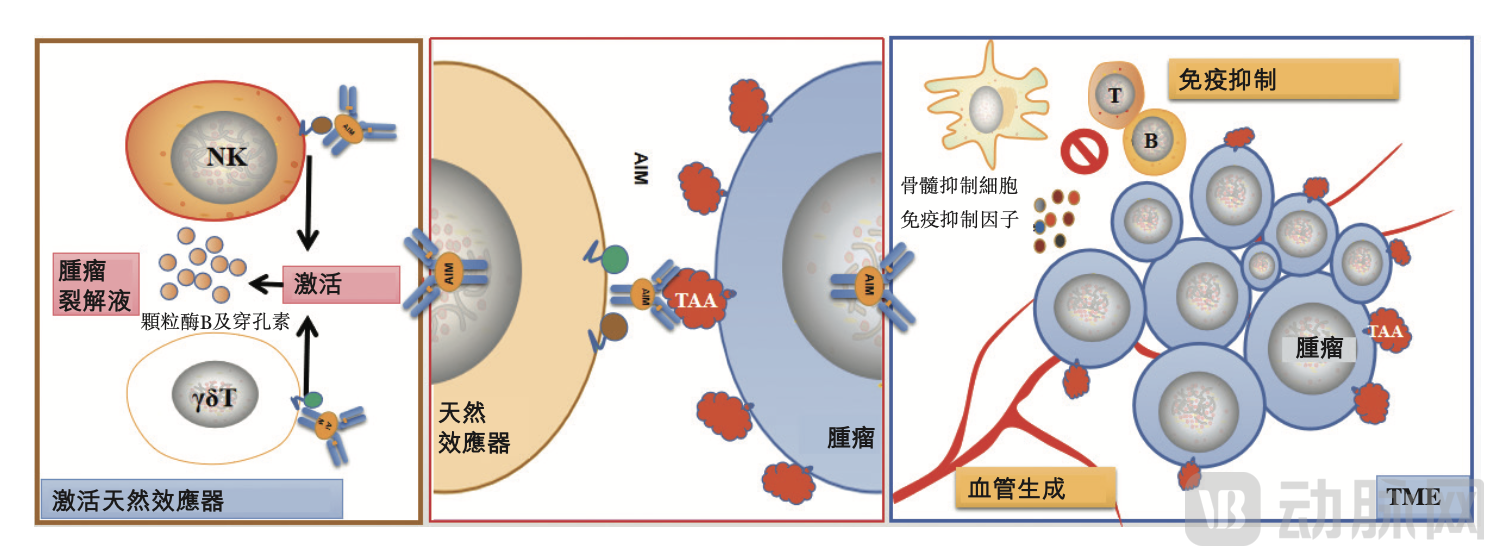
盛禾生物强化抗体细胞因子平台AIM™,图源盛禾生物官网
③AIM™平台:专注于通过结合先天免疫系统来设计癌症免疫治疗的多功能生产产品。其选择用于癌症靶向的肿瘤相关抗原抗体、用于天然效应器激活的受体激动剂抗体以及用于免疫调节的细胞因子和其他肿瘤免疫微环境因子来设计多特异性抗体融合蛋白,并从表达、靶结合、体内及体外生物活性以及成药性等方面对这些蛋白进行评估。
九款在研管线,
三款产品中国临床进展最快
基于三大技术平台,目前盛禾生物拥有9条在研产品管线,其中6条已进入临床阶段,其中3款核心管线IAH0968、IAP0971、IAE0972,皆为国内治疗癌症患者临床进展最快的抗体细胞因子。
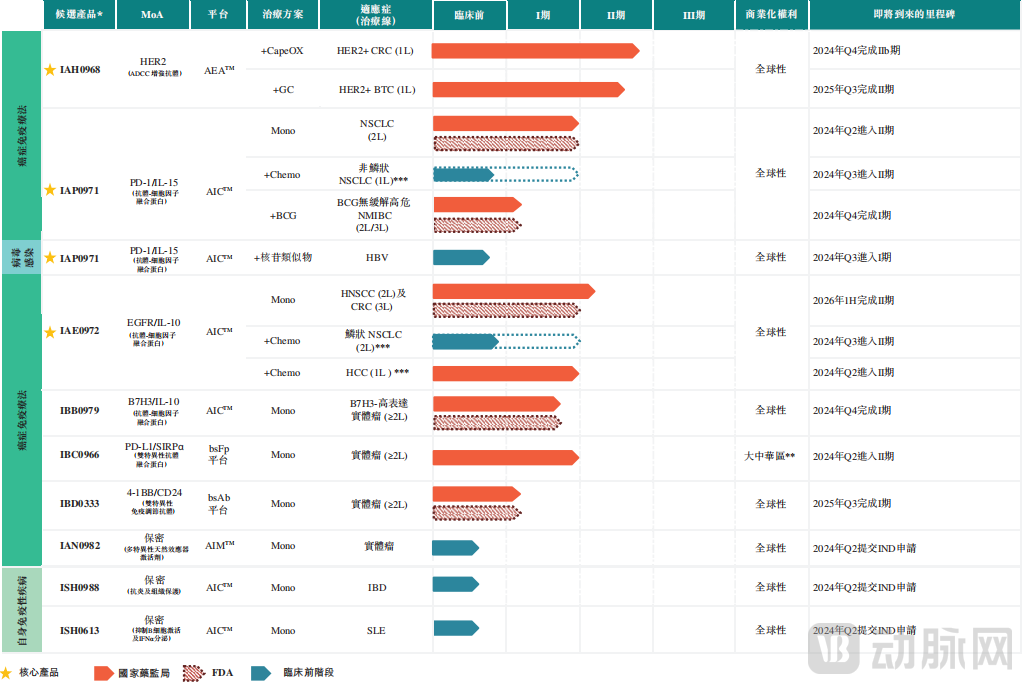
在研管线,图源盛禾生物招股书
其中,核心产品IAH0968是一款ADCC增强型抗HER2抗体,还是盛禾生物自主研发的首个100%去除岩藻糖的临床阶段抗HER2抗体。根据沙利文资料显示,全球范围内有三种用于癌症治疗的抗HER2抗体正处于临床开发阶段,中国目前有四种抗HER2抗体处于临床开发阶段,其中进展最快的产品亦处于II/III期阶段。IAH0968则是中国乃至全球唯一且临床进展最快的通过去除岩藻糖修饰的ADCC增强型抗HER2抗体,目前处于II/III期临床阶段。
I期临床试验表明,IAH0968在对曲妥珠单抗、帕妥珠单抗、西妥昔单抗、多西他赛、奥沙利铂、卡培他滨、伊立替康、白蛋白结合型紫杉醇及阿帕替尼或抗PD-1单抗具有耐药性的晚期HER2+恶性实体瘤(包括乳腺癌、胃癌、CRC和BTC)患者中具有良好的耐受性和抗肿瘤活性。盛禾生物已于2024年1月进入CRC的IIb/III期临床试验,并预期于2024年第四季度完成CRC的IIb期试验,预期于2025年第三季度完成BTC的II期临床试验。
第二款核心产品IAP0971则是盛禾生物自主研发的一款抗PD-1抗体-IL-15/IL-15Rα异源二聚体融合蛋白。根据沙利文资料显示,在全球范围内,目前有14种基于IL-15的免疫疗法处于临床开发阶段,尚无用于治疗癌症的基于IL-15的免疫疗法获准上市。在中国,目前有七种基于IL-15的免疫疗法处于临床开发阶段,而IAP0971是中国临床进展最快的基于IL-15的抗体细胞因子。
盛禾生物于2022年1月及2021年12月,分别获得国家药监局及FDA的IND批准,以对晚期恶性肿瘤患者进行I期及II期临床试验,并于2023年7月完成了I期临床试验,并计划于2024年第二季度在中国启动IAP0971的II期临床试验。I期临床数据显示,IAP0971在晚期恶性肿瘤患者中具有高达200μg/kg的良好安全性,且未观察到剂量限制性毒性(“DLT”)及最大耐受剂量(“MTD”)。
第三款核心产品IAE0972是抗EGFR抗体-IL-10同源二聚体双功能融合蛋白。根据特沙利文资料显示,目前尚无基于IL-10的免疫疗法获批用于治疗癌症。在全球及中国,目前有三种基于IL-10的免疫疗法正处于临床开发阶段,其中两种来自盛禾生物。截至目前,IAE0972处于II期临床阶段,为中国临床进展最快的基于IL-10的抗体细胞因子。
盛禾生物已分别于2021年12月及2022年1月从FDA及国家药监局获得对晚期实体瘤患者进行I期及II期临床试验的批准,并于2023年7月完成I期临床试验。在IAE0972用于治疗晚期实体瘤的I期临床试验中,盛禾生物招募了14名晚期食管鳞状细胞癌、直肠癌、胃癌、胰腺癌、小细胞肺癌(“SCLC”)或NSCLC患者,该等患者至少接受过一种治疗后出现进展,完成了剂量递增试验,仅观察到1例3级不良事件。未出现DLT,亦未达到MTD。
除上述三款核心产品外,盛禾生物还有1BB0979、IBC0966、IBD0333三款产品处于临床阶段,依旧是专注于癌症的免疫疗法。
暂无产品商业化,
或将通过BD进一步“回血”
推进上述管线快速产业化,肯定少不了大量的资金支持。根据招股书数据显示,盛禾生物的年内亏损由2022年的人民币5200万元大幅增加至2023年的人民币1.327亿元。就核心产品产生的研发开支而言,盛禾生物于2022年及2023年分别花费人民币1070万元及人民币1740万元,分别占相应年度研发开支总额的20.1%及40.4%。
目前,盛禾生物尚无产品获批准进行商业销售,亦未从产品销售中产生任何收入,何时盈利尚属未知。本次IPO暂时为盛禾生物回了一波血,估计未来很长一段时间,其都将保持巨额投入。但在招股书中,盛禾生物还透露出了另一个信号:
“我们将积极寻求与国际领先的医药公司合作的机会,通过对外授权安排推进我们产品的海外临床研究。我们还将扩大我们的国际注册团队,以确保进行我们的全球临床开发和注册计划,并强化我们的主打产品,特别是我们的抗体细胞因子管线产品,包括IAP0971、IAE0972和IBB0979。”
“除了不断努力提高我们的国际影响力外,与世界知名的制药公司合作亦将进一步证明我们的研发能力,从而提高我们在制药行业中的知名度。我们现有的资产已引起多家跨国公司的关注,我们将积极与彼等沟通以寻求潜在的合作。”
这些信息都从侧面透露出,盛禾生物未来或将倾向于通过BD实现盈利。事实上,近年来通过大额BD助力企业快速实现盈利的例子不少。复宏汉霖、再鼎医药、康方生物、百济神州、信达生物、和铂医药等企业开始盈利,背后离不开大额BD交易。
在九死一生的生物医药产业中,在既有泡沫也有鲜花的18A中,期待盛禾生物通过建立高附加值技术平台、快速推动管线进展、IPO、BD等各种方式,为行业带来差异化的打法,在医药洪流中健康、积极的发展。
参考资料:
1. 盛禾生物通过聆讯:尚无销售收入,递表前“紧急”融资2亿元
2. 免疫疗法“白马”盛禾生物登陆18A 三款产品临床进展全球最快 下一个MNC“扫货”的对象?





























