编者按:本文来自上海生物医药基金,作者傅沅苑、陈宇城,动脉网获权转载。
高特异性、低副作用的抗体药物在疾病的诊断和治疗中具有其他药物类型无可比拟的优势,因此长期以来在医药领域都保持着高速增长。2023年全球销售TOP 10药品中,抗体药在数量和销售额上依旧占据着半壁江山。本文浅析了抗体药物研发环节的抗体筛选路径,探讨了抗体筛选所面临的挑战与机会。
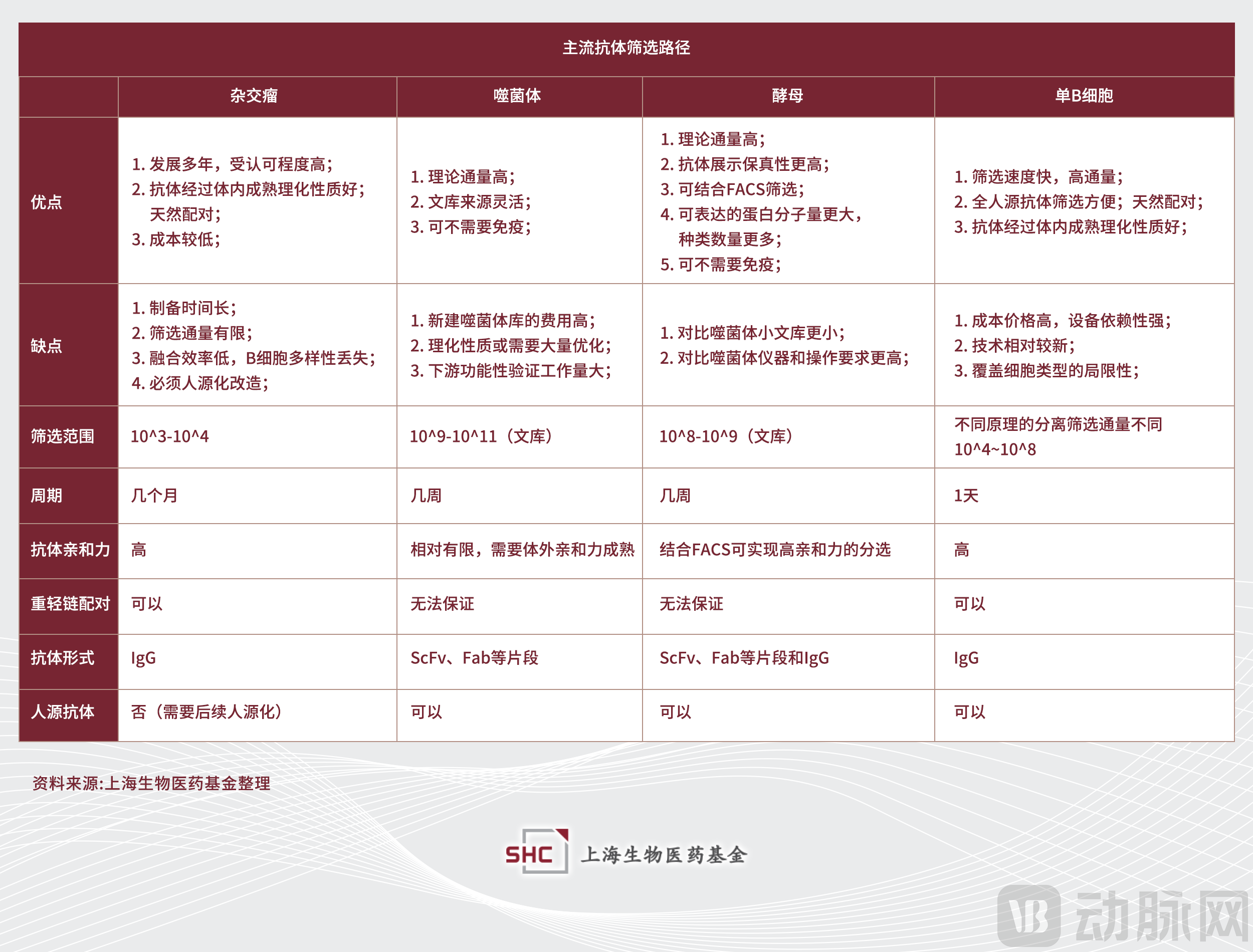
1986年,FDA批准了基于杂交瘤技术诞生的首个单克隆抗体Muromonab(CD3)。随后,在不到40年的时间里,已经有超过百余种抗体药物陆续获批上市。抗体筛选技术作为抗体发现环节的核心,不单是单克隆抗体药物开发的关键,对于包括双抗、ADC、CAR-T等在内的其他新型生物大分子药物类型的开发也至关重要。在研发链条上尽早尽多地挖掘到优质的候选抗体,能大大提高后续药物开发的成功概率,因此对于开发更好抗体发现技术的需求从未停止。从杂交瘤到各类展示技术,再到基于单B细胞的筛选平台,抗体发现手段的更新与迭代为生物药的发展提供着最底层的支持。
一、不足与挑战并存于B细胞和抗体筛选
1、天然免疫文库的多样性对B细胞和抗体筛选提出了挑战
B细胞的分化与发育包括中枢与外周2个阶段:在骨髓处,多能造血干细胞分化成为共同淋巴祖细胞,再变成祖B细胞。祖B细胞先经历重链的重排,生成前B细胞,前B细胞而后经历轻链λ或κ的重排,生成IgM类别的未成熟B细胞。中枢部分完成的是基因重排、BCR表达和阴性选择,与抗原无关。随后进入外周部分,未成熟B细胞以未经过抗原的初始B细胞(naive B cell)状态游走在血液和次级淋巴器官。在淋巴结,遇到抗原的B细胞在Th细胞和DC细胞的辅助和刺激下发育成熟,并经历突变筛选与扩增,完成超突变、抗体亲和力成熟和类别转化后,发育为浆细胞或者记忆B细胞,提供产生抗体的来源[1]。
抗体由两条重链(H)和两条轻链(L)组成,其中重链包含1个可变区和3个恒定区,轻链包括1个可变区和1个恒定区,抗体的多样性正来源于其可变区的千变万化。重链可变区包括V段(可变段)、D段(多样段)和J段(连接段)。轻链的可变区则只有V段和J段,但人抗体的轻链有λ和κ两种亚型,分属于2个不同的基因,位于不同的染色体。B细胞产生多样性的关键两步包括 1. V (D) J重排(V (D) J recombination),产生初始B细胞库(antigen-inexperienced);2. 体细胞超突变(somatic hypermutation, SHM),产生的高亲和力库(antigen-experienced repertoire )[2]。
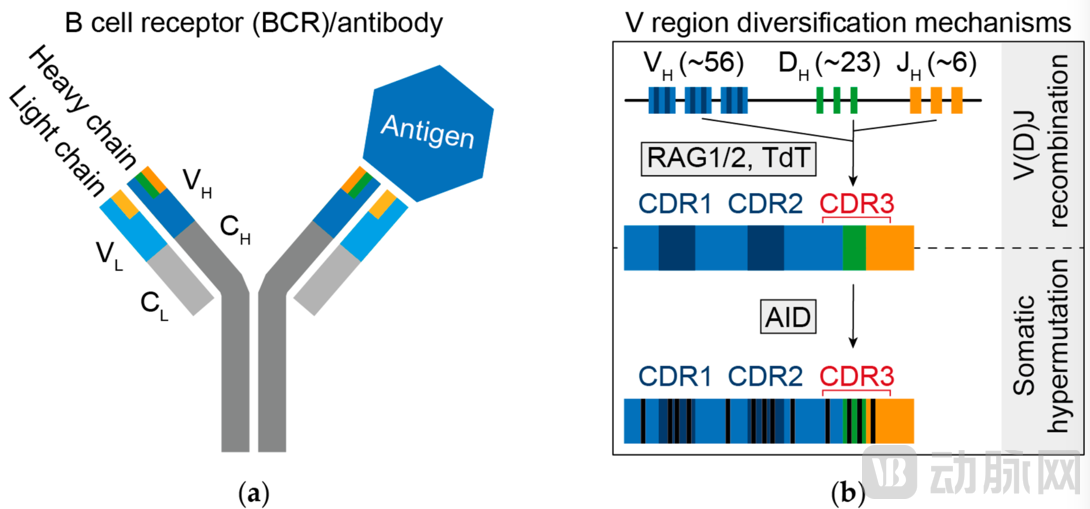
▲抗体的结构以及抗体多样性产生的关键步骤[3]
(1) 在B细胞发育的过程中,发生由RAG1/2重组酶参与的V (D) J随机基因片段重排,不同基因片段带来初始的组合多样性,重链的重排先于轻链。V (D) J基因片段的重组加上重轻链之间的随机配对,综合所产生的多样性为10^6(百万级别)以上,可见B细胞用相对少的基因就产生了足够大的多样性。
(2) 基因片段组合多样性以外,在片段连接处还会产生连接多样性(junctional diversity),DH-JH和VH-DH连接处多样性来源于碱基的随机删除、N/P核苷酸的增加,随机且数量不定的核苷酸变化可让理论上的未经抗原暴露的B细胞多样性高于10^12数量级[3]。抗体的抗原结合区域存在CDR1、CDR2、CDR3三个可变区,其中CDR1和CDR2处于V段中间,CDR3则是由V (D) J的重排产生的,而正是因为连接多样性,CDR3的多样性明显大于前两者,是抗原结合的关键区域。
(3) 除了V (D) J重排,B细胞多样性的另一个产生原因是体细胞超突变。被抗原激活后,B细胞编码可变区的基因以远超基因组背景频率的速度产生突变,在AID突变酶催化下,SHM在可变区引入点突变,促进抗体对抗原亲和力的增加,因此这一过程也被称为抗体的亲和力成熟。低亲和力的细胞凋亡和消除,而高亲和力结合抗原的B细胞在生发中心被选择与增值,分化为效应B细胞:抗体分泌细胞(antibody-secreting cells, ASC)浆细胞与浆母细胞、记忆B细胞。
未经抗原刺激的情况下多样性高于10^12,抗原暴露后该理论多样性可升至10^18级别[5],而健康成年人外周血B细胞的数量级在5*10^9左右,仅为B细胞库的一小部分[3]。其余大部分B细胞有取样困难的制约,因此基于人B细胞和免疫文库研究的主要样本来源还是外周血。尽管如此,如此通量还是对B细胞的免疫谱分析和天然配对抗体的筛选提出了巨大的挑战。
2、杂交瘤技术虽然发挥了体内抗体发现的优势,但在通量、B细胞多样性方面存在局限性
1975年,杂交瘤技术诞生。杂交瘤技术作为首先发展起来的抗体制备手段,由于可以直接进行体内抗体的挖掘且成本较低,更重要的是保留了抗体天然同源配对信息、经过了体内亲和力成熟过程,目前仍然是使用最广泛的抗体底层制备技术和抗体发现领域的“金标准”。目前FDA批准上市的抗体药物中,杂交瘤筛选出的分子仍然是主导。杂交瘤细胞是通过PEG融合或电融合免疫后鼠的B细胞和永生的骨髓瘤细胞所获得的细胞,两类细胞的融合同时满足了抗体生成和细胞无限增值的需求。
不可否认,杂交瘤技术也存在诸多局限性。细胞融合步骤可导致B细胞多样性的丢失,最终获得的阳性克隆少,即便是融合效率相对高的电融合,成功率也有限。且杂交瘤过程相对繁琐冗长,不考虑抗原制备和免疫流程,从融合开始的筛选周期通常需要2-3个月。杂交瘤所制备的是鼠源抗体,需要后续进行人源化处理。不仅需要额外的时间成本,人源化过程中还可导致抗体亲和力下降、生物物理特性不稳定等问题。
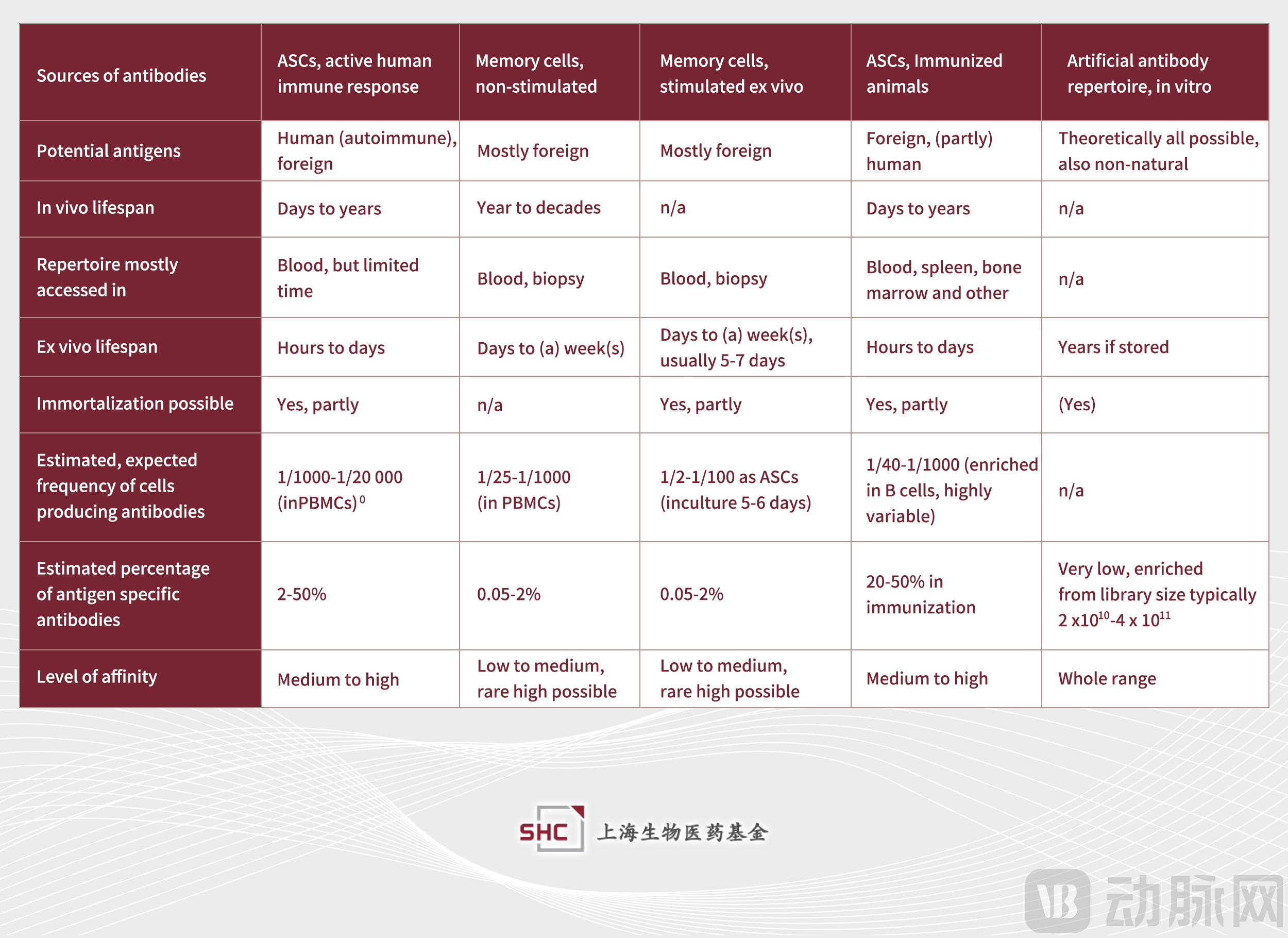
▲常见的抗体序列来源。对比体外用于展示技术的抗体库,体内效应B细胞 – ASCs和记忆B细胞所筛选来源的抗体亲和力更有保障,且更容易筛选出抗原高特异性的抗体[4]
3、体外展示技术的理论库容大,但抗体并非天然配对,理化性质较差
——噬菌体展示
1985年,噬菌体展示技术被首次报道,作为既杂交瘤技术后的又一重要抗体发现方法。噬菌体展示分为两步,第一步为建库,第二步为筛选。噬菌体展示实际上也是抗体库技术,将体外克隆的抗体基因片段插入噬菌体载体中,转染工程细菌进行表达。而筛选基于抗原抗体结合的基本原理,是一个反复掏洗的过程(biopanning),通过将基因编码的抗体片段和噬菌体自身的结构膜蛋白融合展示在噬菌体表面,去除未与目标靶分子结合的噬菌体,而后洗脱并扩增可与靶分子结合的噬菌体,以此类推进行3-5轮的富集并逐步提高可特异性识别目标分子的噬菌体比例。
噬菌体展示的抗体库种属构建和适用范围较广,而全人源抗体库的使用也可省去后续人源化改造的步骤,另外的优势在于其对实验设备要求很低,且可以创建大的文库(~10^11 文库大小,但VH-VL非天然配对配占比大[6])。
噬菌体展示的主要局限性在于筛选的抗体因为没有经历体内的成熟过程,所获得的抗体亲和力通常有限,需要体外重新亲和力成熟,理化性质时常不够理想[7],下游工程改造量较大。噬菌体建库可通过提取免疫动物脾脏或淋巴细胞RNA实现,经过反转录获得cDNA,PCR获得抗体的轻重链基因,随机拼接VH和VL基因构建scFv/Fab基因库。但噬菌体展示的文库抗体重轻链随机组合,无法体现免疫动物抗体文库的轻重链天然配对,限制了自然免疫文库的筛选深度。
——酵母展示
酵母展示是噬菌体展示后又一常用的体外展示体系。将外源蛋白基因与酵母载体基因序列融合,酵母利用特定的锚定蛋白(a-凝集素)将外源基因表达并展示定位于酵母细胞表面。酵母展示系统结合流式细胞仪提高筛选的通量,筛选可控性更高。酵母展示技术作为真核细胞表达体系,对比噬菌体原核展示体系可以对蛋白进行正确的翻译后修饰和折叠,因此抗体的表达保真程度也更高,是完整的具有生物学功能的抗体。对比噬菌体展示的分子量限制(一般为ScFv,再大会影响噬菌体的浸染包装),酵母可以展示完整的IgG。但相比于噬菌体,酵母库略小。
展示体系中除了常见的噬菌体展示和酵母展示路径,哺乳动物细胞表面展示、RNA展示、核糖体展示等也被用于抗体筛选,但暂未得到广泛的应用。
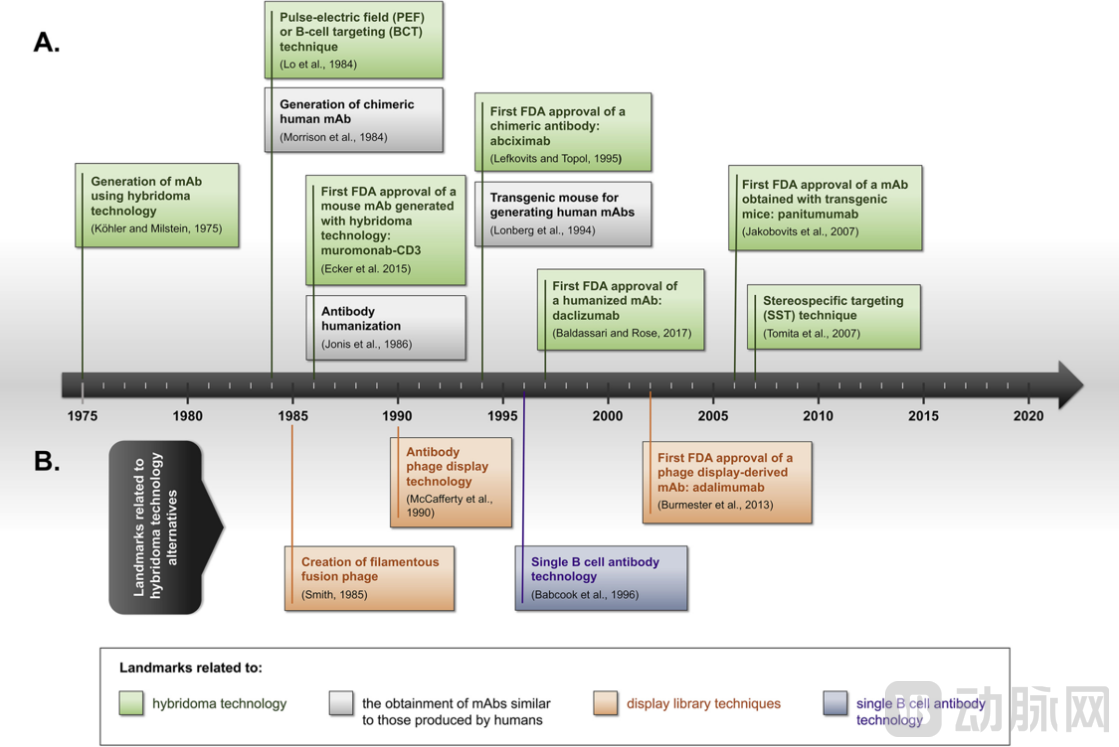
▲单克隆抗体技术的发展时间线[14]
▲主流抗体筛选路径
二、单B细胞技术的应用与推广
体内免疫所得到的抗体成药性通常优于体外展示筛选所获得,在杂交瘤基础上,进一步保留B细胞的多样性、提高筛选通量和效率是体内抗体发现的发展趋势。而基于这样的需求,单B细胞技术在近年来得到了应用与推广。
单B细胞抗体开发基于流式、微流控等不同方法将B细胞分离与鉴定,随后再结合PCR、测序、重组表达,以锁定目标抗体。抗原特异性B细胞的来源可以是常规的动物免疫后样本,常见的也包括患者、转基因小鼠等来源的全人源抗体以加速开发流程。
因为单个B细胞只生成一种特异性抗体,因此基于单B细胞开发抗体的路径能保证重轻链的天然配对。体内来源的样本经过了体内亲和成熟的过程,理化性质有保证,更容易获得高亲和力抗体。对比杂交瘤,单B细胞路径的样本不需要进行融合,抗体多样性也得到保留。单B细胞平台筛选还具备高通量、周期短、阳性率高等优点,很大程度上满足了体内抗体发现的必要条件。
单B细胞的路径主要包括FACS和各类微流控技术平台。微流控技术所赋予的独立反应体系(不管是孔板还是液滴)可以将所分泌的抗体和对应细胞关联,且小反应体系下可以更快速地积累抗体浓度,用于后续目标抗体的检测。以下根据微流控分离原理(液滴、腔室等),各例举代表性的平台和公司进行说明。
三、单B细胞的技术类型和对应公司的商业化进展

▲单B细胞技术类型
1、基于流式细胞荧光分选法(FACS)
FACS技术通常先用抗原磁珠进行初步的抗原特异性B细胞的富集,然后利用抗原结合的荧光做流式分选出目标抗原特异性的B细胞。流式分选的速度快,每秒钟可处理上万细胞,一天可完成数千万B细胞的分析。
流式虽然基于抗原和B细胞表面BCR的结合来获取抗原特异性B细胞克隆,但无法进行功能性验证。另外,从B细胞获取抗体基因,再克隆到表达载体,后续在哺乳细胞表达进行功能验证的整体时间较长,综合下来的成本和工作量很大程度上限制了通量。且FACS假阳性率也较高,进一步增加了下游的表达验证工作量。另外要求抗原为可溶性重组蛋白,因此对于表达纯化困难的靶点也难以适用。
2、基于微流控液滴技术 (Microdroplet-based)
HiFiBio:CelliGo
将B细胞通过油包水的液滴体系分离,单个液滴反应体系里包括B细胞和携带目标抗原的载体。相比于Beacon等半封闭微流控体系,油包水所创造的液滴为封闭体系,目标B细胞在液滴中分泌抗体。基于液滴分离的微流控平台共有的优势是超高的处理通量和快速处理速度。但PBMCs来源的ASC通常低频且体外存活时间短,高通量且快速的操作处理十分重要。在单个液滴体系中,细胞无法存活很久,分泌抗体的浓度在无法进行细胞培养的条件下较低,或影响阳性率。抗体也通常按照二元结果(根据阈值判断结合与否)进行分选,难以考虑到不同功能和结合模式的复杂性。
在微流控液滴技术路径中,HiFiBio Theraeputics(高城生物)是一家代表性的公司。其CelliGo平台基于单液滴的抗体发现,每秒钟可生成5千~1万个液滴[9],每个皮升体积的液滴中包括B细胞和抗原磁珠/抗原细胞,确保单克隆性并捕获可分泌抗体的B细胞。回收的B细胞被barcode标记,裂解进行cDNA文库构建和下游测序分析[10]。基于液滴的单B细胞体系在初始的细胞处理通量上,对比Berkeley Lights nanopen、Abcellera nanowell等体系更有优势。
HiFiBio既开展管线自研也有外部合作。新冠中和抗体(HFB3013)也是HiFiBio曾经最早最快进入临床阶段的项目,也体现了B细胞技术在中和抗体开发上的优势。而目前的自研管线有三条进入临床1期,其中有两条为激动抗体,用B细胞技术外的常规抗体发现手段开发难度颇大。
3、基于微流控纳米孔技术(Microfluidic nanowell-based)
Abcellera
Abcellera的微流控体系包括带有25.6万个纳米腔室的芯片,每次筛选可运行两个芯片,因此达到约50万的处理通量。每个腔室体积不超过一纳升,利用重力装载细胞,可分泌抗体的B细胞与抗原磁珠结合,结合可被高通量的荧光显微镜所检测。作为一家带有AI标签的抗体发现公司,Abcellera是AI药物开发公司里少有能产生盈利的公司。
Abcellera曾在中和抗体的开发中大显身手。疫情早期Abcellera和礼来合作开发了Bamlanivimab,因为B细胞路径的快速开发优势,该分子成为第一个进入临床的新冠病毒中和抗体。2020年11月,Bamlanivimab获得了FDA的紧急使用授权(EUA),是B细胞抗体领域的里程碑事件。虽然后续由于该分子对突变株效果不理想,FDA将其从EUA中移除,但Bamlanivimab从开发到获批不到一年,足以说明B细胞技术用于中和抗体开发的快速与高效[11]。在外部合作上,Abcellera目前已经与40多家药企建立了深入合作关系,合作的项目里超过10个已经进入了临床的不同阶段。合作开发以收取里程碑、royalities、研发费用在可见的未来里仍然会主导Abcellera的收入。
4、基于光驱动微流控腔室技术(Microfluidic chamber-based)
Berkeley Lights:Beacon
Berkeley Lights的Beacon系统是基于光微流控的单细胞平台,整个系统的工作流分为导入、培养、分析验证、导出,可在一天内完成筛选。Beacon系统提供不同规格的芯片,芯片纵向为纳升大小的半封闭仓室(NanoPen),横向为通道(channel)。以14k芯片为例,该规格包含14000个仓室和10个通道。首先通过光驱动把细胞推到只有纳升大小的半封闭仓室(NanoPenn),进行B细胞的导入和培养,形成细胞间的物理分离,培养基等成分可以低速自由扩散到仓室。由于每个仓室的体积小,抗体分泌可以达到较高浓度,阳性B细胞所分泌的抗体扩散到通道里,包被抗原的磁珠和荧光二抗可捕获并产生荧光信号从而检测(抗原和检测形式可有多种),通过光驱动再将阳性B细胞导出回收。
除了基本的抗原结合验证,Beacon可以开展细胞结合的验证(实现抗原天然构象、克服表达困难靶点等)、配体竞争实验、种属交叉结合检测等,芯片上可以完成多个反应的检测评价。而功能性分析前置是必要的,in-chip对单个浆细胞分泌的抗体进行功能性检测,初步筛选获得的序列为具有相应功能的抗体序列,减少下游重组表达和验证的工作量。且仪器高度自动化,只有芯片预处理、上样、试剂配制上机、挑选克隆、设置导出,这几个时间节点需要简单的人工操作[12]。
虽然Beacon的技术亮点突出,但其商业化推广后继乏力。Berkeley Lights的商业模式主要依靠仪器设备与耗材的售卖,价格较为高昂。其2020年在纳斯达克上市发行市值为40亿美元,后续被做空机构发布报告并引起争议。虽然该报告将Berkeley Lights的仪器与芯片类比于普通流式细胞仪和小型化塑料孔板等说法多少有失偏颇,但不可否认的是,高达200万美元的仪器以及上千美元的耗材芯片导致Berkeley Lights后期很难大范围推广,商业化受阻。对于下游CRO、药企等客户来说,需要考虑综合的成本控制。
四、B细胞技术筛选抗体未来的机会何在
抗体作为生物药的中流砥柱,抗体发现平台长期存在改良和迭代的需求。B细胞技术路径对比现有的体内杂交瘤筛选、体外展示技术,在筛选通量、速度、hits多样性等方面有长足的优势,一定程度上保证了抗体后续更好的成药性。对于B细胞技术来说,未来的机会和发展趋势如下:
1、技术层面:更高的实际筛选通量、更广的B细胞库覆盖
单B细胞技术横向对比其他技术虽然通量高,但是理论通量和实际筛选通量并不完全匹配。首先,B细胞分离的各步骤效率存在一定折损。另外在微型反应体系中,对于筛选的灵敏度要求很高,单个Nanopen/droplet里面所含有抗体量不是太大。因此建立高灵敏度的抗体功能分析方法是必要的,且不能局限于纯结合的筛选,从结合至功能性初筛的跨越可极大减少下游表达验证时间,相应地缩短抗体开发周期。最后,在实际筛选通量提高的基础上,需要考虑更广的B细胞类型覆盖。目前的微流控平台大多针对浆细胞,而浆细胞在B细胞库里仅占有极小的比例。
2、商业化层面:不同发展路径的启示
单B细胞技术公司选择了不同的发展路径和商业模式。例如,Berkeley Lights曾依靠设备耗材的销售,Abcellera现阶段主要依托于外部合作,而HiFiBio则是管线公司。单B技术对于仪器的依赖性较强,目前商业化销售的仪器售价高,推广有一定难度。因此即便单B细胞技术具备众多优点,但可预计的是杂交瘤在未来一段时间依然重要,很大的原因在于其相对便宜、简单且为大家熟悉,毕竟任何新型技术的可及性和价格都密不可分,降低设备和运行成本是这类公司首先需要考虑的。而非销售设备、独立开发in-house单B细胞平台的公司,前期克服了极高的研发门槛,但如何发挥B细胞技术上的差异化优势,则需要在下游应用层面着重考虑。
3、应用层面:切入合适的靶点发挥更大的优势,摘取高处的果实
药企在资源允许的情况下通常会采取几种开发路径同时推进。在可用现有技术开发的靶点(“容易靶点”)上, B细胞技术是一种提供更多hits的手段,其与杂交瘤、噬菌体展示等平台更多为互补而不是替代的关系。但面临特殊和复杂类型靶点,比如中和抗体与“困难靶点”,B细胞抗体发现有着不可磨灭的优势。
首先,在面对急性病毒性传染疾病(包括SARS、MERS、埃博拉、Covid-19等)的中和抗体开发时,研发要求通常十分紧迫。单B细胞技术既能缩短研发周期,又能直接从人体中筛选全人源抗体省去后续的人源化工程快速推进临床,有极大的用武之地,是杂交瘤以及噬菌体等技术不可媲美的。
其次,容易被开发的抗体靶点很多已经成药,而针对复杂困难靶点的抗体则是挂在高处的果实。困难抗原具备单点突变、结构高度相似、人猴高度同源、胞外区域小表位有限等特征,如此挑战性的靶点包括GPCR、离子通道等。在体内通常产生很弱的免疫反应,相应所产生的抗原特异性B细胞频率也极低(通常低于10^-5),而低于10^-3的抗体就已经是低频克隆(rare binders),而单B技术在高通量和文库覆盖上的优势可以转化到此类罕见克隆的挖掘上[13]。
上下滑动查看