8月27日,智翔金泰宣布其自主研发的1类新药赛立奇单抗注射液(商品名:金立希®,产品编号GR1501,一款重组全人源抗IL-17单克隆抗体)正式获得国家药品监督管理局(NMPA)批准上市,用于中、重度斑块状银屑病的治疗。
据悉,赛立奇单抗获批规格为1ml:100mg/支,推荐用法为第0、2、4、6、8、10和12周各皮下注射200mg(100mg注射两次),后维持剂量为200mg(100mg注射两次),每4周一次。
赛立奇单抗注射液是首款获批上市的国产抗IL-17A单抗,打破了抗IL-17A单抗外资药企垄断的局面,填补了国产银屑病生物制剂领域空白。
赛立奇单抗中国注册临床试验带头人、北京大学人民医院张建中教授表示:“中国银屑病患者人群多,传统的治疗手段难以满足患者的治疗需求。赛立奇单抗注射液的问世为中国银屑病患者带来了一个全新的治疗选择,作为我国自主研发的全人源IgG4亚型的IL-17抑制剂,是我国银屑病治疗领域的一大重要补充。相信未来在中国,会有更多的银屑病患者受益于此药,改变未来银屑病患者的治疗格局。”
银屑病,俗称“牛皮癣”,是一种免疫介导的、慢性、复发性、炎症性、全身性疾病,由遗传和环境共同诱发,典型临床表现为鳞屑性红斑或斑块。流行病学调查显示,中国银屑病发病率约为0.47%,目前有近700万银屑病患者,其中约57%为中度和重度银屑病。银屑病皮损影响外观,不仅给患者的生活、工作和婚姻带来社交障碍与负面心理影响,还会并发关节炎、肥胖、高血压、重大心血管事件等多种疾病。
根据《中国银屑病诊疗现状2023蓝皮书》,近两年银屑病皮肤病生活质量指数(DLQI)评分显示轻度患者比例有轻微下降,中、重度患者比例稍有增长。但银屑病皮损面积及严重程度指数(PASI)评分、皮损占体表面积(BSA)评分显示重度患者比例有轻微下降,轻度患者比例稍有增长。相反的变化趋势反映出虽然近年间患者皮损的严重程度略有减轻,但其体验到的生活质量却在变差,提示患者对生活质量的需求在增加,临床医生应酌情给予更积极的治疗。
相较既往传统治疗,生物制剂皮损清除率更高,安全性良好,并引领相关指南更迭。《中国银屑病诊疗指南》(2023版)指出,目前临床已证实生物制剂疗效优于既往传统治疗,建议以皮损完全清除或PASI90、PGA0/1作为达到满意疗效的指标。随着生物制剂推动疗效进展,银屑病的治疗目标也从PASI 50升级至PASI 90/100。
蓝皮书指出,2020-2023年间,接受生物制剂治疗的患者比例呈现逐年上升趋势,接受生物制剂治疗与传统系统治疗合并的系统治疗患者比例显著提高。目前,国内获批上市用于中、重度银屑病患者的生物制剂主要包括早期TNF-α抑制剂与IL-17A抑制剂、IL-12/23抑制剂。诺华IL-17A抑制剂司库奇尤单抗与强生IL-12/23抑制剂古塞奇尤单抗均于2019年进入中国市场。
据弗若斯特沙利文数据,2021年,中国的银屑病药物市场规模为11亿美元,预计于2030年将增长至95亿美元,复合年增长率为27.1%。其中,生物药2021年市场占有率为29.3%,估计2030年将上升至50.3%,市场前景广阔。
当然,要闯进临床患者认知有限、生物制剂渗透率未达高值的银屑病市场并非易事。追根溯源,国产创新药需要在“内力”修炼上下苦功。
据悉,赛立奇单抗为全球唯一获批上市的全人源(IgG4亚型)、靶向IL-17A单克隆抗体。赛立奇单抗靶向IL-17A,通过抗体特异性结合、清除发病机制关键通路IL-23/IL-17轴中的核心效应因子IL-17A,阻断与IL-17RA的结合,抑制炎症的发生和发展,进而达到较高的皮损清除率,对斑块状银屑病、中轴型脊柱关节炎等自身免疫性疾病起预防、减轻、延缓的作用。
全人源抗体
全人源抗体是指完全(100%)由人源成分组成、不含鼠源成分的抗体,旨在保证亲和力不变的前提下,最大化降低不良反应发生风险。临床研究显示,赛立奇单抗无HAMA反应(人抗鼠抗体反应),即人体针对鼠源抗体所产生的反应,可使鼠源抗体加速被清除,导致重复治疗无效,有时可引起过敏性反应。2023年《银屑病生物制剂达标治疗专家共识》指出,若患者易出现过敏反应,尽量选择全人源的生物制剂。
IgG4亚型
在单克隆抗体亚型的选择上,赛立奇单抗的IgG4亚型与临床治疗目标密切相关。IgG4亚型的靶点通常位于免疫细胞,不具有ADCC/CDC效应,弱ADCP效应,细胞毒性作用低;不能对靶细胞(CTL)产生杀伤和吞噬作用,可防止过度“免疫激活”;更适合开发自身免疫性疾病的治疗。
IgG4亚型分子特有的“半分子交换”现象会导致抗体的结构稳定性不足。因此,赛立奇单抗通过自主研发的双载体噬菌体平台技术,优化IgG4骨架,将铰链区丝氨酸替换为脯氨酸(S→P),避免了半分子交换现象发生,使抗体结构更稳定。
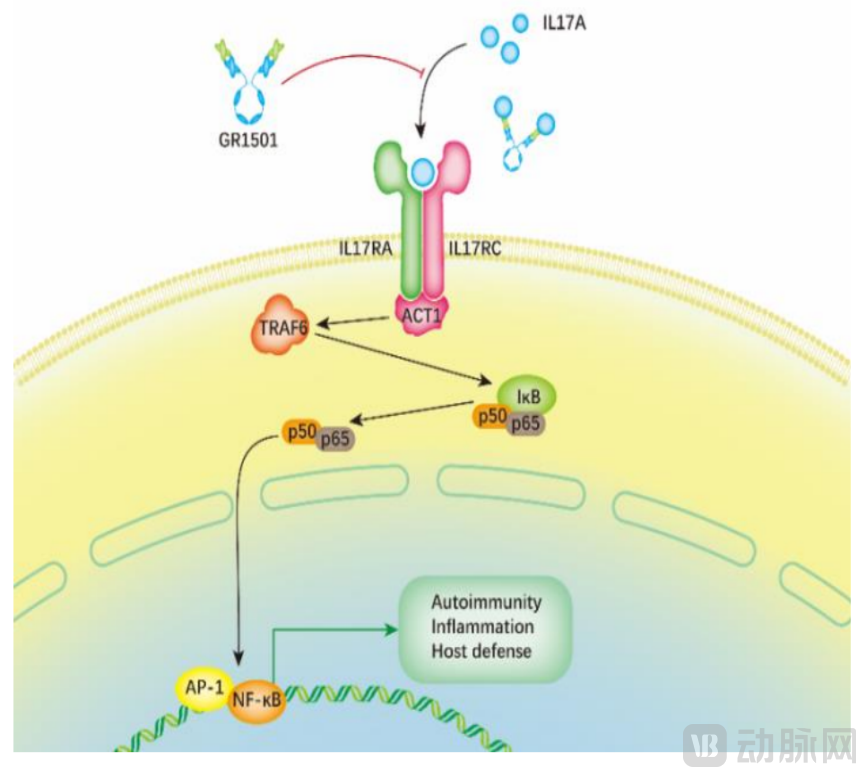
(赛立奇单抗作用机制)
卓越骨架、稳定结构,让赛立奇单抗具备高亲和力、低免疫原性与良好的抗炎效果。临床前研究观察到显著的抑制细胞炎症因子作用。Ⅲ期临床研究的60周观察数据显示,赛立奇单抗安全性良好、耐受性良好。SAE(严重不良事件)及导致退出试验的TEAE(治疗期间出现的不良事件)发生率均低于1%,绝大多数TEAE均为1-2级,且均转归为痊愈或缓解。
作为全人源、IgG4亚型的IL-17A抑制剂,赛立奇单抗在Ⅲ期临床研究数据中显示突出疗效。与安慰剂相比,赛立奇单抗起效快,试验组自第2周起皮损显著改善,在第4周达到PASI 75和PGA0/1的比例高(均P<0.001),第12周PASI90应答率为74.4%,PASI100应答率为50.2%。
赛立奇单抗的疗效持久、保持了高水平的皮损改善,患者生活质量明显改善、稳定且复发率低,52周PASI、PGA0/1数据维持稳定,复发率仅为0.4%,极大满足了银屑病患者“减少复发”的迫切需求。
赛立奇单抗的成功上市,意味着去年在上证所科创板上市的智翔金泰迎来了首款商业化产品。配合有力的商业化打法和市场开拓计划,智翔金泰在营收端预期可观。
据披露,智翔金泰近日已与华润医药商业集团、北京圆心科技集团股份有限公司、重庆医药(集团)股份有限公司、上药控股有限公司达成战略合作,将基于各自优势深度合作,实现产品的快速市场覆盖。产业化能力方面,智翔金泰于2022年启动抗体产业化基地项目一期改扩建建设,目前已完成新增20000L的生物发酵产能,总产能达到24400L,可快速支撑新药商业化生产。此外,抗体产业化基地二期项目拟新增40000L的生物发酵产能。
快速推进商业化的同时,智翔金泰也在不断垒高药物发现与源头创新的壁垒。赛立奇单抗就孵化于智翔金泰自研新型抗体药物发现平台,经由大容量全人源抗体库中筛选先导分子,快速优化和改造抗体药物,提高药物分子亲和力、特异性、表达量及人源化程度等,打破传统抗体筛选技术效率低的瓶颈。
抗体发现环节,智翔金泰拥有基于新型噬菌体呈现系统的单抗药物发现技术平台和双抗药物发现技术平台;药物开发环节,智翔金泰建立了高效的重组抗体药物工艺开发平台,已完成了十余个治疗性抗体的工艺开发和中试生产。
此外,智翔金泰在管线布局上采取自免与感染性疾病双线并行的策略:赛立奇单抗第2个适应症——放射学阳性中轴型脊柱关节炎的上市申请已被受理;GR1802启动中、重度特应性皮炎和慢性鼻窦炎伴鼻息肉Ⅲ期临床试验;全球首个用于狂犬病被动免疫的双特异性抗体GR1801进入Ⅲ期临床试验;抗破伤风单抗GR2001注射液和抗BCMA×CD3双特异性抗体GR1803注射液已陆续被CDE纳入突破性治疗品种。
曾经,虽然自身免疫疾病作为全球第二大疾病市场,在中国仍面临诸多挑战:市场放量缓慢,公众教育、临床拓展与产品推广困难重重。然而,未被充分挖掘的临床需求预示着潜在的蓝海市场,为长期致力于自免药物创新的国产创新药企留下了广阔的探索空间。
如今,这一局面已发生根本性转变。“无药可用”“不知特效药”的现状已成为历史。跨国MNC纷纷入局自免赛道、进口创新药纳入医保、国产创新药接连上市。国产创新生物制剂在疗效、性价比、本土临床数据等都将助力渗透率仍处于低值的银屑病生物制剂市场快速打开。
前有进口生物制剂打开患者及市场教育的大门,后有疗效确切、临床数据优异的国产创新生物制剂继续开疆拓土,自身免疫性疾病的生物制剂蓝图已经展开,临床患者也将获得更多高效、优质的国产药物选择。





























