2024年8月7日,上海欣吉特生物科技有限公司正式向欧盟递交了其核心产品 “牛心包人工心脏瓣膜” 的CE MDR认证申请,标志着公司在国际化之路上迈出了一大步,具有里程碑式意义。
2018年10月,公司与比利时鲁汶医学院(KU Leuven)合作,由院长Prof. Dr. Paul Herijgers完成了首例“欣瓣膜”的CE Mark患者植入。此后相继在比利时、德国、波兰等多家欧洲知名医院开展了临床试验,均取得了满意的研究结果,为此次成功递交MDR认证申请奠定了坚实基础。

Cingular是一款设计经典的环上生物瓣膜,该产品突破性的解决了临床上生物瓣膜开口面积(EOA)较小、容易发生人工瓣膜-病人不匹配(PPM)的问题,其相同型号瓣膜的有效开口面积(EOA)较同类产品平均增加30%~50%,且小瓣优势更明显,更适应亚洲人群小瓣窦的解剖学特点。
与传统机械瓣相比,生物瓣膜有着无需终身服用抗凝药物和高质量的术后生活等优势。据悉,国内生物瓣膜应用比例约20%-30%,临床上往往追求更大的EOA为小瓣患者(约占30%)使用机械瓣,而“欣瓣膜“更大的开口面积不仅为这部分小瓣患者提供了使用生物瓣的机会,更为年轻患者未来瓣中瓣(VIV)预留足够的空间,使患者能够终身受益。
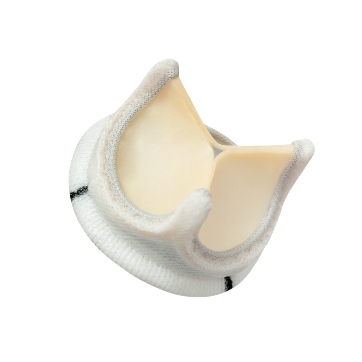
● 严选进口2岁青壮小牛心包,胶原组织佳,延长使用寿命。
● 全球专利,三层套环瓣座,稳固耐久,疲劳试验超9亿次。
● 薄瓣脚、软缝环设计,助力微创小切口手术,轻松植入
欧洲临床研究概述
为研究Cingular主动脉瓣生物瓣膜的有效性和安全性,自2018年起开展的这项前瞻性、国际多中心、单臂临床实验研究。
基线数据显示(在基线时),患者中62.5%为男性,37.5%为女性。男性和女性患者的平均年龄分别为70.9(60.0-82.0)岁和71.7(63.0-81.0)岁,术前平均EuroScoreII评分为1.91。
其中使用23A型号的主动脉瓣膜患者最多,约占45.8%,其次较多的是39.6%的患者使用了21A型号。
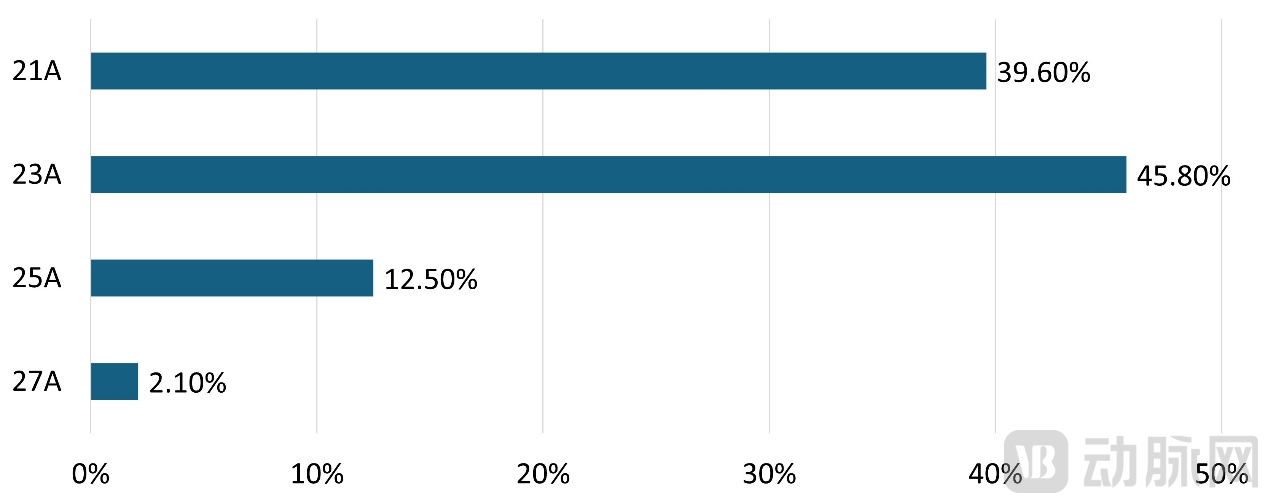
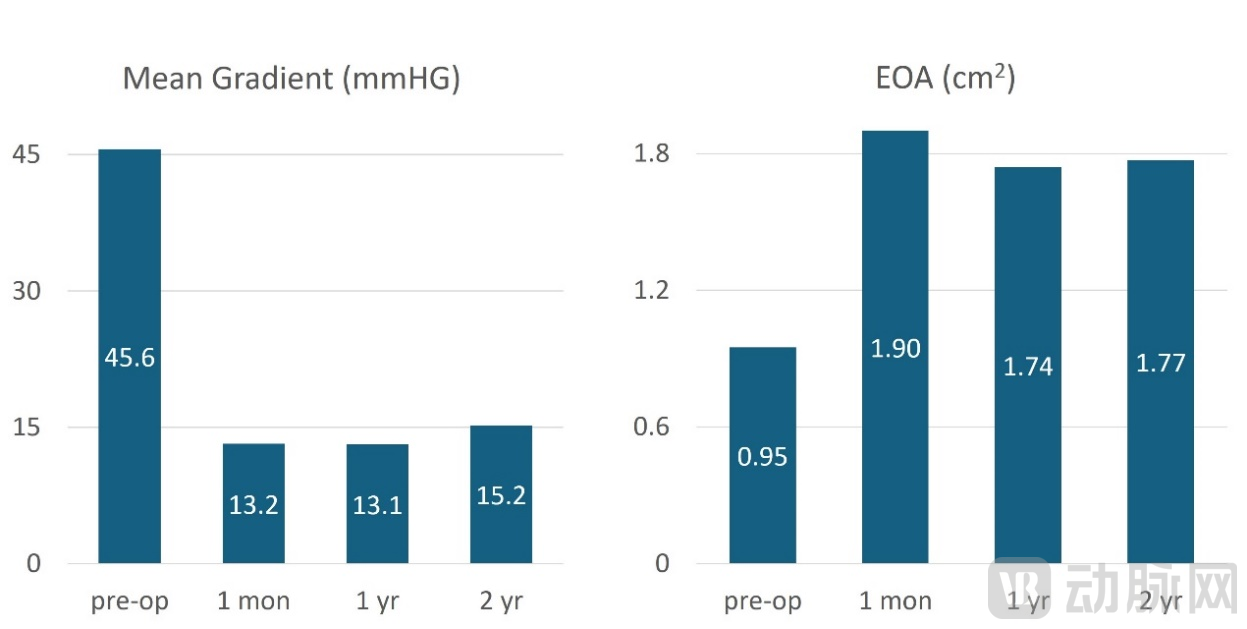
主要有效性终点方面,术后1个月随访时,患者主动脉瓣口平均开口面积从术前0.95cm2增加到1.9cm2,随着时间的推移,这些数据结果是一致的,术后2年的平均瓣口面积达1.77cm2。同样,患者主动脉瓣平均跨瓣压差从术前 45.6 mmHg 降低到术后1个月13.1 mmHg,且随着时间的推移,该结果也具有一致趋势。
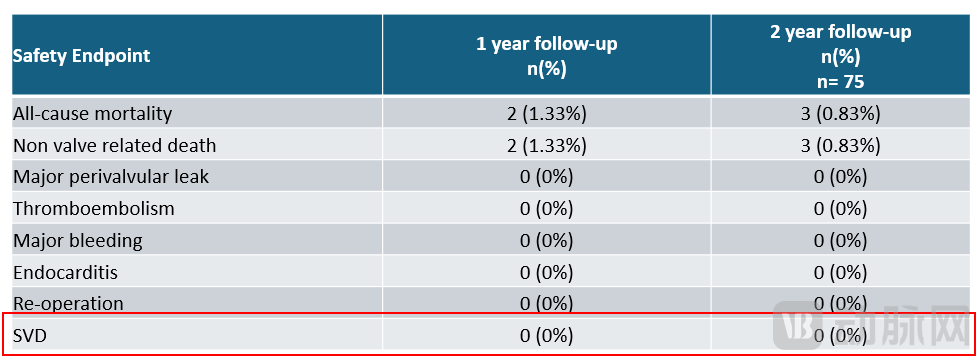
安全性终点方面,瓣膜术后2年全因死亡率仅为3例,分别为尿脓毒症(1例),动脉瘤破裂(1例),结肠扭转导致的心脏骤停(1例),均与瓣膜无关。术后2年均未出现再次手术事件,且无瓣膜结构性衰败。
欣吉特创立以来,布局海外市场一直是公司发展的重要战略方向。此次正式递交CE MDR申请,意味着欣吉特的国际化目标又向前迈出了坚实的一大步。未来,在提升现有产品国际竞争力的同时,我们还将加大创新研发力度产品,以适应不同国家、不同患者人群的医疗需求。相信很快,国外的瓣膜病患者就能用上来自中国的全新解决方案。

● 美国Case Western Reserve University生物医学工程博士
● 30余年心脏瓣膜研发经历,曾是国际巨头瓣膜公司首席研发科学家
● 中国药监局心血管植入物分技术委员会专家委员
● 中国食品药品检定研究院医疗器械检定所瓣膜工作组专家
我与欣吉特结缘于2018年,此后,我们共同开启了一段愉快的临床研究之旅,这是中国本土研发的外科生物瓣膜产品首次在欧洲开展的多中心临床研究,让我切身感受到了中国“智”造在欧洲应用的无限前景。这款瓣膜具有较大的有效开口面积(EOA),不仅有助于延长瓣膜的使用寿命、降低再次手术风险,还能够提高患者的生活质量和满意度。我祝贺欣吉特公司团队完成了这项具有里程碑意义的研究。

● 波兰克拉科夫雅盖隆大学医学院 心血管外科、移植学终身医学教授
● 欧洲心胸外科协会/心脏病学会委员成员、波兰心胸外科医师协会/波兰心脏病学会委员成员
● 循环、循环心血管介入、波兰心脏杂志、欧洲心血管外科杂志国际医学期刊审稿人,迄今已发表200多篇学术论文
欣吉特生物成立于2010年,是一家致力于研发、生产和销售生物类供人体植入高端医疗产品的高新医疗企业。目前公司取得NMPA的产品包括硬脑(脊)膜补片、牛心包生物瓣膜以及心外科生物补片。
公司拥有20位+海外研发顾问、欧洲临床技术顾问及供应链管理团队,仍致力于探索与创新,前瞻性地布局了一系列高附加值的产品,如免缝瓣、介入二尖瓣等等。此外,欣吉特生物还积极布局了多条外科补充产线,将形成一套完整的“外科产品矩阵”。
此次CE MDR认证的递交,不仅彰显了公司实力和市场潜力,也预示着欣吉特生物即将迈向更广阔的全球市场,直面全球竞争!

MDR 是医疗设备和配件投放欧洲市场时,制造商需要遵守执行的法规,自2021年5月起,只有获得CE标志批准后,方可在欧洲经济区的30个国家/地区销售产品设备。
CE标志是一种安全认证标志,在欧盟市场属于强制性认证,无论是欧盟内部企业生产的产品,还是其他国家生产的产品,想在欧盟市场自由流通,就必须加贴“CE”标志,以表明其符合欧盟《技术协调与标准化新方法》法规的基本要求。




























