10月24日,人工智能基因治疗平台开发商Dyno Therapeutic宣布与罗氏(Roche)达成第二项研究合作,开发针对神经疾病的下一代腺相关病毒(AAV)载体基因疗法。根据此次新合作协议,Dyno将进一步向罗氏提供其领先的平台和序列设计技术,促进体内基因递送。
罗氏将向Dyno支付5000万美元的预付款,此外在研究阶段还会进行额外付款,并有望根据临床前、临床期和销售里程碑支付总计超过10亿美元的款项。
Dyno和罗氏的首次合作可以追溯到2020年10月,以开发用于神经系统疾病和肝脏定向基因疗法的下一代 AAV 载体,合作价值可能超过18亿美元。
根据新协议条款,Dyno将负责设计和发现具有改进功能特性的全新AAV衣壳。罗氏则负责进行衣壳验证研究,并推进多个利用Dyno开发创新衣壳的神经基因疗法候选产品,进行临床前、临床期及商业化活动。
AAV是当下基因治疗领域的主旋律。目前临床上使用的大多数天然存在的AAV载体/重组AAV衣壳,它们在氨基酸序列和生物特性上与天然AAV密切相关,甚至完全相同。由于缺乏对衣壳的优化,这类自然选择的衣壳,在许多目标组织中显示出有限的细胞靶向特异性和较低的体内转导效率。对于天然的AAV衣壳,其固有的免疫原性会对治疗的安全性和疗效产生一定的影响。而人体预先存在的体液免疫和细胞免疫也会限制病人的疗法和疗效。
目前,获得新衣壳的方法包括挖掘衣壳的自然发生序列多样性、合理设计和定向进化。以定向进化为例,即在组成AAV病毒衣壳的衣壳蛋白中,让直接接触靶细胞的衣壳蛋白的特定氨基酸发生随机突变。通过评估哪些氨基酸变化可以将AAV递送到靶组织,并在艰巨的迭代过程中将突变依次层叠,改进所需的AAV特性。
理性设计(rational design)或随机诱变等的传统方法,各有其缺点,前者受限于文库大小,后者受限于较低的质量。Dyno的机器引导设计(machine-guided design)正是应用数据驱动、机器学习进一步赋能定向进化等方法。Dyno联合创始人兼首席执行官Eric Kelsic博士曾表示,“高通量技术与机器引导设计相结合,为构建出优秀的高度定制的AAV变体用于未来的基因疗法奠定了基础。在这项新的研究中,我们证实即使是一种简单的数学模型,只要有足够的数据支持,也能成功地产生有活性的合成衣壳。在蛋白质工程中,这种迭代和经验方法使我们能够兼具理性设计和随机诱变的优点,并产生大量高质量的衣壳变体。”
Dyno专有CapsidMap™平台开辟了识别新型衣壳(病毒载体的细胞靶向蛋白外壳)的新方法,具有每月在动物体内进行数十亿次序列-功能检测的能力。CapsidMap™平台通过提高靶向能力、有效载荷大小、免疫逃避、可制造性来克服天然存在的病毒衣壳的局限性。通过构建大量详细的合成AAV 衣壳序列空间图谱,该平台可以实现快速导航,以发现具有变革潜力的增强型基因治疗载体:
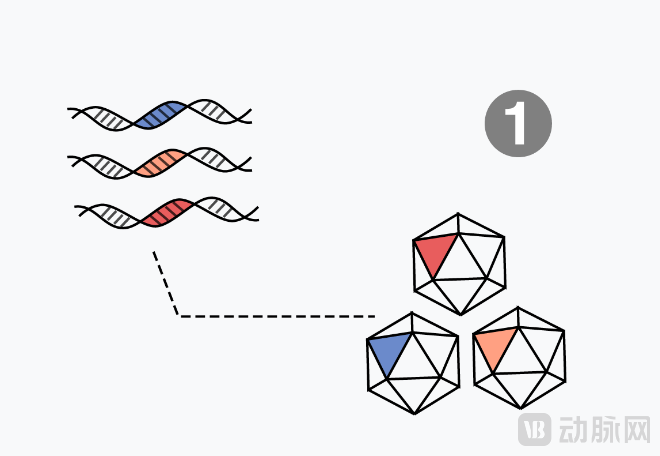
首先建立合成编码修饰衣壳的DNA文库:设计了数百万个衣壳序列,然后在DNA打印机(DNA printers)上合成并组装成衣壳文库。
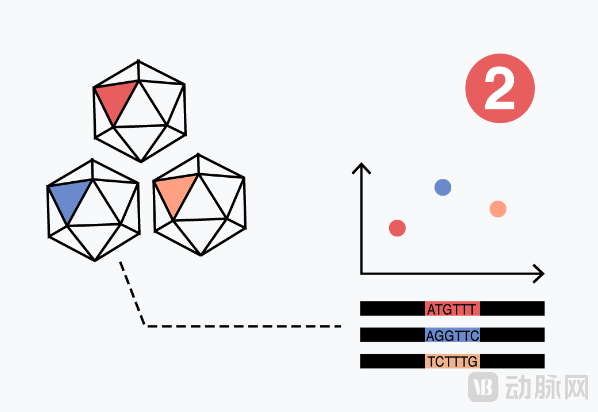
其次,对衣壳特性进一步高通量测量:使用新一代高通量测序,衣壳可追踪DNA条形码,识别文库中的单个衣壳变体。在具有数百万个衣壳的混合实验中,平台可同时测量对治疗成功至关重要的多个特性及指标。
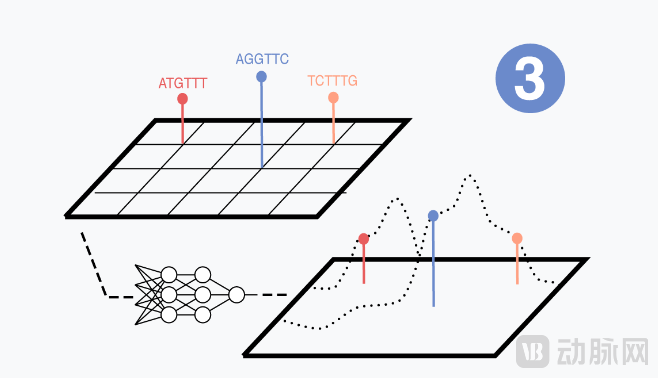
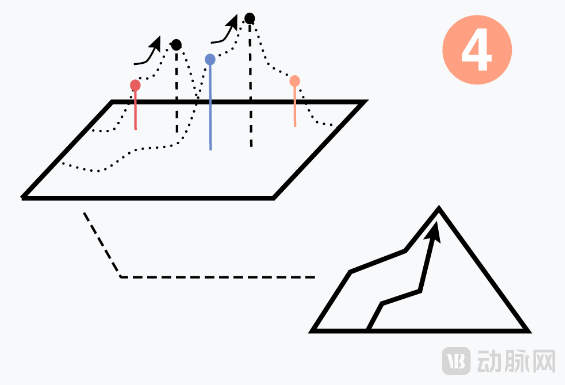
进而,Dyno团队搭建、训练基于衣壳功能空间(fitness landscape,适应度地形)的机器学习模型,预测新序列的功能,构建 AAV 衣壳的功能空间。随着每一次新实验,对于衣壳的功能空间理解更详细。进而,模型能够在探索和优化之间取得平衡、搜索,以寻找优秀的改进衣壳。
Dyno科学联合创始人George Church教授曾说,“利用AAV衣壳库产生的信息,我们还能够设计具有比以前的天然变体或合成变体更多突变的衣壳,而且产生的有活性的衣壳的效率远远超过通过随机诱变方法产生的AAV衣壳。”此外,还可以将衣壳靶向新的器官和细胞类型来治疗新的疾病。”
据悉,Dyno目前主要有2条在研载体管线,分别是大脑基因递送的bCap1载体和眼部基因递送的eCap1载体。Dyno bCap 1载体在静脉注射后穿过血脑屏障,能够更安全、更微创地以低剂量递送到整个CNS中的不同细胞。Dyno eCap 1载体使用玻璃体内注射有效转导 NHP 视网膜中的所有主要细胞类型,从而能够更有效地递送眼部基因疗法。两者都已通过体内研究得到验证。
基于CapsidMap™平台,Dyno在5年内与多家MNC达成多个器官及相关疾病领域的研发合作:
2020年5月,Dyno在推出CapsidMap平台的同时,与诺华、罕见病药物研发公司Sarepta Therapeutics达成合作,预计带来超过20亿美元的资金。Dyno将为两家公司的实验性基因疗法量身定制新的AAV载体,与诺华的合作主要聚焦于眼部疾病;与Sarepta 的合作主要聚焦肌肉疾病。
2021年,Dyno又与安斯泰来建立研发合作,开发用于骨骼肌和心肌的下一代AAV基因治疗载体,合作总价值超过16亿美元。 2020年和2024年(此次合作),Dyno又两度合作罗氏,合作总价值超过28亿美元。
同时,Dyno也在不断扩大其平台建设,迭代模型。当使用适当、大型、多样化的数据集,配合足够快速和通用的计算资源进行训练时,序列设计算法会变得更加强大。今年5月,Dyno与英伟达合作,加速推进生物序列设计。此项合作将利用Dyno领先的人工智能和体内实验技能,并结合英伟达可扩展的人工智能驱动药物设计平台BioNeMo。
Dyno的推理和设计管道依赖于英伟达的加速计算。英伟达将通过其云基础设施、软件和BioNeMo 框架支持此次合作。这将使Dyno能够以更高的速度研究和部署先进的机器学习模型以进行序列设计。同时,Dyno的机器学习科学家和工程师将与 NVIDIA AI 专家合作,扩展、增强和优化Dyno的AI 驱动的推理和搜索算法,并通过英伟达AI Enterprise 旗下的NVIDIA NIM微服务和BioNeMo提供服务。
创立于2018年的Dyno能以如此快的速度打开全球合作渠道,除了过硬的平台和实验数据外,其强有力的创始团队也为其提供了早期背书。
2018年,哈佛大学威斯(WYSS)生物启发工程研究所核心成员George Church教授及其团队,与瑞典卡罗林斯卡医学院(Karolinska Institute)、瑞典隆德大学(Lund University)的研究人员联合成立了Dyno。
Dyno科学创始人、科学顾问委员会成员George Church教授,为美国三院院士、“人类基因组计划”领军人物、个人基因组学、基因编辑以及合成生物学领域鼻祖,阿里巴巴“达摩院”首批学术咨询委员会成员、哈佛医学院遗传学教授。
联合创始人兼首席执行官Eric Kelsic博士为George Church教授的前博士后研究员,拥有哈佛大学系统生物学博士学位和加州理工学院物理学学士学位。在George Church实验室,Eric Kelsic博士开发了Dyno人工智能驱动的衣壳工程平台的基础技术。不仅成功测量了AAV衣壳蛋白的第一个综合功能空间(fitness landscape),并共同发现了AAV MAAP(膜相关辅助蛋白)基因。
在2次总价值超28亿美元的研发合作背后,是罗氏在CNS领域的执着。
阿尔茨海默病方向上,罗氏虽然已有两款Aβ单抗药物gantenerumab和crenezumab的临床表现不尽人意、终止开发,但仍有靶向Aβ/TfR的双特异性抗体Trontinemab在研,表现出穿越血脑屏障、亮眼的临床数据。
相比之下,Aβ抗体治疗阿尔茨海默病的Leqembi(渤健,卫材)已于2023年获得FDA完全批准上市,成为20年来FDA首款完全批准的阿尔茨海默病药物。2024年7月,第二款Aβ抗体礼来的donanemab也获得FDA批准上市。
不过,在人类探索程度较低的CNS领域,仍有广阔的药物研发与疗法研究空间。Leqembi 和 donanemab显示出一定减缓AD疾病恶化的能力,但无法停止或逆转疾病的进展,并伴随副作用,如脑水肿和出血等。
新闻稿中提到,罗氏业务发展主管 Boris L. Zaïtra说:“我们致力于在这一领域(CNS)取得重大进步。之前与 Dyno Therapeutics 的合作使我们非常有信心增加对治疗性基因递送的投资,以支持我们的神经系统疾病产品组合。”
2024年,罗氏在CNS领域上展现出对于基因疗法的高度关注。除此次对于Dyno的超10亿美元合作,8月罗氏旗下基因泰克与Sangamo Therapeutics达成总价近20亿美元授权协议,开发静脉输注的基因疗法,治疗包括阿尔茨海默病在内的神经退行性疾病。布局阿尔茨海默病基因疗法。同时,基因泰克获得使用Sangamo公司的AAV衣壳STAC-BBB的权益。这款AAV衣壳在非人灵长类动物模型中表现出强力穿越血脑屏障(BBB)的能力。
参考材料:
动脉网《Dyno完成1亿美元的A轮融资,人工智能深入基因治疗,开启AAV衣壳的改造之旅》
生物谷《Science:利用机器引导设计方法优化AAV病毒衣壳》





























