间充质干细胞(MSCs)是一类来源于骨髓、脐带、脂肪、胎盘等组织的多能干细胞,具备自我更新、多向分化等再生特性,还具有调节免疫系统、影响受损组织周围微环境,以及增强组织修复的归巢和营养等特性,是干细胞疗法的主要种子细胞来源之一。在全球干细胞药物临床管线中,MSC管线占比近70%;在全球已上市的19款干细胞药物中,有16款是MSC药物,占比超80%。另据Research Nester报告显示,2024年MSC全球市场规模已达39.3亿美元,预计2037年将达233.7亿美元,年复合增长率超14.7%。
不难看出,MSC已成为干细胞治疗领域最热门的“主力军”。但是,传统MSCs是混合细胞群,包含免疫抑制、促血管生成、靶向部位迁移和趋化等多种功能亚型,且不同亚群表达比例存在巨大差异,导致MSCs群体之间存在显著差异,从而无法精准匹配疾病需求。当下,MSC疗法正陷入实验室与临床疗效不一致的困局。精准亚型MSC是从MSCs中分选出某一类含有特定标志物的MSC,可从根本上解决MSC异质性问题,从而解决MSC临床有效性不稳定的难题。因此,从混合MSCs到精准亚型开发,是MSCs领域从基础研究走向成熟制药工业的必由之路。
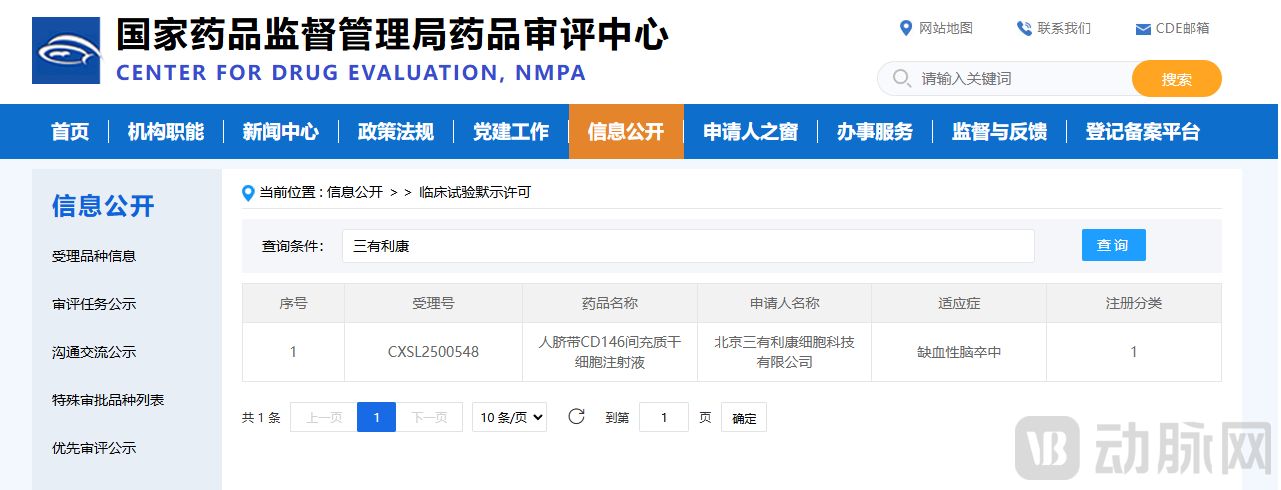
近期,北京三有利康细胞科技有限公司(简称“三有利康”)自主研发的人脐带CD146间充质干细胞注射液正式获得CDE的临床试验默示许可(受理号:CXSL2500548)。人脐带CD146间充质干细胞注射液作为国内首个获批IND的精准亚群MSC(间充质干细胞)管线,有望突破MSC领域疗效不一致的临床困境,为脑卒中等重大疾病患者带来精准治疗的新希望。
创始团队来自军科院,
聚焦“精准亚型”MSC
2021年5月,三有利康依托北京吴祖泽科技发展基金会和中关村三有利再生医学研究中心正式成立,聚焦细胞治疗技术和产品开发。该公司创始成员均具备军事医学研究院科研背景,深耕细胞与基因治疗领域数十年。
创始人兼首席科学家王立生教授,师从中国科学院院士、中国干细胞之父吴祖泽院士,是干细胞和基因治疗药物研发领域的资深专家。在科研领域,王立生教授曾先后承担“国家重点研发计划”“国家新药创制重大专项”等20余项研发课题,发表研究论文120余篇,申请及授权发明专利20余项;在临床转化领域,王立生教授先后获得新药临床批文3项、国家科技进步奖二等奖1项、省部级科技进步奖一等奖2项及军队科技进步奖一等奖1项。
联合创始人、执行总经理兼首席技术官孙慧燕博士,在血液肿瘤发病机制及细胞治疗的基础研究和转化方面有深入研究。孙慧燕博士曾主持和参与博士后基金、“863”“973”及国家“重大新药创制”重大专项及国家自然科学基金共计20余项;参编译著1部、专著2册,发表30余篇专业领域论著,获得专利7项,获得部队科技进步奖二等奖1项。
提及过往经历,孙慧燕博士回忆,“2001年,我刚进入军科院科研课题组时,身边已经有师兄师姐针对间充质干细胞、胚胎干细胞、质粒及腺病毒载体药物等前沿疗法进行基础及应用转化研究,目前已有疗法完成了三期临床,进入申报上市阶段。2016年,我们团队在军科院蛋白质工程中心(昌平生命科学园)主导参与筹建了一个超4000平米的细胞治疗中试车间,用于质粒、慢病毒载体、免疫细胞、间充质干细胞等产品的开发及中试生产,该平台的建设为团队的后期细胞基因药物开发奠定了良好的基础。”
从孙慧燕博士的过往经历中,我们可以窥见,其实早在20多年前,国内就有团队开始了细胞与基因治疗领域的研究和转化,但该领域直到目前还未实现大规模商业普及,是因为还有诸多待解决的痛点。以MSC为例,目前MSC稳定成药还面临疗效不均一、疗效不可预测、无法稳定大规模生产、商业化成本高等多个关键挑战。
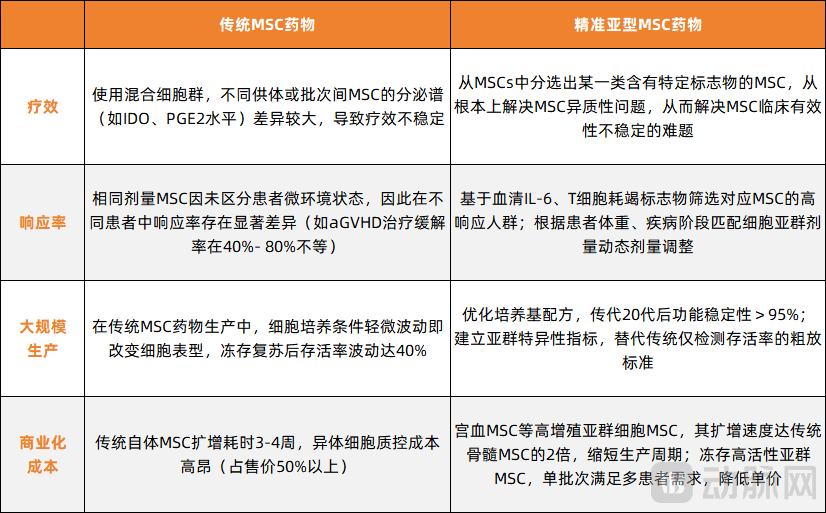
孙慧燕博士解释,“过去二十年,行业内进行了大量MSC的基础研究、临床试验,也积累了丰富的数据。基于这些数据,行业内对MSC药物的功能机制、伦理、安全性、成药路径等,有了更清晰的共识。但MSC药物的疗效,却始终无法保持均一。这是因为,哪怕来自同一组织的原代细胞,经过不同培养代次、不同生产批次,其产品的细胞功能也会存在差异,从而导致疗效的波动。”
MSC药物的细胞异质性,导致疗效的波动,是行业内一直存在但从未“根治”的问题,也是三有利康能够在MSC领域实现后发先至的核心切口。针对上述痛点,三有利康团队开发了精准亚型MSC药物。精准亚型MSC是从MSCs中分选出某一类含有特定标志物的MSC,其通过将“细胞药物”的活性成分定义得更加清晰与标准,能从根本上解决MSC异质性问题,最终实现MSC药物的高效、安全、稳定和可预测。
“CD146+MSC”
推动行业进入“亚型竞争”时代
三有利康提到,“从传统的混合MSCs到精准亚型开发,是MSCs领域从基础研究走向成熟制药工业的必由之路。”在数十种MSCs特异性标志物中,研究和探索一个明确的MSC亚群的功能优势,则可以在很大程度上保证细胞功能的稳定性和可靠性。
三有利康团队分析了大量文献并完成了相关的概念验证,最终选择以CD146切入MSC赛道。CD146是一种功能性MSC亚群标志物,在过去的30余年研究中,该标志物已经被验证深度参与人体的早期发育、免疫应答、代谢等生理过程,以及在肿瘤、炎症、自身免疫病中都发挥着重要作用,其作用机制十分清晰。CD146 + MSC是间充质干细胞中具有高增殖、强免疫调节和血管生成的“精锐部队”。缺血性脑卒中动物模型及细胞功能实验研究显示,这一亚型通过以下机制实现精准治疗:
①免疫调控:CD146+MSC可调节缺血性脑卒中受试者血流再灌注后的TNF-α、iNOS和IL-6等炎症相关因子的表达;差异性调节T细胞亚群的增殖与功能,重塑免疫平衡;改善大脑缺血再灌注后的炎症损伤,显著减少脑部梗死面积;②再生激活:CD146 + MSC促进血管网络生成,改善循环,实现神经血管单元保护和神经功能改善。
三有利康利用CD146+MSC更强效的免疫调节能力和血管生成能力,精准治疗缺血性脑卒中。缺血性脑卒中是脑卒中的主要类型,其治疗旨在恢复脑组织的血流灌注、改善循环、神经保护,最终实现神经修复与功能恢复,改善长期预后。临床针对溶栓或取栓后的缺血性卒中患者,主要进行消除自由基、营养神经等药物治疗,实现急性缺血期的神经功能保护,为后续缺血恢复期的认知功能和运动功能改善奠定基础。目前,间充质干细胞治疗缺血性脑卒中的临床试验占全部适应症不足5%。一方面,临床需要更高效的创新型治疗产品;另一方面,亟须探索相关疗效指标。
三有利康此次获批的人脐带CD146间充质干细胞注射液,定位于神经血管单元保护,在亚急性期的多次输注,通过归巢和旁分泌效应减轻组织受损、调节炎性相关因子分泌和T细胞活性、促进血管网络生成等方式,改善缺血性脑卒中所致的神经症状、日常活动能力和功能障碍;减少复发率,展现出良好的临床应用前景。
除了缺血性脑卒中这一适应症,三有利康还围绕CD146+MSC布局了其他四款在研管线,涵盖免疫性血小板减少症、卵巢功能早衰、肝衰竭、脓毒症等多个适应症。孙慧燕博士告诉动脉网,“CD146+MSC 管线更清晰的机制和更统一的亚群,能够有效解决MSCs的‘多靶点’作用机制与传统单靶点药物评审体系冲突,增加审批成功率。低异质性带来的更稳定的疗效,也让三有利康在临床Ⅱ期和Ⅲ期的大规模人群试验中,有望实现临床进度的加速超车。”
基于完整细胞药物临床经验,
稳步推进三大板块数条管线
除了基于干细胞治疗技术平台,重点布局了五款CD146+MSC管线之外,三有利康还建立了靶向免疫细胞治疗技术平台、细胞衍生物平台,并分别布局了相关管线产品。
基于免疫细胞治疗技术平台,三有利康布局了数款靶向免疫细胞疗法。该团队通过体外抗体修饰技术,将自体或异体来源的NK细胞定向改造为精准识别CD123靶点的“生物导弹”,在2周内实现数十亿级扩增的同时保持>90%细胞活性,显著提升对AML细胞的清除效力。更为重要的是,在进行体外抗体修饰之后,该药物可以“更温和”地达到有效的疗效,老年患者也可以选择使用该疗法。
基于细胞衍生物治疗技术平台,三有利康在开发细胞新药的过程中,伴随进行了外泌体工艺研究、干细胞功能评价试剂盒、干细胞培养基等生命科学应用材料,并与相关产品联合申报。
孙慧燕博士告诉动脉网,“这三个技术平台各自独立又互有交叉,例如三个平台会有共用质控方法、检测方法、技术背景等,但其产品布局又各有差异。”此外,上述平台的建设,对内可助力自研管线产业化,对外可赋能精准细胞治疗领域的产业链伙伴,为合作伙伴提供相关服务。
这也是三有利康能够快速推进管线的重要原因之一,公司在赋能产业的同时,也通过项目的积累,强化其产业链经验。在公司成立之前,三有利康团队曾深度参与多个细胞基因治疗药品的开发工作,并完成相关临床研究项目,积累百余例病例研究资料,为新一代细胞药物开发奠定了坚实基础。 目前,CD146+间充质干细胞亚群药物获得临床批件后,正准备在北大医院等机构进行临床探索性试验;靶向NK细胞药已在301医院开展备案研究。
随着管线的推进和不断突破的里程碑,三有利康目前也在同步推进市场化融资与BD合作。对于未来,孙慧燕博士表示,“短期内,三有利康将重点推进CD146+MSC针对缺血性脑卒中的临床试验,让行业通过真实临床数据看到精准亚型MSC的临床价值。未来,三有利康将依托此前数十年细胞药物研发积淀与前沿技术洞察,逐步将管线推向临床和市场,最终构建具有持续生命力的细胞药物产品矩阵,为广大适应症患者提供循证可依、可及、可负担的精准治疗解决方案。”




























