11月17日,国家药品监督管理局(NMPA)发布的药品通知件送达信息显示,礼来公司的替尔泊肽注射液在列,所涉四个受理号分别为JXHS2400108、JXHS2400109、JXHS2400110和JXHS2400111。显示的签发日期为2025年11月14日。
根据国内现行的新药审批流程,如果药物顺利获批,则会收到“药品批准证明文件送达信息”,如果收到的是“药品通知件”, 则表示此次申请暂未成功获批。当然 , 收到“药品通知件”, 也并不意味着药物上市的彻底失败,理论上存在着完善补充数据之后,继续申报流程的可能性。
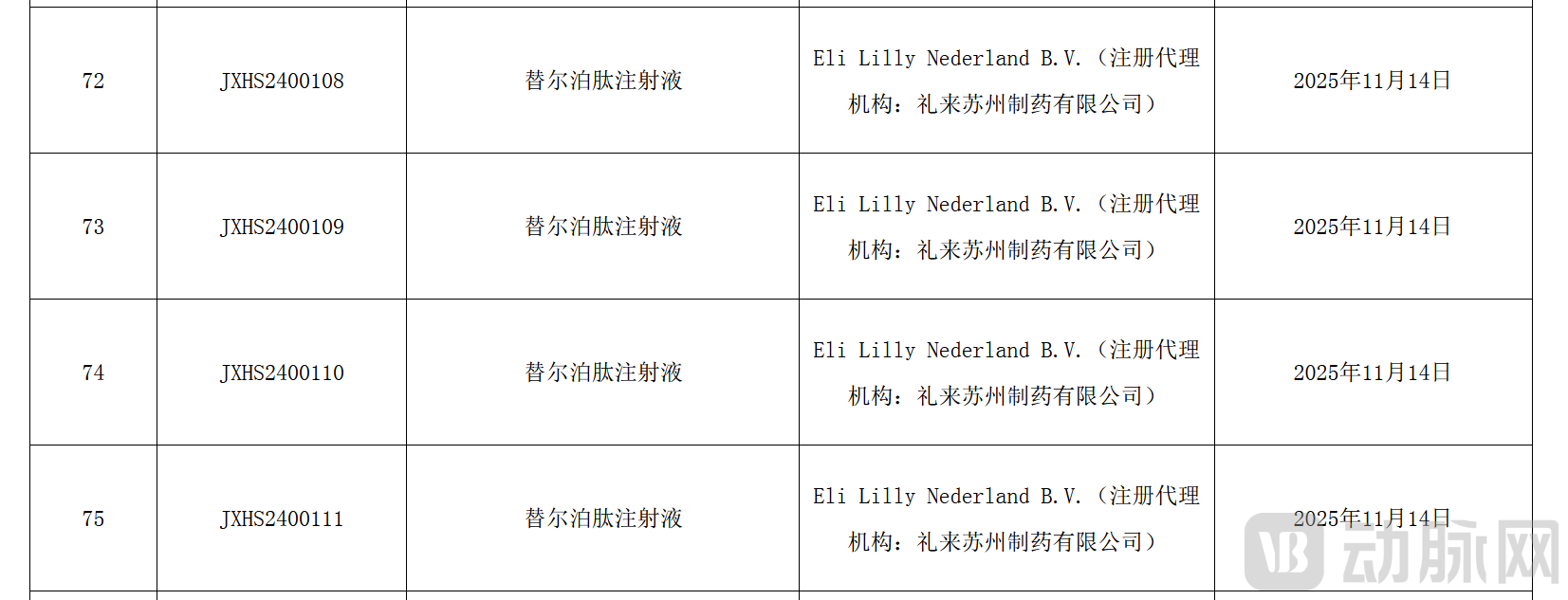
来源:国家药品监督管理局
据业内推测,申请所涉适应症为“合并肥胖的射血分数保留型心力衰竭”,此适应症在美国也还处于注册审批中。在中国,替尔泊肽已获批三项适应症:在饮食控制和运动基础上,接受二甲双胍和/或磺脲类药物治疗血糖仍控制不佳的成人2型糖尿病患者;在饮食控制和运动基础上,联合胰岛素(伴或不伴口服降糖药)治疗,改善成人2型糖尿病患者的血糖控制。在控制饮食和增加运动基础上,用于初始体重指数(BMI)符合以下要求的成人的长期体重管理:≥28kg/m2(肥胖),或≥24kg/m2(超重)并伴有至少一种体重相关合并症(例如高血压、血脂异常、高血糖、阻塞性睡眠呼吸暂停、心血管疾病等)。在控制饮食和增加运动基础上,治疗成人肥胖患者的中度至重度阻塞性睡眠呼吸暂停(OSA)。





























