
2025年11月18-22日,第52届VEITHsymposium2025年会在美国纽约隆重召开,来自海迈医疗科技(苏州)有限公司创始人邱雪峰教授在19日血管通路专题大会上,隆重介绍了公司自主研发的国产首款小口径生物型人工血管LineMatrix耐迈通®FIM临床试验结果,同时特邀该临床试验PI、浙江大学医学院附属邵逸夫医院肾内科李华教授分享了LineMatrix耐迈通®生物型人工血管的独特优势。2025年6月LineMatrix耐迈通®生物型人工血管FIM临床试验圆满完成术后6月随访,临床结果优异,LineMatrix耐迈通®是人工血管国产化替代进程中的里程碑产品。

邱雪峰教授:非常荣幸接受VEITHsymposium2025大会邀请在国际讲台上展示LineMatrix耐迈通®生物型人工血管的临床试验结果。海迈医疗经过多年研发,作为国产首款小口径生物型人工血管LineMatrix耐迈通®于2024年9月进入临床试验阶段,该FIM临床试验已在2025年6月圆满完成术后6月随访,初步证实其安全性和有效性。下面有请本临床试验PI、浙江大学医学院附属邵逸夫医院肾内科李华教授分享LineMatrix耐迈通®的临床使用经验。
李华教授:LineMatrix耐迈通®生物型人工血管FIM临床试验于2024年启动,已顺利完成了术后6月临床随访,累计通畅率100%。目前,所有患者都在使用该人工血管进行血液透析治疗。在临床试验中,LineMatrix耐迈通®展现了其独特优势:远期通畅率高、生物相容性好、抗感染能力强、耐穿刺性能好,弥补了既往ePTFE人工血管的短板,期待LineMatrix耐迈通®多中心产品注册临床试验带来更多令人振奋的结果,也希望未来这款产品能早日商业化,为广大血液透析患者带来更优质的产品。


01
小口径人工血管市场需求旺盛
中国慢性肾病(CKD)患者数量增长快,目前全国约有1.2亿CKD患者,其中超300万患者需要进行肾脏替代治疗。2024年接受透析治疗患者数量超118.3万,其中102.7万为血液透析患者,5年生存率仅为33.4%,血液透析平均生存时间只有4.4年,远低于欧美发达国家水平。
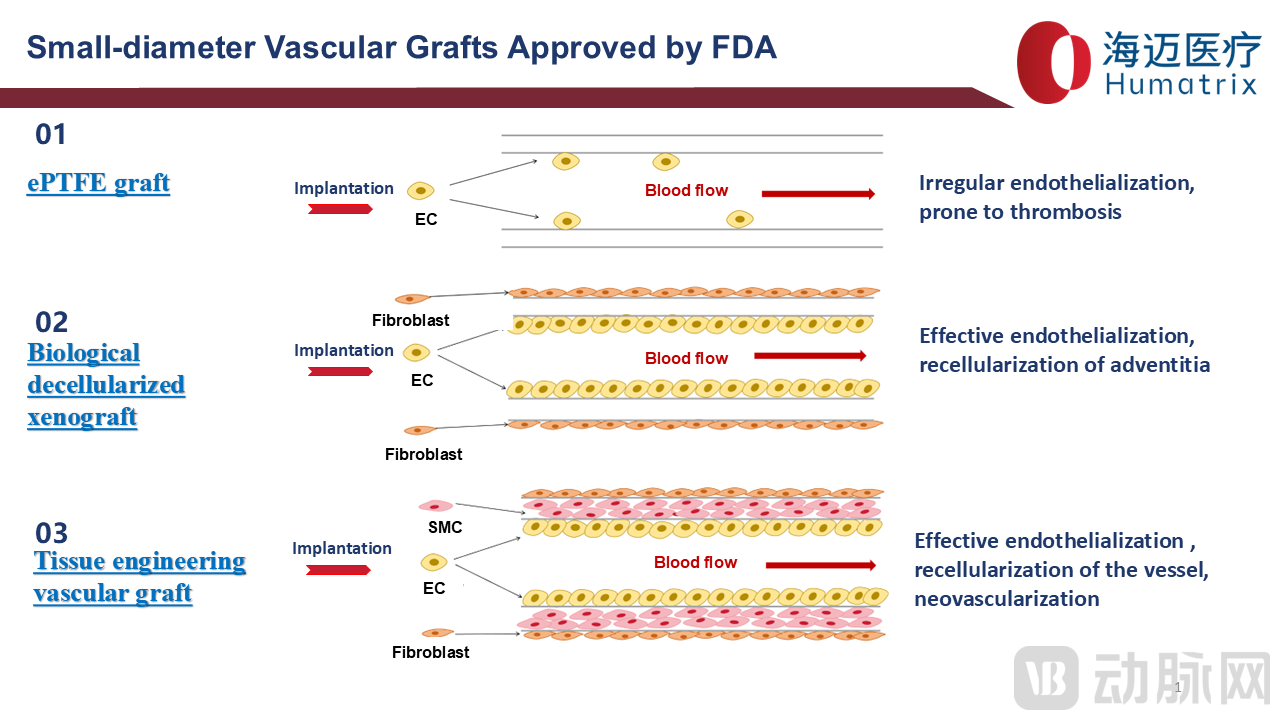
FDA已批准小口径人工血管产品包括ePTFE人工血管、生物型人工血管和组织工程人工血管三类:ePTFE人工血通畅率低、易形成血栓、感染率高;生物型人工血管植入体内3-6月管腔可实现完全内皮化、血管外膜再细胞化,具有良好生物相容性、通畅率高、感染率低等优势;组织工程血管2024年获得FDA批准,目前只能用于外周动脉损伤血管替换,血液透析临床试验正在进行中。
02
LineMatrix耐迈通®生物型人工血管特点
目前中国血液透析患者可使用的小口径人工血管只有ePTFE类产品,LineMatrix耐迈通®是国产首款小口径生物型人工血管:其管壁具有仿生细胞外基质(ECM)结构以及自我修复和再生性能、抗血栓、抗感染、耐穿刺、低免疫反应、免于或减少再干预、高性价比等优势。
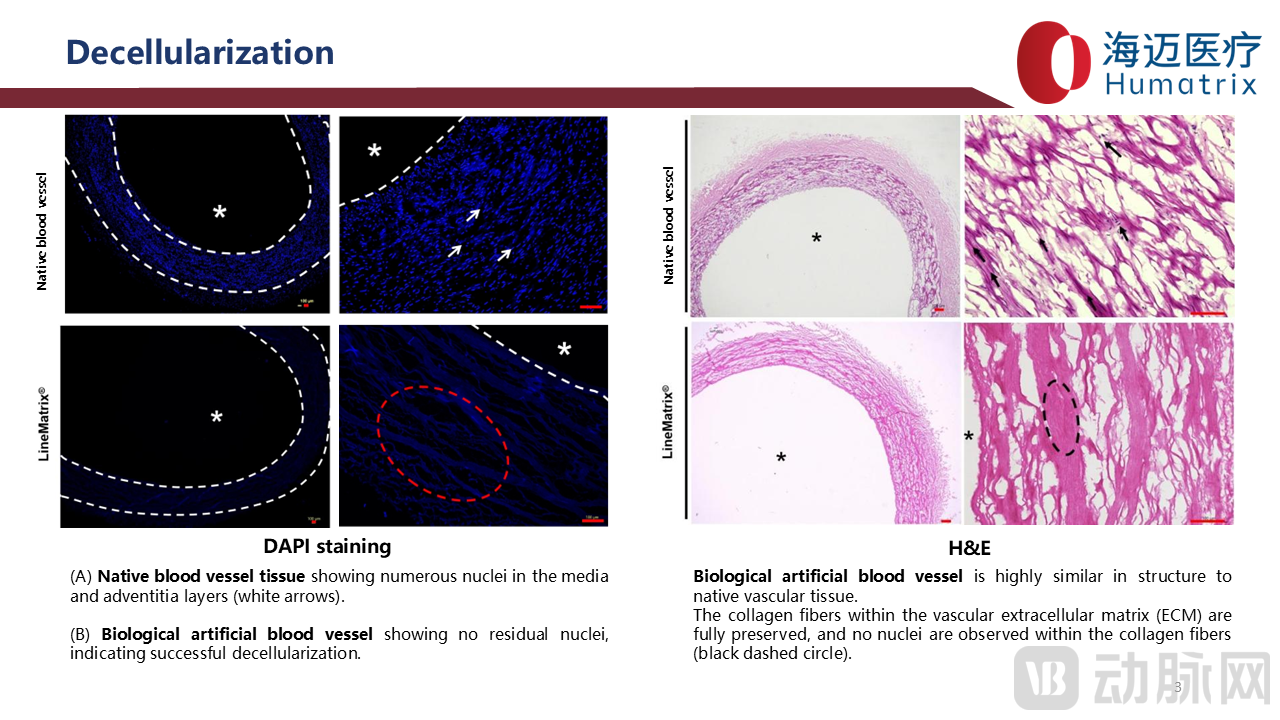
研究显示,LineMatrix耐迈通®生物型人工血管管壁无残留细胞核,管壁组织DNA残留定量检测低于10 ng/mg组织干重,远低于国际行业标准(小于50ng/mg组织干重),α-Gal抗原清除率大于90%,进一步证实LineMatrix耐迈通®极低免疫原性;管壁H&E染色及扫描电镜观察显示:生物型人工血管与天然血管管壁结构高度相似,血管壁ECM胶原纤维结构被完整保留。
03
LineMatrix耐迈通®大动物试验
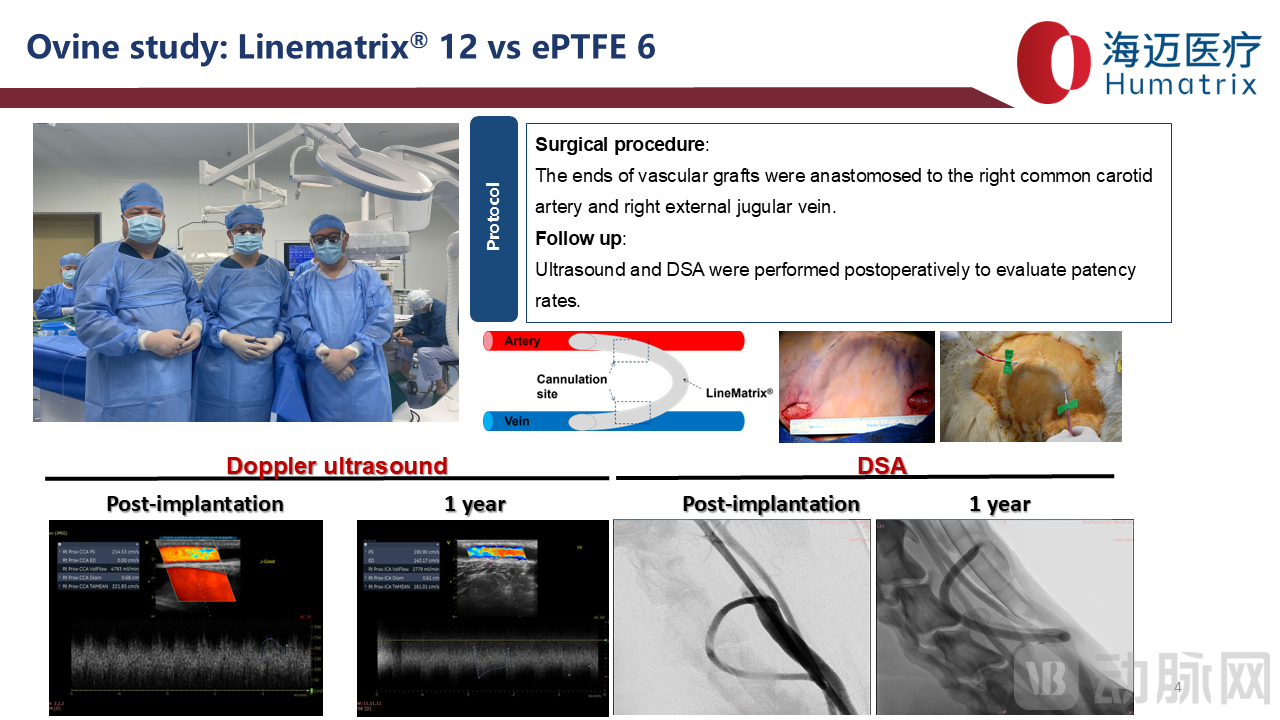
临床前研究共实施了18例绵羊体内动静脉内瘘模型,其中LineMatrix耐迈通®组12例,ePTFE组6例。10例LineMatrix耐迈通®术后随访6月通畅率100%,6例ePTFE组术后随访6月通畅率83%。2例LineMatrix耐迈通®随访1年,血管超声及DSA检查人工血管均保持通畅。
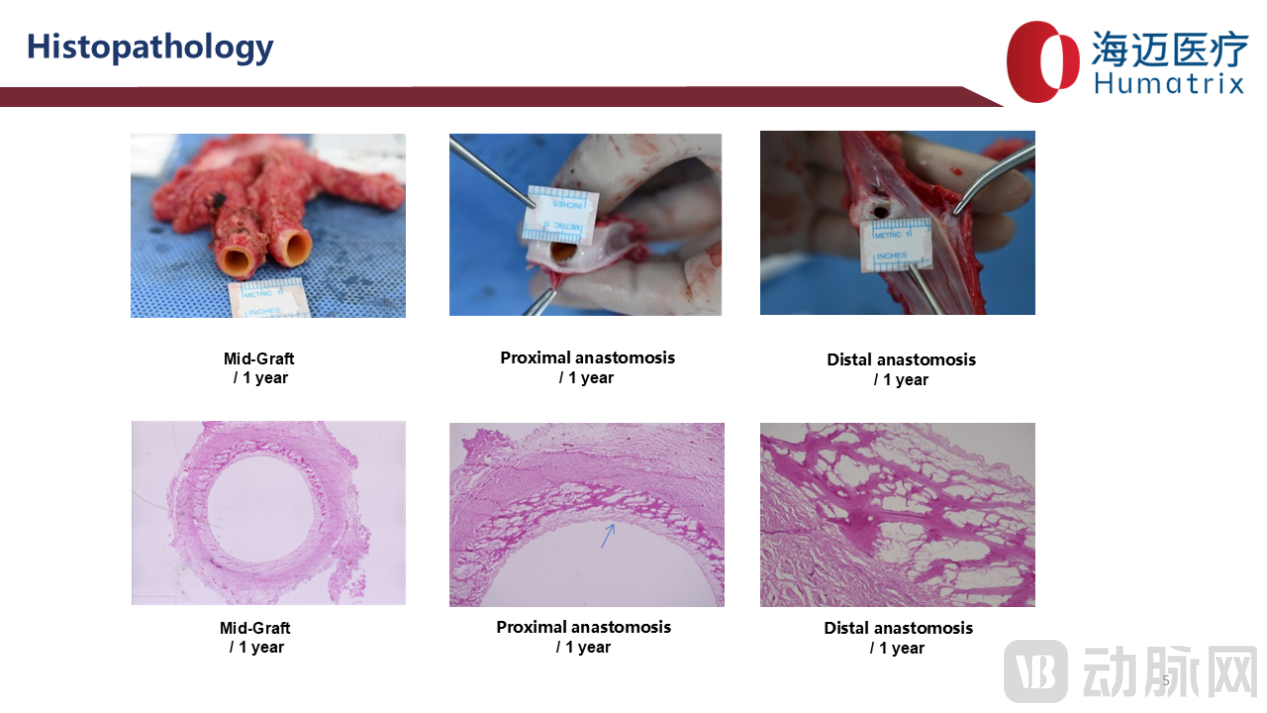
术后6月组织病理学及扫描电镜检测显示:LineMatrix耐迈通®生物型人工血管标本vWF免疫荧光检测可见管腔均匀内皮化,而ePTFE组管腔未见内皮细胞。
术后6月组织钙定量结果显示:LineMatrix耐迈通®生物型人工血管和自体动脉无显著性差异,而显著低于ePTFE组。

04
LineMatrix耐迈通®生物型人工血管FIM临床试验
本试验共纳入12例患者,旨在评估LineMatrix耐迈通®生物型人工血管用于慢性肾衰移植物动静脉内瘘的初步安全性和有效性,最终10例完成随访,2例患者退出研究。
● 安全性:无狭窄、无感染、无血清肿、无动脉瘤及假性动脉瘤、无死亡;2例患者血栓形成:其中1例为术后1月首次血液透析穿刺后止血按压不规范,另外1例为术后3月血液透析期间患者侧卧压迫静脉形成。
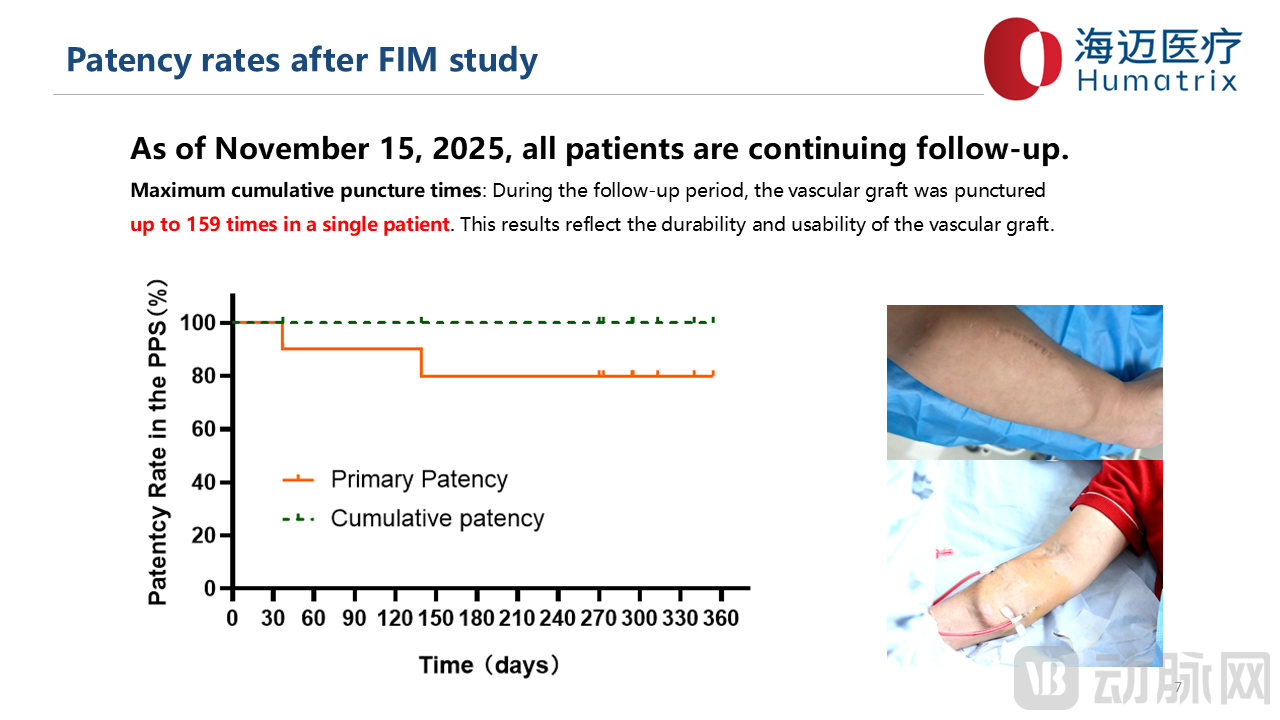
● 有效性:术后3月初级通畅率90%,术后6月初级通畅率80%,累计通畅率100%。截至2025年11月15日所有患者持续随访均通畅,并使用人工血管进行血液透析,159次人工血管结构及功能仍保持正常。
05
总 结
FIM临床试验术后3月初级通畅率90%,累积通畅率达100%;术后6月初级通畅率80%,累积通畅率100%,未见感染、动脉瘤、血清肿及免疫反应,初步证实了LineMatrix耐迈通®生物型人工血管的安全性和有效性。不仅如此,LineMatrix耐迈通®生物型人工血管可实现早期穿刺,术后2周即可进行穿刺透析,有效减少中心静脉导管使用,且外科操作和缝合简单、术后再干预少。
关于海迈医疗

海迈医疗科技(苏州)有限公司成立于2021年9月1日,是一家临床阶段的组织工程与再生医学平台技术公司,为国内首家、全球第二家具备量产小口径(内径≤6mm)组织工程血管能力的企业。公司创始人华中科技大学附属协和医院心脏大血管外科邱雪峰教授先后留学加州大学伯克利分校、加州再生医学研究所(CIRM)、加州大学洛杉矶分校。

公司专注于标准化大规模培养和生产小口径组织工程血管,该产品适应症包括慢性肾透析血管通路建立、下肢动脉外伤(包括战场血管损伤)血管替代、下肢动脉粥样硬化及冠状动脉搭桥术,在此技术平台上研发、生产其他再生医学产品,并扩大至全球范围的临床研究及商业化。公司已入选苏州工业园区领军人才、姑苏领军人才、江苏省人才计划、苏州市独角兽培育计划企业名单,2024年11月荣获工信部第十三届中国创新创业大赛生物医药全国总决赛第一名,2025年9月被长城企业战略研究所评为“科创未来之星”,2025年10月入选苏州市关键核心技术攻关项目并斩获第八届(2025)中国医疗器械创新创业大赛无源医疗器械组总决赛第一名。过去3年公司已累计完成4轮融资,2024年5月建成2243平方米的C+A级别GMP生产车间及质检中心并投入使用,年产能量超过3万根。首个国产生物型人工血管LineMatrix耐迈通®已完成FIM研究,并取得优异的临床效果,目前已在全国12家医院已经启动产品注册临床试验。




























