近日,剂泰科技肿瘤治疗管线产品MTS-105和MTS-107分别在国际权威学术期刊《自然通讯》(《Nature Communications》)和《癌症免疫治疗杂志》(《Journal for ImmunoTherapy of Cancer》,简称JITC)连续发表两项突破性研究成果。
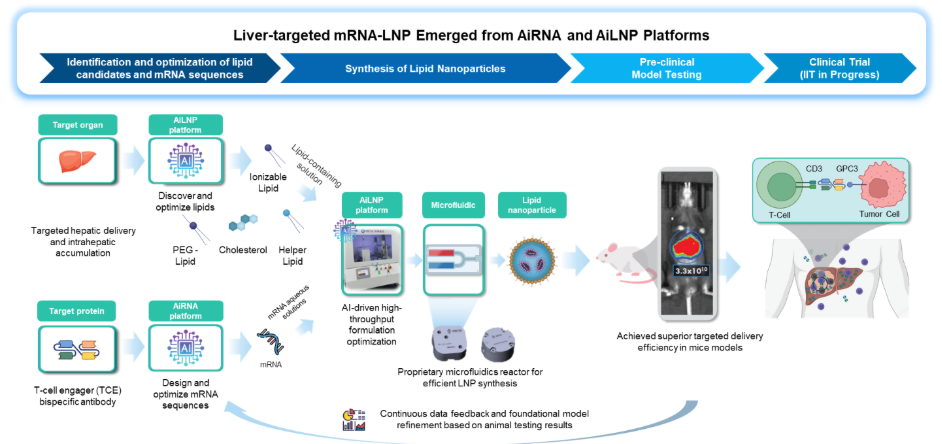
两项研究均基于剂泰科技自主研发的AI纳米递送平台NanoForge,用“火箭+卫星”的递送新范式,分别通过靶向肝脏和脾脏的LNP(纳米脂质颗粒)递送突破,结合mRNA的可编程设计能力创新,构建出“在人体特定器官内高效激活抗肿瘤免疫”的新一代免疫治疗策略。
其中,MTS-105是一款业内首创(FIC)mRNA编码双特异性抗体(TCE,T细胞衔接器)肝细胞癌治疗候选药物,通过剂泰自主研发的肝脏高特异性LNP递送。研究数据显示,MTS-105递送的mRNA被肝细胞摄取后在原位大量编码和分泌双特异性抗体,并能快速渗透到肝癌组织内,采用“特洛伊木马”策略,在肿瘤内部高效诱导T细胞的激活杀伤肿瘤,在小鼠模型中实现HCC完全清除并诱导长期T细胞免疫记忆。MTS-105有望从根本上解决传统基于蛋白的双特异性抗体在实体瘤疗效不理想的难题,成为全球首款mRNA编码TCE实体瘤疗法。目前,MTS-105已经进入临床开发阶段。
MTS-107是一款针对HPV16/18型阳性宫颈癌和头颈癌的mRNA治疗性疫苗,有望实现HPV相关癌症的突破性治疗。通过高效递送免疫器官脾脏的LNP, 剂泰科技研发团队用一个包含E6/E7双抗原加上一个全新的免疫激活佐剂,在小鼠模型里出色验证了MTS-107 和免疫检查点抑制剂PD-1的协同抗肿瘤效应,实现大量HPV特异性CD8⁺T细胞的扩增。MTS-107在未来将继续原创性的临床探索。
剂泰科技联合创始人兼CEO赖才达博士表示:“这是剂泰科技AI纳米递送平台赋能药物研发的重要时刻。肿瘤药物最大的痛点是传统疗法中绝大多数士兵都是在城堡之外,无法进入实体瘤进行高效精准的杀伤。剂泰科技“火箭+卫星”的精准递送新范式在这两项研究成果中得到了有力验证。我们期待未来与合作伙伴携手推进全球临床开发,让更多的好药能直击痛点,为患者送去生存甚至治愈的希望。”
两篇研究文章的通讯作者,剂泰科技首席科学官徐伟博士讲到:“长期以来,mRNA类核酸药物在传染病疫苗之外的治疗性应用始终面临瓶颈,关键问题在于mRNA递送载体LNP的创新。MTS-105首次验证了不带Fc设计的双特异性抗体对于T细胞激活的独特优势, 能够避免反复刺激T细胞诱导凋亡和耗竭。MTS-107在mRNA抗原设计上做了原创性突破,并引入了新型佐剂, 从而显著提升了抗原提呈效率和特异性T细胞的抗肿瘤活性。值得一提的是,《自然》杂志近日发表的研究显示:在接受PD-1抑制剂免疫治疗的肿瘤患者中,接种mRNA新冠疫苗的患者三年生存率几乎是未接种的两倍,其背后的免疫机制层面与MTS-107的研究发现高度一致--mRNA可以协同PD-1产生更广的抗原表位特异性免疫。”
《自然·通讯》研究的共同通讯作者,剂泰科技副总裁、平台技术负责人刘安东博士讲到:“研究结果显示,我们自研NanoForge引擎下的AiLNP和AiRNA双平台均显著加速了LNP和mRNA的设计周期,明确提升了靶向肝脏和脾脏的LNP递送效率和安全性。在抗肿瘤药物研发中,LNP纳米递送是决定mRNA精准送达靶向组织,成药并发挥效应的关键。这两项研究为mRNA创新药研发打开了更为广阔的应用场景和空间。”
MTS-105研究登上《自然》子刊:有望成为全球首款mRNA编码TCE实体瘤疗法
12月15日,国际权威学术期刊《自然·通讯》(《Nature Communications》,2024年影响因子15.7)发表了剂泰科技MTS-105在肝细胞癌治疗领域的临床前研究成果《Organ-Specific Delivery of an mRNA-Encoded Bispecific T Cell Engager Targeting Glypican-3 in Hepatocellular Carcinoma》(《靶向GPC3的mRNA编码双特异性T细胞衔接器在肝细胞癌中的器官特异性递送》)。

研究显示,MTS-105在多种动物模型中展现出显著的抗肿瘤活性,为TCE在实体瘤治疗中的临床转化提供了全新策略,有望成为全球首个mRNA编码TCE实体瘤疗法。
以NanoForge为技术引擎,MTS-105的研发效率显著高于行业平均水平,目前已完成GLP毒理学研究,启动首个临床研究者发起的临床试验(IIT, Investigator-Initiated Clinical Trial) , 正式进入临床阶段。
在血液肿瘤中,TCE疗法已获得广泛验证,但其在实体瘤中的应用仍受限于T细胞浸润、免疫抑制性肿瘤微环境以及系统性毒性风险。MTS-105采用“特洛伊木马式”策略,颠覆全身攻击、广域轰炸式的传统疗法,通过精准靶向肝脏的LNP递送系统,在实体瘤内部和其周围大规模生成并释放TCE,攻陷肿瘤组织外周坚固的壁垒,有效激活T细胞介导肿瘤杀伤,使肿瘤细胞从内部瓦解,显著提升局部药效并优化了药代动力学特性。
同时,研究团队通过优化mRNA序列设计,在密码子适应指数(CAI)与最小自由能(MFE)之间取得最佳平衡,显著提高mRNA的翻译效率及稳定性。
研究数据显示,MTS-105实现以下四项重大突破:
1,可扩展、可编程的肝脏靶向mRNA药物递送体系展现出卓越的体内递送效率,具有高度组织特异性与优异的安全性:在小鼠、大鼠和食蟹猴模型中,肝脏药物暴露量显著高于血浆,组织特异性药物富集显著优于抗体性TCE,展现出真正意义的“靶向治疗”;
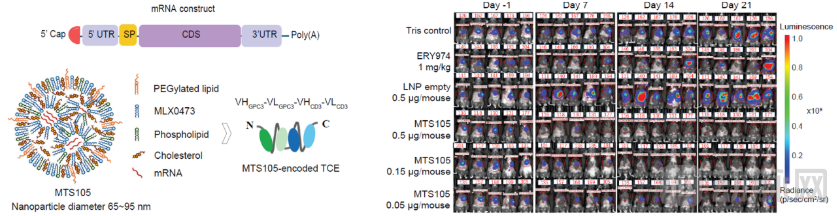
2,缓释特性有效降低外周血峰浓度(Cmax)及系统药物暴露,大幅减少系统性毒性风险。在食蟹猴实验中,MTS-105表现出良好的线性药代动力学特性,所有受试动物在测试剂量下均耐受良好,未出现严重不良反应,其独特的缓释特性可支持每周一次给药,有望显著提高患者依从性。
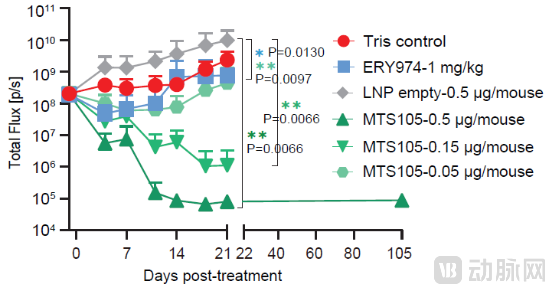
3,抗肿瘤效果显著,在两种肝原位癌小鼠模型中均实现剂量依赖的完全肿瘤消退。小鼠模型数据显示,组织内暴露量显著增加,在低至0.15 μg剂量下试验小鼠实现100%完全缓解,肿瘤完全清除,而对照组的抗体性TCE在1 mg/kg(约20微克)剂量下仅表现出约50%的肿瘤生长抑制。
4,MTS-105诱导持久的T细胞记忆反应。MTS-105治愈(无瘤)小鼠在再次接种新肿瘤后仍保持无瘤状态,显示出长期免疫记忆效应,提示MTS-105可诱导持久性抗肿瘤T细胞免疫反应,有效防止肿瘤复发,为mRNA编码TCE疗法在实体瘤的持久疗效提供有力的实验依据。
MTS-107研究登上《癌症免疫治疗杂志》:有望实现HPV相关癌症的突破性治疗
9月17日,国际权威期刊《癌症免疫治疗杂志》(Journal for ImmunoTherapy of Cancer, JITC)发表了剂泰科技团队研发的创新型mRNA治疗性疫苗MTS-107的研究成果《mRNA-encoded mutant HPV16/18 vaccines promote specific T-cell responses and synergize with anti-PD-1 checkpoint blockade in mediating therapeutic tumor regression in mice》(《mRNA编码突变型HPV16/18疫苗通过激活特异性T细胞应答并与PD-1阻断协同,实现小鼠肿瘤完全清除》)。
研究结果显示,在晚期肿瘤动物模型(体积≥100mm³)中,MTS-107联合PD-1抑制剂在HPV18+ MC38肿瘤模型中实现100%完全缓解(CR, Complete Response),标志着HPV相关肿瘤联合免疫治疗取得突破性进展。

高危型人乳头瘤病毒(HPV),尤其是16和18型的持续感染,是宫颈癌的主要病因,也与超过70%的头颈癌(包括口咽癌)密切相关。尽管预防性HPV疫苗在防控新发感染方面成效显著,但全球数百万已感染患者迫切需要有效治疗性疫苗。
现有的手术与放疗方案对晚期或复发患者疗效有限,且伴随显著副作用。免疫检查点抑制剂(如PD-1抗体)为患者带来了希望,但因缺乏足够肿瘤特异性T细胞而整体响应率不高。如何实现高效的疫苗递送、安全设计抗原与强力免疫激活,已成为全球攻关的关键问题。
MTS-107的研究实现了以下四项关键突破:
- 业内最佳靶向脾脏LNP递送技术:剂泰科技自研LNP可精准将疫苗递送至脾脏,显著提升抗原递呈效率,为激活强效T细胞反应奠定坚实基础,直达脾脏免疫细胞大本营。
- 双亚型、多靶点智能安全的抗原设计:疫苗同时编码来自HPV16和HPV18两种高危亚型的突变E6/E7抗原,解除其对p53和pRb的抑癌功能并保留了完整免疫原性。研究团队通过优化mRNA序列,在密码子适应指数(CAI)与最小自由能(MFE)之间取得最优平衡,显著提升翻译效率及RNA稳定性。体内药效数据显示,MTS-107对HPV16阳性和HPV18阳性的移植瘤模型都表现出显著的抑瘤药效。
- 内置高效免疫佐剂:MTS-107共表达免疫刺激因子GM-CSF(粒细胞-巨噬细胞集落刺激因子),可显著促进树突状细胞(DC)成熟与活化,实现抗原与佐剂的协同效应,使其能更高效地处理并呈递抗原,更有效地激活HPV特异性的CD8+ T细胞。
这种“抗原+佐剂”一体化的设计形成“1+1>2”的协同效应,使MTS-107在小肿瘤和大肿瘤负荷的模型上均表现出显著的剂量和时间依赖性抗肿瘤活性。这一策略不仅适合早期干预,也有望为晚期患者提供有效治疗,极大拓展了临床适应的潜力。
- 协同免疫检查点实现完全缓解:MTS-107单药即可诱导HPV特异性CD8+ T细胞的大量扩增与肿瘤浸润;联合PD-1抗体可进一步解除免疫抑制,后者负责“解除”肿瘤对T细胞的“刹车”抑制,从而使联合疗法有效突破肿瘤的免疫防御机制,实现肿瘤的完全消退。
这一研究成果展示了剂泰科技在AI赋能mRNA治疗性疫苗在HPV相关肿瘤治疗中的潜力,标志着剂泰科技在AI纳米递送与肿瘤免疫治疗交叉领域的重要突破,为HPV相关肿瘤的临床转化提供了坚实的科研基础。
* Grippin, et al, Nature 2025, https://doi.org/10.1038/s41586-025-09655-y




























