对内自主创新,对外造船出海,已成为一家全球化医疗科技企业必须同时打赢的两场硬仗。
2025年年底,百济神州在市值与营收上双双登顶,让我们见证了中国首个5000亿级创新药巨头的诞生。其崛起,更印证了一种以“全球化创新”为核心的范式价值——一方面,实现从研发、注册到生产与商业化的全链条自主布局;另一方面,深耕全球市场,站在产业最前沿与跨国巨头同台竞技,放大价值。
在国内的高端医疗器械赛道,也有一家企业有望复制这条“百济神州”路径。在“自主创新”与“造船出海”的双轮驱动下,聚焦全磁悬浮人工心脏企业的同心医疗,正式步入资本市场赋能的新阶段——其科创板IPO申请已于12月26日获上交所受理,美国临床实验也迎来百例植入,全球化发展的征程正在加速。
心力衰竭,是众多心脏疾病的终末战场。
弗若斯·特沙利文研究数据显示,2024年全球心衰患者约6298.1万人,其中中国患者达1535.0万人,占比近四分之一。预计到2033年,全球患者数量增长至约7151.1万人,心衰治疗需求持续旺盛。
然而,受限于供体严重短缺,全球心脏移植手术数量极为有限。根据国际心肺移植协会(ISHLT)统计,全球每年完成的心脏移植手术仅约5500例。2024年,中国64家医疗机构全年累计完成1064例心脏移植手术,远无法满足日益增长的临床需求。
在这一供需矛盾下,人工心脏已成为当前唯一可规模化治疗晚期心衰的有效手段,展现出巨大的临床价值与市场空间。
回溯人工心脏六十余年的发展历程,其技术从早期的“搏动式人工心脏”发展成“旋转式人工心脏”,而“旋转式人工心脏”又根据转子的支承方式分为“滑动轴承式”“磁液/液力悬浮式”与“全磁悬浮式”人工心脏。
市场与临床的选择是残酷的。血液相容性作为人工心脏性能最关键的指标之一,直接反映血液流经血泵时受到的损伤程度,决定了是否会引发致命的血液相关并发症,是关乎患者生命安全的最重要因素。在技术发展的过程中,有产品黯然离场,也有产品成为全球临床主流:
早期的“滑动轴承”技术因转子与轴承有直接接触会严重破坏血细胞,目前市场上已难觅踪影;“液力悬浮”技术虽避免了转子与轴承的直接接触,但由于其依赖血液实现悬浮与润滑,决定了其仍无法克服血液相容性难题——转子易对血液产生破坏,导致血细胞损伤风险较高。
自2018年以来,已有包括全球巨头美敦力HVAD在内的数款基于“滑动轴承”或“液力悬浮”技术的人工心脏产品相继暂停临床试验,或退出市场。这些在技术迭代浪潮中折戟的案例,进一步暴露了非全磁悬浮技术在血液相容性和长期安全性上的短板。
正是在一轮轮技术的优胜劣汰中,“优秀”的评判标准正在被清晰定义——全磁悬浮技术可实现旋转叶轮的稳定悬浮,无需依赖血液支撑,避免了机械摩擦和挤压血液造成的血细胞损伤,由此显著降低了泵内血栓、中风和出血等不良反应事件的发生。全磁悬浮人工心脏,以其无可争议的技术优势和临床表现,真正叩开“优秀人工心脏”的大门。
当前,以全球累计植入约50000例的雅培HeartMate3为代表,全磁悬浮技术在人工心脏领域已确立不可撼动的领先优势。雅培的垄断地位,也印证了全磁悬浮是经过临床验证与市场筛选的最优技术路径。
在这一高门槛的赛道,同心医疗携其自主研发的全磁悬浮人工心脏产品登上全球舞台,并在血液相容性、血流动力学、防感染性、植入侵犯性及系统可靠性等各项核心指标上,实现全面突破,向世界提交一份具有国际竞争力的中国人工心脏“优秀答卷”。
2021年,由同心医疗自主研发的,中国首个、全球唯二的全磁悬浮人工心脏产品——慈孚®VAD(型号:CH-VAD)正式获批上市。

图片来源:国家药监局官网
在CH-VAD的基础上,同心医疗进一步研发了新一代植入式全磁悬浮左心室辅助系统——美国临床实验产品BrioVAD,体外电池由之前的2块减为1块,控制器内置小型电池,整体更轻便和安全。
就技术而言,CH-VAD与BrioVAD均采用同心医疗全球首创的“分立式磁悬浮结构”,与雅培的HeartMate3相比,CH-VAD/BrioVAD的血泵体积更小、转子更大、转速更低、叶片更长,在同样压差条件下,CH-VAD/BrioVAD仅需约一半的转速就能实现与雅培HeartMate3相同的流量,可实现更高的稳定性和更小的血液破坏,进一步降低中风和消化道出血等临床高发风险。
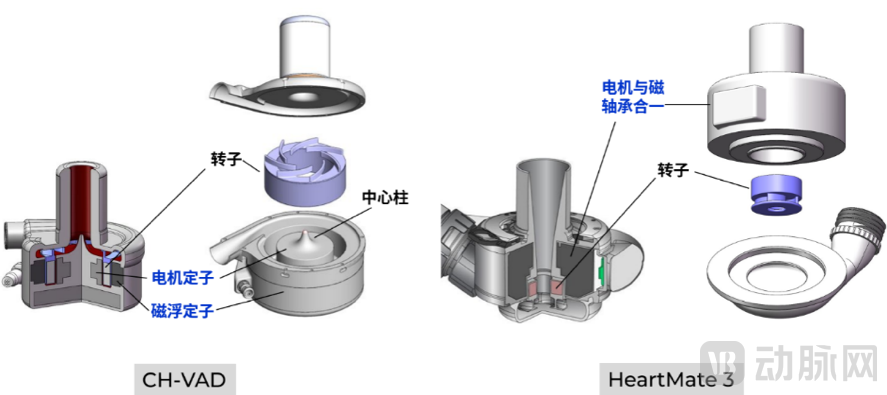
CH-VAD/BrioVAD(左)与HeartMate 3(右)相比,有更大的转子和叶片
在防感染性方面,同心医疗也实现突破——CH-VAD/BrioVAD有全球最细经皮电缆导线(3.3毫米),大大降低了感染风险。
技术优势不只体现在参数上,更需要临床效果的证言。在这方面,同心医疗展现出极高的临床数据透明度,成为目前国内唯一一家能够持续在国际权威学术会议及顶级期刊上发表临床数据的人工心脏企业。
真实世界的长期多中心随访研究结果显示,CH-VAD在多中心真实使用环境中表现出良好的生存率与低并发症水平,远超国际平均水平。研究期间未发生泵血栓、泵体故障或更换事件,体现出优异的安全性与可靠性,更展现出具有全球竞争力的性能优势和临床价值。
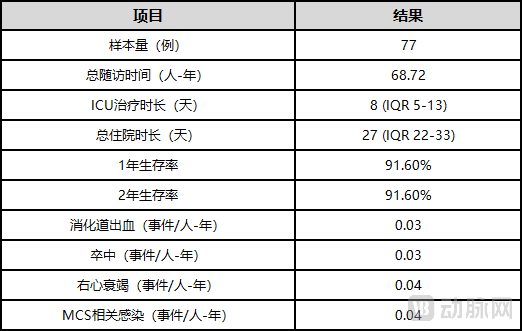
表格来源:同心医疗招股说明书
在临床价值持续得到验证的同时,同心医疗也同步开启了全球化的新阶段。
2024年,BrioVAD正式获得FDA临床试验器械豁免许可(IDE)批准,成功在美国启动与雅培HeartMate 3的“头对头”对照临床试验。
该试验为全球首个全磁悬浮人工心脏领域大规模“头对头”试验,实现了中国高端医疗器械发展史上的零的突破——中国首个且唯一获得美国FDA PMA批准进入临床试验的有源植入式医疗器械。同时,该临床试验还获得了美国保险支持,每例可获得约22万美元的医保覆盖,目前已在22家中心完成108例患者植入。
不同于以FDA 510(K)通过性能检测实现出海的中低风险医疗器械,人工心脏这类高风险植入设备,必须遵循美国医疗器械监管体系中最为严格、流程最复杂、投入成本最高的PMA(上市前批准)路径。一旦通过该路径获批上市,不仅意味着产品本身具备全球顶尖的技术水准,也标志着企业真正跻身国际高端医疗器械舞台。
据弗若斯特沙利文统计,美国植入式心室辅助装置市场规模已由 2021 年的 5.64 亿美元增长至2024 年的7.82 亿美元,市场增速逐年增加,预计 2035 年将达 17.16 亿美元。欧洲市场趋势与美国类似,预计2035年市场规模将达7.8亿美元。
在欧美处于垄断地位的雅培HeartMate 3,年营收达10亿美元,且每年增幅约为13%。而同心医疗的BrioVAD作为除雅培以外唯一获FDA批准在美国开展临床试验的全磁悬浮人工心脏,将有望结束雅培长期以来的单一主导局面,重塑市场版图。
技术创新和国际突破背后,是同心医疗坚实的研发团队支撑——早在2009年同心医疗便在美国成立子公司,公司研发人员103人,中美各占一半。中国团队聚焦核心技术研究与临床支持,美国团队则主导符合FDA标准的产品开发、海外临床试验及注册事务。双方高效协同,不仅在研发、质量体系与临床策略上全面对标国际最高标准,更深度适配美国、欧洲等主流市场的监管要求,持续强化公司在国际市场的产品准入与支持能力。
从CH-VAD的商业化到BrioVAD的全球“头对头”试验,同心医疗的发展轨迹正沿着一条清晰的路径向前——以自主创新为引擎,以全球临床为支点,以全球体系化能力穿越周期,向全球医疗企业迈进。我们相信,这不仅是一场技术出海,更将是一次从“中国创新”到“全球价值”的系统性升维。





























