2025年即将落幕,FDA旗下药物评价与研究中心(CDER)已批准44款新药,其中超过半数为“first-in-class”药物。这一数据不仅彰显了全球新药研发的创新能力,更揭示出治疗范式正在从“改良”走向“颠覆”。小分子药物依然占据主流,但多肽、核酸疗法、ADC等新型治疗模式正加速进入临床,靶点创新、机制突破成为年度关键词。
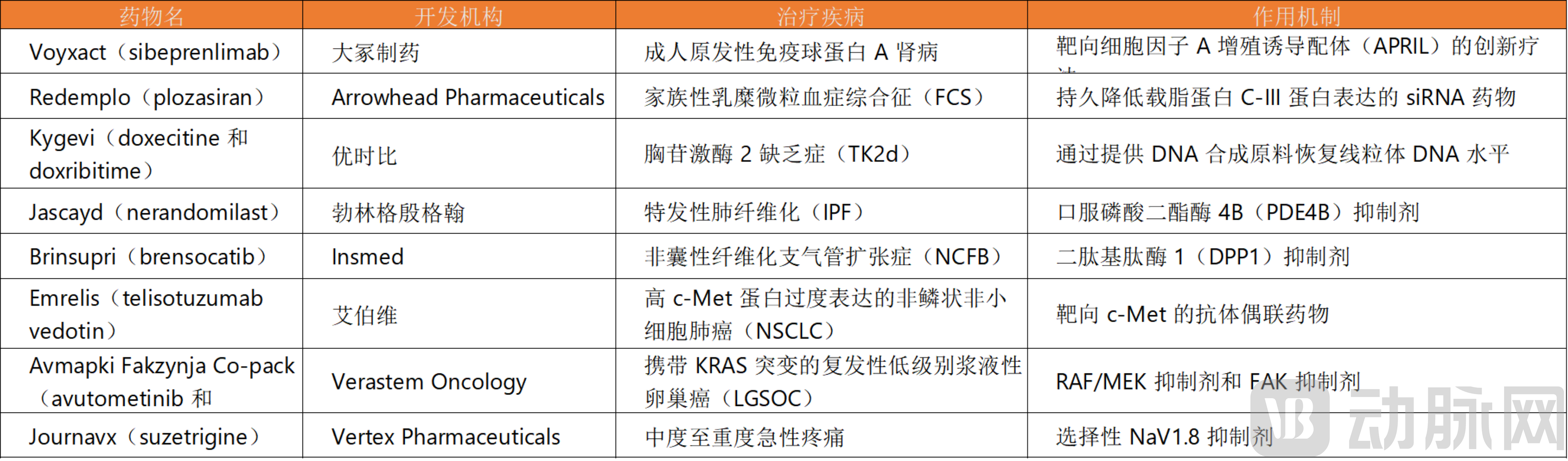
表格:获得FDA突破性疗法认定的“first-in-class”药物
首创新药占比过半,创新药进入“机制驱动”时代
为何行业如此热衷于开发全新机制的药物?从临床需求角度来看,许多疾病,尤其是罕见病和复杂的慢性病,现有的治疗手段往往无法满足患者的需求。例如非囊性纤维化支气管扩张症(NCFB),在Brinsupri(brensocatib)获批之前,临床上缺乏有效的针对性治疗药物,患者只能依赖物理排痰和抗生素治疗,生活质量严重受影响。Brinsupri作为一款靶向二肽基肽酶1(DPP1)的“first-in-class”抑制剂,通过抑制中性粒细胞内可驱动NCFB慢性气道炎症的中性粒细胞丝氨酸蛋白酶的活化,从发病机制的根源上解决问题,为患者带来了新的希望。
再如,对于携带H3K27M突变且在既往治疗后疾病进展的弥漫性中线胶质瘤成人和儿童患者,此前的治疗手段极为有限,患者预后极差。JazzPharmaceuticals开发的Modeyso(dordaviprone)除了抑制多巴胺受体,减弱多巴胺受体介导的RAS信号通路的激活,还过度激活创新靶点ClpP,导致线粒体蛋白质的选择性降解,让癌细胞因能量供应短缺而死亡。这种独特的作用机制为这类患者提供了新的治疗选择,也体现了全新机制药物在攻克疑难病症方面的潜力。
从商业角度看,开发“first-in-class”药物一旦成功,企业将在市场上占据先发优势,获得丰厚的回报。在专利保护期内,企业可以独家销售该药物,获取高额利润,同时也有助于提升企业的品牌形象和研发实力。
在2025年获批的新药中,有8款药物同时获得突破性疗法认定,这与创新机制密切相关。突破性疗法认定旨在加速开发及审查用于治疗严重或危及生命的疾病,且初步临床证据表明比现有治疗有实质性改善的药物。获得这一认定的药物,通常具有独特的创新机制,能为患者带来显著的疗效改善,如Brinsupri就凭借其创新的作用机制和良好的临床数据,在加速审批通道下获批上市,这也体现了监管机构对真正创新药物的鼓励态度,通过政策倾斜,加速创新药物的研发和上市进程,让患者更快受益。
小分子药物仍是中流砥柱,但“打法”已变
在2025年CDER批准的新药中,小分子药物占比高达66%,这一数据彰显了小分子药物在新药研发领域中不可撼动的中流砥柱地位。尽管小分子药物一直是药物研发的重要组成部分,但在2025年,其内在的创新维度有了显著提升,“打法”发生了深刻的变化,正从传统的“泛抑制”模式向“精准调控”模式转变。
传统的小分子药物往往通过对靶点的广泛抑制来发挥作用,这种方式虽然在一定程度上能够治疗疾病,但也容易带来较多的副作用,因为它在抑制致病靶点的同时,可能也会影响到其他正常生理功能相关的靶点。而如今,随着对疾病机制和靶点结构研究的不断深入,小分子药物的设计更加精细,旨在实现对特定靶点的精准调控,提高疗效的同时降低副作用。
别构抑制剂是小分子精准调控的重要体现。例如Cytokinetics公司的Myqorzo(aficamten,别构心肌肌球蛋白抑制剂),2025年12月获批治疗有症状梗阻性肥厚型心肌病(oHCM)成人患者。其通过结合心肌肌球蛋白独特变构位点降低收缩力,相较传统直接抑制更精准,减少对正常生理过程的干扰,提升安全性与耐受性。关键3期SEQUOIA-HCM研究显示,治疗24周后患者峰值摄氧量(pVO2)较基线增加1.8mL/kg/min,显著优于安慰剂组(0.0mL/kg/min),验证了精准调控的疗效。
共价药物的兴起同样展示了小分子药物的创新“打法”。共价药物通过与靶点形成稳定的化学键,实现持久的抑制效果。2025年,FDA批准了多款共价药物,如EGFR抑制剂Zegfrovy(sunvozertinib),它为携带EGFR第20号外显子插入突变的非小细胞肺癌(NSCLC)成人患者带来了新的治疗选择。传统的EGFR抑制剂往往存在耐药性问题,而共价药物凭借其与靶点形成的稳定共价键,能够更有效地抑制靶点活性,克服部分耐药问题,提升靶点占有率。以较低的剂量给药,就可以达到较好的治疗效果,不仅减少了药物的用量,还降低了药物的副作用风险,展现出广阔的临床应用前景。
再看Vertex Pharmaceuticals公司开发的Journavx(suzetrigine),这是一种口服选择性NaV1.8抑制剂,通过别构抑制的机制达到对NaV1.8的高度选择性,它对NaV1.8离子通道的选择性与其他NaV相比达到了3万到4万倍。NaV1.8主要表达于外周神经系统的痛觉神经元,负责将疼痛信号传递至脊髓和大脑,Journavx通过高度选择性地抑制NaV1.8,精准地阻断疼痛信号的传导,从而实现对中度或重度急性疼痛的有效治疗。与阿片类药物相比,它不仅能够提供良好的镇痛效果,还避免了成瘾等副作用,这正是小分子药物精准调控带来的优势。在两项III期临床研究NAVIGATE1和NAVIGATE2中,Journavx能够迅速减少中度至重度急性疼痛,且在48小时内作为单药使用有效,其恶心、呕吐等副作用发生率显著低于阿片类药物,患者耐受性更好,为疼痛治疗领域带来了新的希望。
Jazz Pharmaceuticals开发的Modeyso(dordaviprone)获批用于治疗1岁及以上、携带H3K27M突变且在既往治疗后疾病进展的弥漫性中线胶质瘤成人和儿童患者。这款药物除了抑制多巴胺受体,减弱多巴胺受体介导的RAS信号通路的激活,还过度激活创新靶点ClpP,导致线粒体蛋白质的选择性降解,让癌细胞因能量供应短缺而死亡。通过精准调控多个靶点,Modeyso为这类难治性肿瘤患者提供了新的治疗策略,也体现了小分子药物在精准治疗复杂疾病方面的潜力。以往针对弥漫性中线胶质瘤的治疗手段有限,患者预后较差,Modeyso的出现为这一困境带来了转机,其对ClpP等新靶点的精准调控,为肿瘤治疗开辟了新的思路。
多肽与核酸疗法崛起,RNA靶向治疗进入收获期
在传统小分子和抗体药物之外,多肽与核酸疗法在2025年迎来了重要的发展节点,多款具有创新治疗模式的新药获得FDA批准,这一领域正逐渐成为新药开发的重要力量,标志着RNA靶向治疗从概念走向常态化,为众多难治性疾病的治疗带来了新的曙光。
随着多肽和核酸类药物开发技术成熟,FDA近年平均每年批准4款这类新药。2025年获批的3款“first-in-class”寡核苷酸疗法中,siRNA疗法Qfitlia(fitusiran)通过抑制肝脏抗凝血酶生成、平衡止血功能,为血友病患者提供革命性预防方案。血友病作为罕见遗传性出血病,因凝血因子缺乏致出血风险高,有抑制剂患者治疗更复杂,而Qfitlia打破传统治疗模式,III期ATLAS研究显示,其在有无抑制剂患者中均能显著降低年化出血率(分别降低71%、73%);且该药物为皮下注射,每年仅需6次,大幅提升患者依从性,有望重塑血友病治疗格局。
反义寡核苷酸疗法Dawnzera(donidalorsen)是用于预防遗传性血管性水肿(HAE)发作的RNA靶向药物。遗传性血管性水肿是一种常染色体显性遗传病,其发病机制主要与C1酯酶抑制物(C1-INH)的功能缺陷或数量不足有关,导致缓激肽等血管活性物质的过度生成,进而引起皮肤和黏膜的局限性水肿发作,可累及四肢、颜面、胃肠道、呼吸道等部位,严重时可因喉头水肿导致窒息死亡。目前,临床上针对HAE的治疗主要包括急性发作期的治疗和预防性治疗。传统的急性发作治疗往往只能在发作时缓解症状,而预防性治疗的手段有限。Dawnzera通过皮下注射给药,靶向沉默前激肽释放酶(PKK)基因,减少缓激肽生成,从而预防水肿发作。关键性III期OASIS-HAE研究显示,每4周给药可使HAE发作率降低81%-87%,每8周给药降低55%-60%,为HAE患者提供了一种长效的预防治疗方案,填补了该领域在长效预防疗法方面的空白,显著降低了患者的发作频率,提高了患者的生活质量,让患者能够更好地控制病情,减少疾病发作带来的痛苦和风险。
Redemplo(plozasiran)则是FDA批准的用于降低家族性乳糜微粒血症综合征(FCS)成人患者甘油三酯的siRNA疗法。家族性乳糜微粒血症综合征是一种极为罕见的常染色体隐性遗传病,由于参与乳糜微粒代谢的关键酶或载脂蛋白发生基因突变,导致脂蛋白脂肪酶(LPL)活性严重降低或缺乏,使得乳糜微粒在血液中大量蓄积,患者的甘油三酯水平极高,易引发严重的胰腺炎等临床症状,严重威胁患者的生命健康。现有治疗手段对FCS患者的疗效有限,患者急需更有效的治疗方法。Plozasiran通过下调载脂蛋白C-III(APOC3)降低甘油三酯水平,使脂质恢复到正常水平,为FCS患者带来了新的希望。此前,Arrowhead Pharmaceuticals宣布FDA已受理其siRNA疗法plozasiran的新药申请(NDA),用于治疗FCS,这一疗法在中国也已提交上市申请并纳入优先审评,体现了全球对FCS治疗的关注和对这一创新疗法的期待。
多肽药物领域,FDA加速批准first-in-class药物Forzinity(elamipretide)上市,为Barth综合征患者带来首个获批疗法。Barth综合征是罕见X连锁遗传病,主要影响男性,由tafazzin基因突变导致心磷脂降低、线粒体异常,患者存运动不耐受、心衰等症状,85%早期死亡发生在5岁前。Forzinity作为线粒体心磷脂结合剂,通过靶向线粒体内膜改善线粒体结构功能,其获批基于TAZPOWER2/3期试验及192周延长期数据——随机试验主要终点未优于安慰剂,但延长期内患者膝关节伸肌肌力较基线显著改善(基线肌力中位数124牛顿)。该药物亦是首个获批的靶向线粒体疗法,虽需进一步验证临床益处,但为Barth综合征及其他线粒体相关疾病治疗提供了新方向。
ADC不止于“抗癌”,机制创新与适应症拓展并行
抗体偶联药物(ADC)作为癌症治疗领域中发展迅猛的治疗模式之一,在2025年虽然仅获批2款,但其在机制创新与适应症拓展方面却取得了令人瞩目的进展,正逐渐改变着癌症及其他疾病的治疗格局。
2025年获批的Datroway(datopotamab deruxtecan)便是ADC机制进化的典型代表。它由人源化、靶向Trop2的单克隆抗体,与创新DNA拓扑异构酶I抑制剂(DXd)通过可裂解的四肽连接子偶联生成。在乳腺癌治疗中,Datroway展现出独特的优势。其搭载的拓扑异构酶I抑制剂DXd具有独特的作用机制,与常见化疗药物伊立替康相比,活性提高10倍。而且此药物具有很强渗透细胞膜的能力,这一特性使其在杀伤吞入ADC的癌细胞之后,能够杀死附近的癌细胞,产生“旁观者效应”。对于异质性较高的乳腺癌肿瘤组织来说,“旁观者效应”尤为重要。乳腺癌细胞在肿瘤组织中并非均一分布,存在不同亚群,部分癌细胞可能由于Trop2表达水平较低等原因,难以被传统的单靶点药物完全清除。而Datroway凭借“旁观者效应”,可以在杀死高表达Trop2的癌细胞后,继续作用于周围低表达Trop2或不表达Trop2但与高表达细胞临近的癌细胞,有效克服了肿瘤异质性难题,提高了治疗效果。在治疗无法切除或转移性激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的成年乳腺癌患者时,Datroway显著延长了患者的无进展生存期,为这类患者提供了新的有效治疗选择,改变了以往这部分患者治疗手段有限的困境。
ADC药物的潜力不仅局限于乳腺癌,在肺癌等其他癌症领域也有重要突破。Datroway在2025年6月获得FDA加速批准治疗NSCLC,为肺癌患者带来了新的希望。对于非小细胞肺癌患者,尤其是那些经过多线治疗后病情进展的患者,治疗选择极为有限。Datroway通过靶向在肺癌中高表达的Trop2,精准地将高活性的拓扑异构酶I抑制剂DXd递送至癌细胞,实现对癌细胞的精准打击。在临床试验中,Datroway在经治NSCLC患者中显示出了良好的疗效,显著提高了患者的客观缓解率,延长了患者的生存期。对于一些存在耐药问题的NSCLC患者,由于其独特的作用机制,Datroway也可能发挥作用,为耐药患者开辟了新的治疗途径。
除了在癌症治疗领域不断拓展,ADC在非癌领域的探索也逐渐展开。在自身免疫病方面,艾伯维开发的ABBV-3373曾进行过相关探索。它由阿达木单抗和新型糖皮质激素受体调节剂(GRM)组成,旨在通过将有效载荷GRM直接传递到表达TNFα的活化免疫细胞中,进而调节TNF介导的炎症途径。虽然目前艾伯维终止了ABBV-3373项目,但它为后续的研究提供了重要的思路。国内的恒瑞医药公开了CD40ADC专利,探索其治疗自身免疫性疾病的用途;映恩生物公开BDCA2ADC专利,采用糖皮质激素作为payload用于治疗自身免疫性疾病。在抗感染领域,基因泰克的RG-7861是一种Anti-S.aureusAAC,由识别金黄色葡萄球菌的THIOMAB™IgG1与利福平类抗生素连接,抗体与金葡菌结合后进入吞噬细胞内部,利福平类抗生素就会被释放出来并将吞噬细胞内的金葡菌杀死,目前处于1期临床。这些研究表明,ADC有望通过将特定的药物载荷精准地递送至病变细胞,为自身免疫病和感染病的治疗提供新的策略。
从更宏观的角度来看,ADC技术正朝着成为平台型技术的方向发展。随着对ADC作用机制的深入理解和技术的不断改进,未来ADC可能会被设计用于更多不同类型疾病的治疗。通过选择不同的抗体和药物载荷,以及优化连接子的设计,ADC可以实现对各种特定靶点的精准靶向治疗。在神经系统疾病方面,ACImmune公司开发的Morphomer抗体偶联药物(morADC),结合了Morphomer小分子的高度大脑渗透性与单克隆抗体的靶向特异性,能够靶向包括β淀粉样蛋白(Aβ)、Tau和α-突触核蛋白在内的重要靶点,同时允许单一或双重靶向策略,在单一制剂中提供组合疗法。在临床前研究中,morADC与传统抗体相比,将穿越血脑屏障的能力提高5倍,显著改善了药物在中枢神经系统中的暴露水平,为阿尔茨海默病、帕金森病等神经退行性疾病的治疗提供了新的可能性。如果ADC技术能够在非癌领域取得突破,将极大地拓展其应用范围,为更多患者带来福音,也将对整个疾病治疗模式产生深远的影响。
从“first-in-class”到“best-in-class”,哪些疗法具备重磅潜力?
在新药研发的激烈竞争中,“first-in-class”与“best-in-class”是两个备受关注的概念。“first-in-class”强调的是首创性,即药物具有独特的作用机制,是同类药物中的第一个;而“best-in-class”则更侧重于药物在同类产品中的优越性,它不一定是首创的,但在疗效、安全性、便利性等方面具有显著优势。随着新药研发的不断推进,越来越多的药物不仅追求首创性,更注重在临床应用中展现出卓越的性能,以成为各自领域的“best-in-class”,进而具备成为重磅药物的潜力。
首创新药Brinsupri(brensocatib,二肽基肽酶1抑制剂)在非囊性纤维化支气管扩张症(慢性肺部疾病,以气道损伤、粘液积聚和反复感染为特征)治疗中优势显著。此前该疾病缺乏针对性疗法,患者依赖物理排痰和抗生素,生活质量差。Brinsupri通过抑制中性粒细胞内驱动慢性气道炎症的蛋白酶活化,从机制根源干预,临床研究证实可显著延长首次急性加重时间、降低发作频率,减少住院及抗生素使用,且适用于不同基线病情患者。与传统药物相比,其通过调控免疫炎症通路预防加重,具有不诱导耐药、依从性高等优势。据预测,2031年年销售额或超40亿美元,有望成为该领域重磅药物。
Exdensur(depemokimab)是一款靶向IL-5的超长效生物制品,在哮喘治疗领域具有巨大的潜力。哮喘是一种常见的慢性炎症性气道疾病,严重影响患者的生活质量。超过80%的严重哮喘患者的病情是由2型炎症引起的,患者具有嗜酸性粒细胞水平升高特征,且其病情恶化不可预测。Exdensur能够与IL-5以高亲和力结合,以每6个月给药一次的频率用以治疗重度哮喘患者。与传统的哮喘治疗药物相比,Exdensur的给药频率大大降低,提高了患者的用药依从性。其获批基于SWIFT临床试验结果,研究显示,与安慰剂相比,接受Exdensur治疗的患者年化哮喘急性加重发生率显著降低。在52周内,Exdensur治疗使年化哮喘急性加重发生率(哮喘发作)显著降低58%(RR=0.42,95%CI:0.30-0.59,p<0.001)和48%(RR=0.52,95%CI:0.36-0.73,p<0.001)。Exdensur的出现,为重度哮喘患者提供了一种更有效、更便捷的治疗选择,有望改变哮喘治疗的格局,成为哮喘治疗领域的重磅药物。
Imaavy(nipocalimab)是潜在“best-in-class”靶向新生儿Fc受体抗体疗法,通过结合FcRn促进自身抗体细胞内降解,可用于多种自身抗体介导免疫疾病。其在全身性重症肌无力(gMG,神经肌肉接头传递障碍自身免疫病,表现为肌肉无力、易疲劳)治疗中疗效显著,能降低抗AChR、抗MuSK抗体阳性患者的自身抗体水平、改善症状。相较于现有疗法,其机制独特,或具更优疗效与安全性,为gMG患者提供新选择,也为同类免疫疾病治疗开辟新思路,具备重磅药物潜力。
“重磅药物”的评价标准也在发生变化。过去,“重磅药物”往往以销售峰值来衡量,一款药物的年销售额达到10亿美元以上,就被认为是重磅药物。然而,随着医疗技术的不断进步和人们对健康需求的不断提高,“重磅药物”的评价标准逐渐从单纯的销售峰值转向治疗范式的改变。一款能够改变疾病治疗范式、显著提高患者生活质量、延长患者生存期的药物,即使其销售峰值可能达不到传统的“重磅药物”标准,也被认为具有重要的价值。Brinsupri、Exdensur和Imaavy等药物,它们不仅在销售额上具有潜力,更重要的是,改变了传统的治疗模式,从这个角度来看,它们无疑具备了成为新时代“重磅药物”的特质。这种评价标准的转变,也反映了医疗行业对药物价值的更全面、更深入的认识,更加注重药物对患者健康的实际影响,而不仅仅是商业利益。
结尾
2025年的新药批准图谱,既延续了小分子的生命力,也见证了多肽、核酸、ADC等新模式的崛起。创新不再局限于某一类分子,而是贯穿于靶点发现、机制设计、给药系统乃至患者体验的全链条。FDA的高比例“first-in-class”批准,不仅是对科学勇气的鼓励,更是对患者需求的积极响应。未来,随着人工智能、基因编辑等技术与药物研发深度融合,我们有望迎来更多从根源上改写疾病进程的疗法。
参考来源:同行致远;FDA官网;企业官网




























