2021年7月,美国基因疗法公司Adverum Biotechnologies Inc.(NASDAQ:ADVM,Adverum)暂停了其AAV基因治疗药物ADVM-022用于治疗糖尿病性视网膜病变黄斑水肿(DME)的II期临床试验,原因是一例受试者在接受单次高剂量治疗30周后,出现了眼压过低、炎症以及失明等严重不良反应,引发了业界对该药物安全性的担忧。
ADVM-022是一种使用Adverum专有载体衣壳AAV2.7m8的基因疗法。该疗法通过眼部单次玻璃体内 (IVT) 注射进行,旨在使视网膜内细胞持续产生长久的治疗和预防的效力,减轻频繁注射抗VEGF抗体药物的负担,最终改善患者视力。
尽管面对临床安全挑战,基因疗法仍然具有不可比拟的治疗优势,尤其是对于缺少替代疗法的单基因遗传疾病来说。因为该疗法能从根本上补充或修复缺陷基因,恢复健康基因的正常生物学功能,在患者中最大限度地减少甚至消除影响一生的症状。
近五年,眼部基因疗法临床试验也在迅速增加,针对多种罕见遗传性视网膜疾病和基因突变角膜疾病,比如无脉络膜血症、Leber遗传性视神经病变、Stargardt 病、X连锁视网膜劈裂和X连锁视网膜色素变性等。更值得期待的是,基因治疗为遭受如AMD(老年性黄斑病变)等常见眼部疾病的病人(数亿人)带来希望。因为常规的VEGF抗体注射疗法需要长期频繁和定期的玻璃体内注射,严重降低了患者依从性,也增加了治疗风险。而基因疗法正在成为其行之有效的治疗方案。
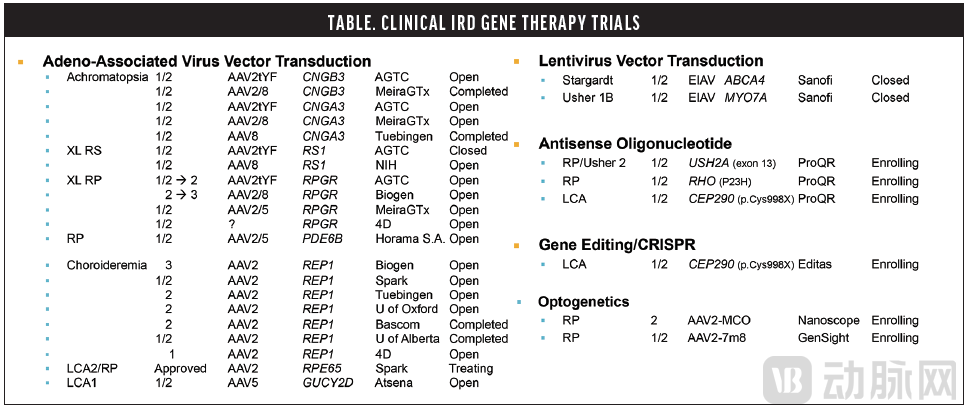
正在进行的遗传性视网膜疾病基因治疗临床试验(部分),图源:Paul Yang,AAO 2020
在基因治疗中,病毒载体技术是目前主要的基因导入方式,该技术的进步很大程度上驱动着基因治疗领域的发展。近二十年来,腺相关病毒 (AAV) 载体掀起了该领域的临床热潮。
AAV是一种小型无包膜细小病毒,作为递送系统具有许多优势,比如无致病性、高效持续表达、易于操作以及免疫原性低等。AAV载体携带的治疗基因(gene of interest,GOI)进入细胞后,将转录翻译为功能蛋白,达到治疗一系列疾病的目的。
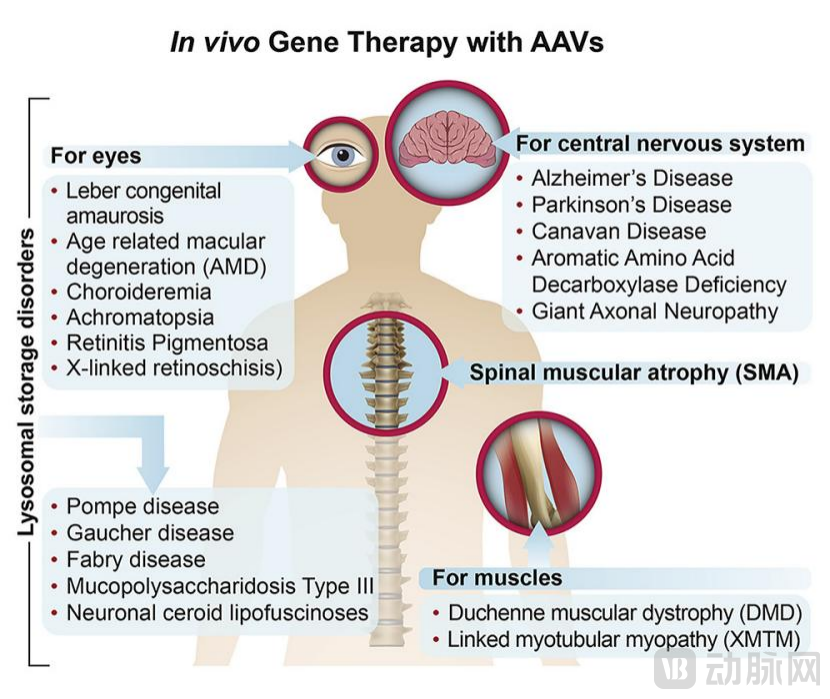
使用AAV进行基因治疗的一系列疾病。图源:参考文献1
rAAV是眼部基因治疗的主要载体,在治疗性基因递送中,AAV单链脱氧核糖核酸(ssDNA)基因组中编码调节蛋白(Rep)和结构蛋白 (cap)脱氧核糖核酸(DNA)序列被所需的GOI表达盒所替换,称为重组AAV (rAAV)。AAV外衣壳(capsid)可以帮助GOI靶向特定组织,迄今已在灵长类动物中鉴定出12种不同的AAV血清型,它们的衣壳成分不同,显示出不同的细胞趋向性、转导效率和免疫原性。血清型AAV1、2、4、5、6、7、8 和 9 都显示出视网膜组织的趋向性。
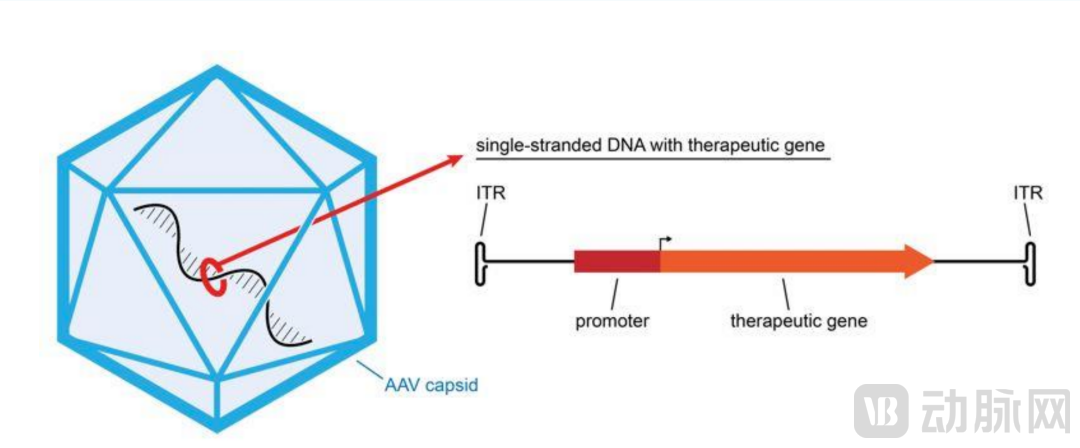
AAV治疗载体结构示意图。图源:catapult.org.uk
在治疗眼疾方面,基因疗法有显著优势,这是由眼疾的遗传基础和眼部隔室的独特性所决定的。
由于眼睛的解剖结构明确,物理空间封闭有限,这为局部给药提供了独特优势。血眼屏障有助于眼部免疫特权,针对基因治疗产品的免疫反应有限。而且,眼睛的视网膜细胞不再进行分裂,可允许持续的基因表达且不会整合入基因组。最主要的是一系列眼部疾病(包括遗传性失明)的潜在遗传因素已被鉴定出来。此外,近来相关动物模型的开发也让眼科研究取得重大进展,有利于开展眼部基因治疗试验。
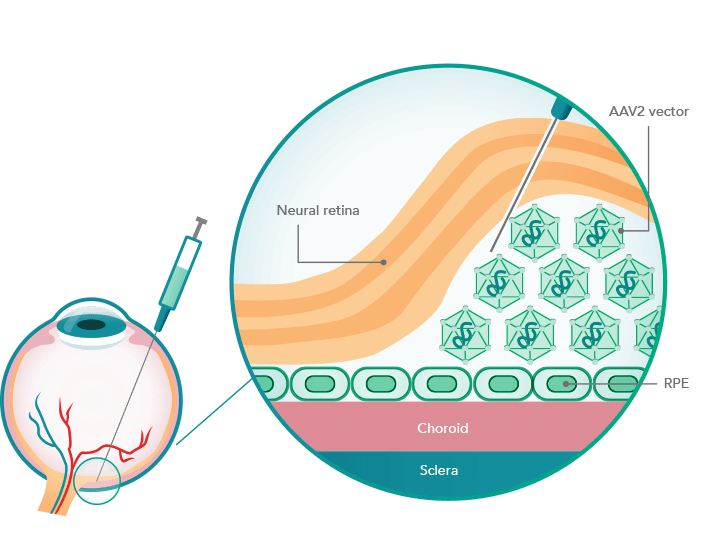
AAV2病毒载体将治疗基因通过视网膜下导入眼部。图源:https://luxturnahcp.com/
Spark Therapeutics公司的Luxturna®(voretigene neparvovec-rzyl)是首个获批上市的用于治疗眼部罕见病的基因治疗产品,Luxturna能将RPE65基因的正常拷贝转导入视网膜色素细胞 (RPE),治疗双等位基因RPE65突变的Leber 先天性黑蒙(LCA2)。
Luxturna的获批是眼部疾病基因疗法发展的重要里程碑。该项目的成功验证了基因疗法概念的可行性,也证实其在恢复或保持视力方面的重要价值。
rAAV产品已显示出作为基因治疗药物的广阔应用前景,目前全球已有超过200项基于rAAV的临床试验。然而,多项在研项目并不像在LCA2 患者中观察到的那样始终如一地转化为临床结果。
事实上,作为一种由病毒基因组和多种结构蛋白组成的复杂生物制剂,rAAV产品的上游开发以及下游生产过程都面临着许多技术挑战。如何保证rAAV的活性功效并降低临床使用剂量,是需要解决的关键问题。因此,在优化生产纯化的同时,设计改造AAV载体以提高rAAV产品与靶细胞的亲和力,增强GOI效力也非常重要。
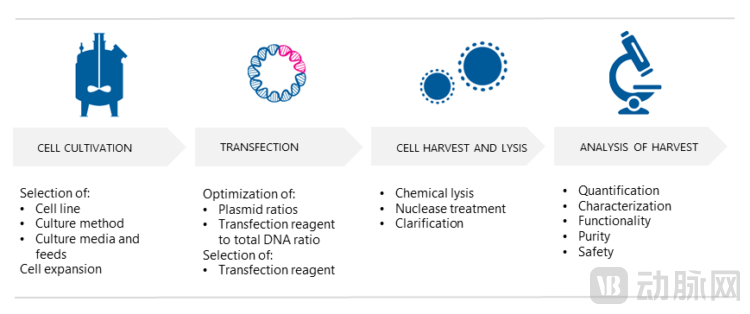
AAV 产品的上游生产过程
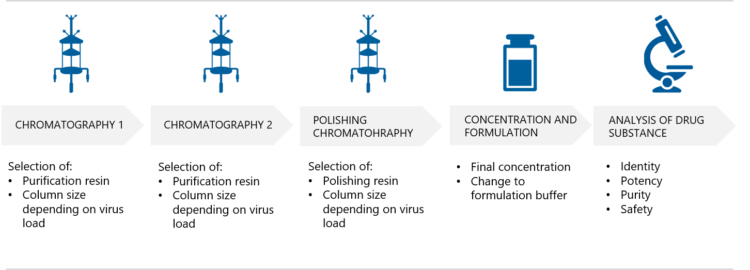
AAV产品的下游生产过程。图源:biovian.com
当所用载体的靶向和转导能力有限,就不得不增加使用剂量以达到预期的临床效果,但高剂量的病毒样产品也代表混有更多的杂质,增加诱发免疫反应的风险。同时,高剂量药物难以均衡转导,不同细胞类型的转基因表达水平也难以控制。
为了提高载体靶向性和特定细胞类型的转导能力,一方面,工程化改造AAV衣壳是优化递送载体的关键领域。AAV产品的衣壳质量和视网膜细胞趋向性是实现安全有效的眼部基因治疗的重要特征。人们可以从天然分离株中提取AAV衣壳,也可通过合理设计、定向进化或计算机引导技术对衣壳进行改造。在UC Berkeley就职的教授David Schaffer是使用“直接进化”的先行者,其实验室产生了现在应用于Adverum公司ADVM-022的视网膜特性性的AAV2.7m8新型载体。同时他也是4DMT公司的科学创始人,4DMT现在使用直接进化的手段发现新型的AAV载体,并在多种疾病领域进行了基因治疗的布局和开发,包括,眼科,心血管疾病,及呼吸系统疾病。
值得关注的是,AAV衣壳工程化技术也是华人科学家刘胜江和陈海峰联合创立的Avirmax公司的研发重点。据官网介绍,Avirmax拥有独特的AAV衣壳工程技术,其开发的rAAV与受体的结合更强,能够穿透玻璃体内限制膜(Inner limiting membrane, ILM),将GOI高效导入视网膜细胞,产生高于野生型AAV衣壳成百上千倍的浓度。Avirmax的rAVV产品可用于常见视网膜疾病,比如wAMD、DME、PCV以及十余种罕见视网膜疾病的治疗。下图是Avirmax的一种改造过的AAV衣壳的计算机模拟图。
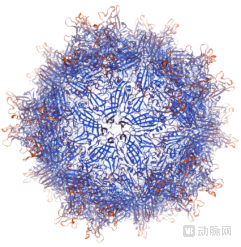
经工程改造的AAV-VP1衣壳蛋白
为了增加rAAV功效,人们还可以借助于基因工程和优化等技术,增强AAV载体GOI的表达水平,以达到降低药物使用量的目的。Avirmax公司正在使用这类转基因增强表达技术,他们的数据显示,该技术能够显著增强AAV治疗载体中的GOI的表达(提高10倍)。
AAV基因治疗产品面临的另一项挑战是如何实现无杂质载体生产的可扩展性和经济性。
AAV产品中的衣壳成分、载体基因组、转基因产物或混杂污染物都有激活宿主免疫反应的可能,导致治疗失败或炎症失控。即使AAV载体具有相对的免疫特权,但仍然能在视网膜下空间引发细胞反应。因此,AAV产品制造商必须改进生产技术,更好地纯化产品并严格质控。其产品具有低免疫原性。
理想的AAV生产系统需在确保足够的病毒滴度的同时减少有害污染物,去除空壳或者错误DNA包装的载体,尽可能地减少临床风险。然而,目前还没有从载体产品中去除错误DNA包装的技术;如何在大规模生产时从产品中去除空壳也是一大难题。
事实上,大规模生产AAV产品是保证临床需求和降低产品价格的关键一环。从目前的应用系统来看,相比于三重转染HEK293系统或者哺乳动物稳定细胞系生产系统,Avirmax公司使用的杆状病毒生产平台具有显著优势,是非常有吸引力的一种大规模临床级载体生产策略。
该平台利用昆虫(草地夜蛾)细胞系 Sf9与两种杆状病毒表达载体共感染:一种杆状病毒载体携带GOI及其在 ITR 区域之间的启动子,另一种杆状病毒载体编码rep和cap基因。这个系统可快速生产高质量和高滴度的AAV产品,降低宿主细胞DNA错误包装,提供可靠的病原体安全保证,而且,在此基础上可以较易实现产品的大规模生产。
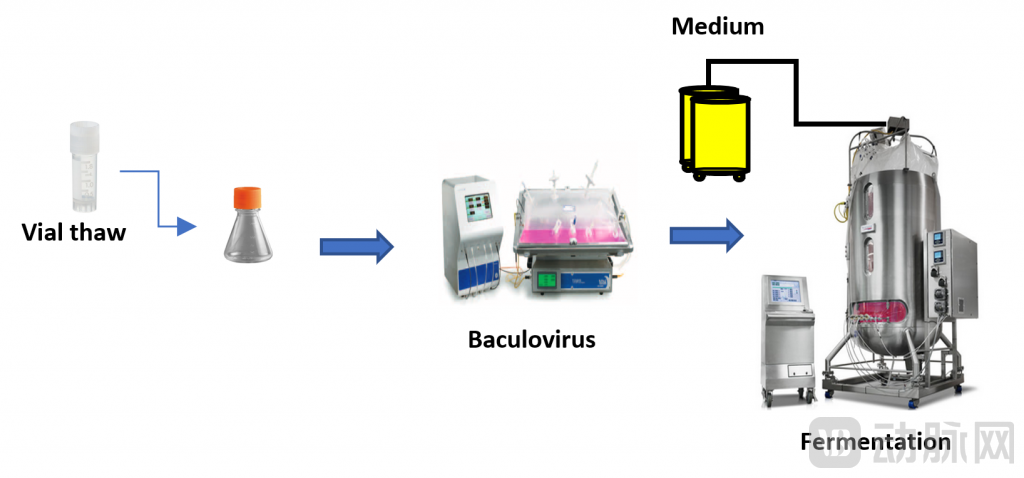
Avirmax的Sf9-AAV 大规模生产平台。图源:Avirmax官网
之前的研究表明,使用小型模式动物的AVV实验在转到大型模式动物之后,其转染效率等结果出现了偏差。而且,一些模式动物中观察到的效果难以在人体试验中应用和重现。由于新型AAV载体的这种不可预见性,有必要在开展AAV产品的临床试验之前使用大型模式动物,比如非人类灵长类动物模型(如食蟹猴或恒河猴)进行研究。据了解,Avirmax公司坚持尽早使用大动物体系,来验证新型AAV载体的临床转化成功率。
除了模型物种的选择,研究者还需要考虑选用模型的年龄,治疗方式,以及跟进时间长短等因素。通过选择更合适的体外疾病模型,可靠地模拟人类生理水平,以得出更安全有效的临床剂量范围。
人类血清学研究显示,由于之前接触过野生型AAV,全球人群存在AAV中和抗体的流行率很高,大约67%的人有针对AAV1的抗体,72%有针对AAV2的抗体,40%有针对AAV血清型5至9的抗体。因此,AAV基因治疗试验首先需对受试者进行筛选,50%以上的患者可能会被排除试验。此外,载体预存免疫原性也是AAV产品再给药的主要挑战,这一问题在体内基因治疗方面尤其突出。
为了让更多的患者得到治疗机会,开发能够“逃避”中和抗体的AAV衣壳是解决办法之一。最近,一种新兴的方法引发了关注,为解决该问题提供了新思路。该方法利用的是在细菌中发现的酶(imlifidase),目前正在测试的有IdeS和IdeZ。这类酶可在使用AAV产品之前使用,它们能在短期内降解血液中预存的抗AAV中和抗体,为AAV载体到达目的细胞创造一个临时的时间窗口。
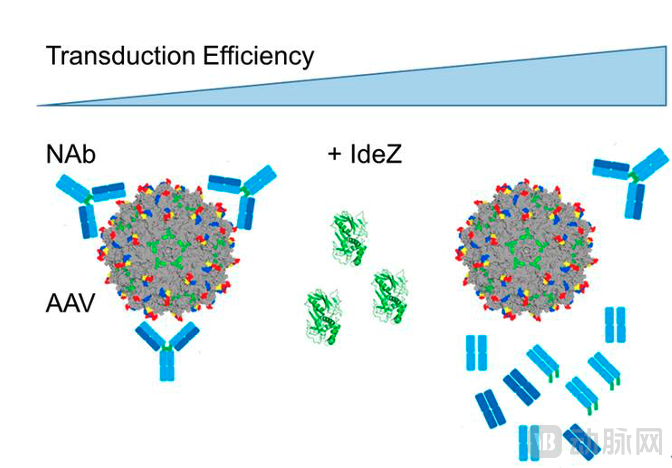
用酶法降解预存AAV中和抗体,以增加转导率。图源:参考文献9
总之,基因治疗获得成功的关键是在可控炎症的剂量下保证足够的GOI表达水平,否则就会导致疗效降低或丧失,需重新给药或引起局部组织损伤,甚至威胁生命。
基因治疗的潜力刚刚开始显现。作为一种新的治疗方式,AAV基因治疗仍处于发展早期阶段。相较于其他积累了大量经验和知识的生物制品(比如治疗性抗体、重组蛋白),人们对AAV病毒载体的生物学特征的理解尚有待加深。
就目前的研发市场来看,专注于眼部疾病基因治疗的公司越来越多。然而,我们看到很多研发项目都是集中在管线冲刺上,真正在解决基础科学问题方面的研发力度远远不够。即使有些产品冲进临床阶段,也可能会遭遇各种安全效力的问题,造成无法挽回的后果。
针对这一问题,除了加强产品基础研发的力度和深度,不断完善与跟进的临床监管也同样重要,以明确和规范基因治疗产品的临床期望。
● 2008年4月,FDA首次发布人类基因治疗指南。同年7月,FDA公布关于人类基因治疗的更新指导文件草案,概述了当前的监管观点;
● 2020年1月, FDA发布了视网膜疾病基因治疗指南《Human Gene Therapy for Retinal Disorders》;
● 2021年9月30日,FDA发布了《行业指南草案:早期临床研究中单一疾病多版本细胞或基因治疗产品的研究(Studying Multiple Versions of a Cellular or Gene Therapy Product in an Early-Phase Clinical Trial:Draft Guidance for Industry》(详见参考文献10)。在这项最新指南中,FDA创新地提出了对某一疾病的IND中,可用多个不同版本细胞和基因产品进行临床,并对有意实施这种临床研究初步安全性和生物活性的评估提供了多项建议,包括如何组织和构建 IND、提交新信息和报告不良事件(Adverse effect, AE)。该草案正在行业内征求反馈意见,这一新指南草案一旦定案成文,为未来细胞和基因治疗产品的早期开发速度和效率的提高有很大帮助。
尽管AAV基因治疗仍存在很多挑战和局限,但现有的临床数据表明AAV基因治疗仍是一种安全、耐受性好和有效的方式。比如本文开头提到的ADVM-022治疗DME的试验中发现存在高剂量毒性,但在低剂量试验中没有发现不良事件,而且ADVM-022的另一项治疗湿性AMD的临床试验显示,低剂量与高剂量应用患者中均未观察到类似不良事件,这些患者的随访已达到治疗后52周至2.5年。
在全世界范围内,rAAV占总基因治疗产品的24%,在2015-2020年之间,FDA已收到99个rAAV基因治疗的IND。随着各项技术的进步和临床监管的完善,我们期待更多的基因治疗产品上市,惠及更多的常见眼部疾病患者,带来长久的治疗益处。
参考资料:
1. Jerry R. Mendell, et al., Current Clinical Applications of In Vivo Gene Therapy with AAVs. Molecular Therapy(2021)29:464-488.
2. Allison M. Keeler and Terence R. Recombinant Adeno-Associated Virus Gene Therapy in Light of Luxturna (and Zolgensma and Glybera): Where Are We, and How Did We Get Here? Flotte Annual Review of Virology (2019) 6:601-621.
3. Kuzmin DA, et al., The clinical landscape for AAV gene therapies. Nat Rev Drug Discov (2021) 20:173-174.
4. Beginner’s guide to the production of AAV vectors for gene therapy–Mentored by a CDMO.https://biovian.com/beginners-guide-to-the-production-of-aav-vectors-for-gene-therapy-mentored-by-a-cdmo/
5. Mark White. Addressing the Top Five Challenges to AAV-Based Gene Therapy with ddPCR.https://www.genengnews.com/insights/addressing-the-top-five-challenges-to-aav-based-gene-therapy-with-ddpcr/
6. Christine Kay. AAV Gene Therapy Trials To Watch. July/August 2021. https://retinatoday.com/articles/2021-july-aug/aav-gene-therapy-trials-to-watch
7. Bulcha, J.T., Wang, Y., Ma, H. et al. Viral vector platforms within the gene therapy landscape. Sig Transduct Target Ther (2021) 6, 53.
8. Leborgne C, Barbon E, Alexander JM, et al. IgG-cleaving endopeptidase enables in vivo gene therapy in the presence of anti-AAV neutralizing antibodies. Nat Med. (2020) 26:1096-1101.
9. Zachary C. Elmore, Daniel K. Oh, et al.Rescuing AAV gene transfer from neutralizing antibodies with an IgG-degrading enzyme. JCI Insight. (2020) 5:e139881.
10. US Food and Drug Administration, HHS 【Docket FDA-2021-D-0776】 Studying Multiple Versions of a Cellular or Gene Therapy Product in an Early-Phase Clinical Trial:Draft Guidance for Industry, Availability.




























