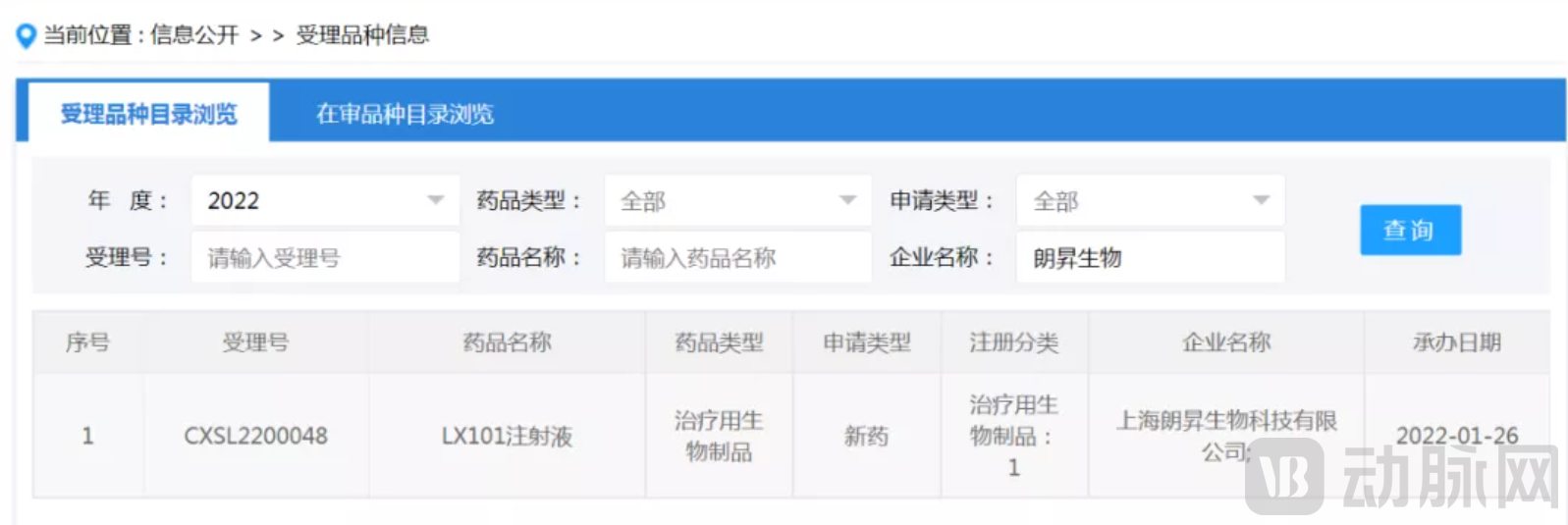
今日,据CDE官网显示,上海朗信启昇(朗信生物)生物制药有限公司自主研发的AAV2-RPE65基因治疗制剂LX101眼用注射液的临床试验申请,已获国家药品监督管理局药品审评中心(CDE)受理(受理号:CXSL2200048)。
先天性黑朦LCA是一类发生最早、最严重的遗传性视网膜病变, 大多数LCA患者在婴儿期或儿童期开始出现严重视力障碍,并且由于进行性视网膜变性,在30-40岁时彻底失明。
LCA目前尚无有效方法治疗,直到近些年来基因治疗领域的快速发展,这种严重视网膜遗传病才有了可用的治疗方法。
2017年FDA批准的第一个基因疗法Luxturna就是用于治疗由RPE65双等位基因突变引起的Leber先天性黑朦症2型(LCA2)。并且该疗法于2018年11月获得EMA批准。而在国内,LX101眼用注射液是国内递交的首个先天性黑蒙基因治疗新药临床试验申请。
● 2021年6月,上海朗信生物启动了研究者发起的中国首项针对LCA的基因治疗临床研究,评估单次视网膜下腔注射LX101眼用注射液治疗特定类型先天性黑矇的总体安全性和疗效。6月24日在上海市第一人民医院眼科中心成功完成首例患者治疗。
● 2021年9月16日,LX101完成了首位LCA患者的视网膜下注射。经过生物工程改造后,LX101带着目的基因片段进入由于基因突变而影响功能的细胞,在其中进行功能修复。
● 2021年12月,根据公开信息显示:LX101表现出良好的安全性,且已在多位患者中见到视力提高的疗效。公司表示2022年将有更多的患者纳入临床试验中。
● 2022年1月26日,LX101眼用注射液的临床试验申请获CDE受理。
国内外研究显示出,AAV基因疗法对于视网膜和中枢神经系统其他部位的罕见、显性遗传性疾病具有治疗潜力。而这次LX101眼用注射液在国内获得CDE受理也意味着,国内自主研发基因治疗眼科新药步入了“转化快车道”,在给遗传性眼病盲人带来光明希望的同时,有望填补我国自主研发基因治疗药物在LCA领域的版图。图片