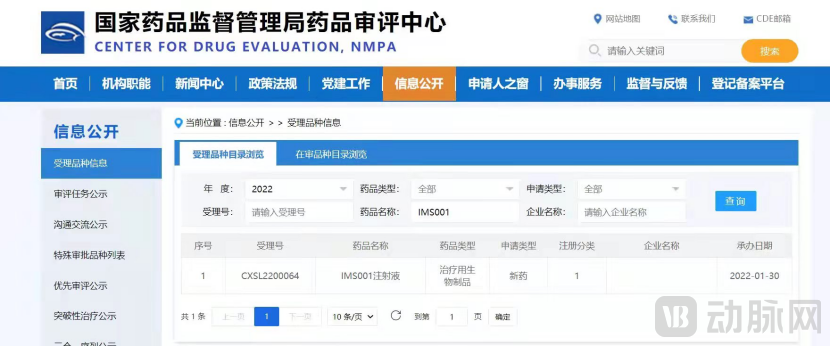
虎年春节,珠海横琴爱姆斯坦生物科技有限公司(以下简称爱姆斯坦或公司)迎喜讯,公司自主研发的T-MSC干细胞新药(IMS001注射液)临床试验申请,获得中国国家药品监督管理局药品审评中心(CDE)正式受理,受理号为:CXSL2200064。
T-MSC是一种来源于人胚干细胞的间充质样干细胞,此次申报的适应症为多发性硬化。基于T-MSC得天独厚的颠覆性技术优势,“IMS001注射液”作为一款1类治疗用生物制品,由T-MSC和临床级制剂缓冲液构成,可以潜在地预防免疫介导的炎症、中枢神经系统脱髓鞘,并通过神经元的修复和/或再生促进其恢复,致力于满足多发性硬化未被满足的医疗需求。
该干细胞新药在2020年已获美国FDA临床试验许可,是全球首款可静脉滴注的人胚干细胞来源的在研原创间充质样干细胞新药。2021年在美国已正式启动I/IIa期临床试验,多位受试者完成用药。此次,“IMS001注射液”在中国提交临床试验申请,既是首次中美双报,也是国内首个治疗罕见病——多发性硬化的人胚干细胞来源的间充质样干细胞新药。
T-MSC作为此次爱姆斯坦申报新药的主要成分,是利用爱姆斯坦的两步细胞分化专利技术,从单个人胚干细胞通过滋养层细胞中间体(Trophoblast)分化而来的。相比iPS诱导全能干细胞,胚胎干细胞未经基因工程改造,在安全性和基因稳定性上更具优势,且因胚胎干细胞是在胚胎囊胚期提取、在体外建立的干细胞系,可以在体外无限扩增,具有分化成机体几乎全部组织和器官的潜能。基于其无限扩增分化的潜能,胚胎干细胞可以像化学药一样进行标准化生产,避免了传统成体干细胞的来源受限、质量不一致的问题,在医学上具有巨大应用前景。
爱姆斯坦创始人、董事长门增轩表示:多发性硬化虽是罕见病,但是每一个小群体都应该得到关注和关爱。在美国,我们I/IIa期的临床试验数据为我们在中国的新药注册增加了信心,无论是在中国还是美国,我们希望让创新的科学技术给患者和社会带来更多的美好。
IMS001注射液是一种来自人胚干细胞系的异体间充质样干细胞产品。临床前试验已证明了IMS001注射液对免疫调节的修复能力和穿越血脑屏障能力,这些天然属性可能在治疗神经性疾病、自身免疫性疾病尤其是罕见病时有明显的优势,从而满足疾病治疗的更高需求。因此,这些特性在治疗多发性硬化等疾病时,可能会更加有效地减少疾病复发与持续恶化,从而治疗疾病。





























