2024年5月26日,北京先通国际医药科技股份有限公司(简称 “先通医药”)为进一步拓展全球业务,并考虑到香港联交所可为上市公司提供一个国际平台,以获取境外资金及吸引多元化的境外投资者,其正式向港交所递交上市申请,中金公司和中信证券担任联席保荐人。
根据灼识咨询报告,先通医药是中国首家获得创新放射性药物上市批准的企业;首家以药品上市许可持有人(“MAH”)身份获得创新放射性药物生产许可的企业;及首家完成治疗用放射性配体注册临床试验并获国家药品监督管理局(“药监局”)受理新药申请(“NDA”)的企业。
作为中国核药市场的新一代龙头企业,先通医药近年来依托自研、并购、商业合作等多维度布局,在核药领域实现弯道超车。随着其冲击港股,以及重磅产品的逐渐商业化,先通医药有望撼动中国同辐、东诚药业的核药双寡头格局。
此次冲击港股,先通医药拟将IPO募集资金,用于XTR008、XTR006、XTR004、XTR003等核心产品的研发及注册申报;XTR015、XTR024、XTR010、XTR020、XTR021、XTR022、XTR016、XTR017、XTR025等候选产品的研发;加强销售及营销能力,提高其产品市场知名度;在京津冀鲁地区建设新生产基地,确保其产品能够及时交付予中国北方地区的客户,从而提高产品可及性,并扩大市场覆盖范围;以及用于营运资金及其他一般企业用途。
IPO前累计融资 29 亿,
估值九年增长超5倍
先通医药成立于2005年,早期以传统药物研发为主。2013年,先通医药开始积极探索从仿制药转向创新药赛道的路径,尝试了很多不同的方向,最终在2014年因为一个合作,正式迈入了增长空间巨大的创新药细分赛道——创新核药。
2014年6月,美国核药公司Navidea的新型受体靶向放射性药物Lymphoseek® (Technetium Tc 99m Tilmanocept)注射液获经FDA批准,Lymphoseek®是FDA此前10年批准的唯一一个99mTc标记的新药,用于实体瘤手术中的前哨淋巴结定位。Navidea希望能够开拓中国市场,因此积极在中国寻找合作伙伴。
同期在中国,虽然此前我国药品监管部门批准上市了约40种核药,但均是一些老品种,自2008年后仅有1款新的核药获批上市。当时,国内很少有人关注创新核药赛道,从事创新核药研发的企业更是少之又少,Navidea的选择并不多。先通医药抓住这个机会,获得Technetium (99mTc) Tilmanocept产品的中国权利,正式入局核药领域,也就此占据了这一赛道的先发优势。
自2014年首次接触核药以来,随着对核药领域的了解不断深入,先通医药敏锐地感觉到,核药的风口即将到来。2019年底,先通医药彻底剥离了其他传统药业务板块,并在2020年正式开启专注创新核药的元年,核药研发也进入了发展快车道。
同期,全球核药市场进入爆发阶段。2021年以来,全球累计达成超80项核药交易,涉及诺华、默克、赛诺菲等头部MNC。全球前三名业务发展交易金额分别达约20.6亿美元、16.3亿美元及4.87亿美元。
另据招股书,核药全球市场规模自2018年的50亿美元增至2024年的97亿美元,复合年增长率达11.7%。预估2035年将攀升至573亿美元,2024至2035年间复合年增长率为17.5%。同期在中国市场,该规模从2018年的36亿元增长至2024年的74亿元,复合年增长率为13.0%。至2035年,预计将达到758亿元,2024至2035年间复合年增长率达23.5%。
核药赛道因其创新潜力和强大的商业前景,吸引了大量投资。以先通医药企业为代表,其2017年至今,一共完成了9轮融资,累计融资金额29亿元。目前,先通医药已获得众多知名投资者的支持,其中包括知名的医疗保健及生物技术投资机构,如金石新材料基金、中金启德、医药基金、南京钲凯、国药中生及启明融信等;国有基金,如国调基金二期、国投创业及通用技术创投公司;保险支持的投资机构,如江苏疌泉;及核工业投资基金同辐基金。
值得一提的是,先通医药在2023 年 6 月完成的两轮11亿元融资,创下了国内核药领域单笔融资纪录,充分体现了资本市场对先通医药的高度认可。此外,如果按照其2017年A轮1.3亿元人民币,投后估值10.3亿元;以及IPO前最近一轮融资,即2024年11月及12月完成两轮共计6亿元融资,投后估值51.88亿元来算,先通医药在不到9年的时间里,估值实现了超5倍的增长。
平台覆盖核药发现、开发、临床全流程,
获上百项专利保护
基于强大的资金后盾,先通医药目前的内部研发能力,涵盖整个放射性药物开发过程中的所有关键功能,包括前体设计及优化、放射化学标记、放射性核素选择、临床前验证、临床研究、医学成像、放射性诊疗一体化与转化研究。
在核药的发现方面,先通医药的前体设计及优化平台,通过将药代动力学、理化性质及组织分布等关键参数整合至化合物设计及优化,可提高产品的成药性及临床转化。
在核药的开发方面,考虑到放射性药物的独特性及其开发所需的高度跨学科方法,先通医药在放射性药物开发的所有关键阶段均已建立专业技术平台,重点包含医用放射性同位素开发平台及放射化学标记技术平台。前者可用于开展全面的放射性核素工艺及质量研究,生产高纯度放射性核素,同时确保与监管部门无缝对接,化解核药供应链在物流和运营方面的痛点。后者整合了优化的标记工艺参数、量身定制的配方筛选(如自由基清除剂)及严格的材料选择,以确保产品即使在高放射性水平下亦能保持稳定及质量控制。
在核药的临床研究方面,先通医药已建立多个专用放射性药物临床研究平台,包括辐射剂量测定平台、成像平台、转化医学平台。
辐射剂量测定平台:辐射剂量学研究是放射性药物开发的基础环节,在确保疗效及安全性方面发挥着至关重要的作用。辐射剂量学研究平台,通过分析不同器官在多个时间点的放射性活度,可系统地评估放射性药物的疗效及安全性,为剂量选择提供坚实的科学基础。
成像平台:该平台完全按照《药物临床试验质量管理规范》(“GCP”)标准设计,具有强大的图像数据管理及质量控制流程,可确保准确性及可靠性。
转化医学平台:在IIT设计及执行方面拥有成熟能力,并已与中国顶级医院的核医学科建立战略合作伙伴关系。该模式通过生成人体数据,直接支持IND申请并完善临床试验方案,从而加快PCC向临床验证的转化。
此外,先通医药还拥有诊疗一体化开发平台,该平台整合了诊断及治疗用放射性配体的开发,实现了诊断-治疗的无缝衔接,提高其研发效率。
截至目前,先通医药的专有技术及管线资产已获得了上百项专利保护,其中包括在中国的101项注册专利及53项专利申请,在其他司法管辖区的5项注册专利及34项专利申请,以及9项根据PCT申请的待批专利申请。其中,与核心产品相关的有33项注册专利及26项专利申请。
15款产品管线,
覆盖肿瘤、CNS、心血管疾病三大领域
目前,先通医药拥有一款已商业化产品XTR005,四款核心在研产品(XTR008、XTR006、XTR004及XTR003),以及十款处于不同开发阶段的候选产品,适应症涵盖肿瘤、神经退行性疾病、心血管疾病三大领域。值得一提的是,在其管线资产中,包含四项潜在同类首创或同类最佳资产,以及四项基于2024年全球五大畅销放射性药物开发的资产。
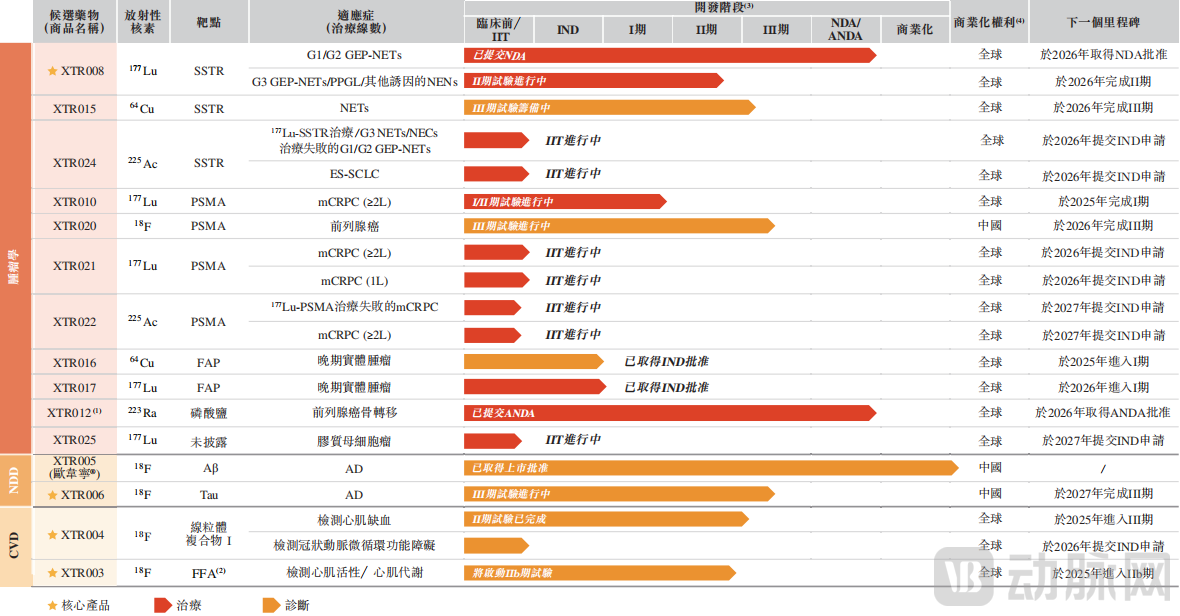
先通医药产品管线,图源招股书
商品化产品:
XTR005(中国商品名欧韦宁®):一种靶向Aβ的PET放射性示踪剂,用于通过PET成像测量成年患者大脑中Aβ斑块的水平,帮助评估AD及其他认知能力下降的原因。该产品是先通医药通过与Life Molecular Imaging Ltd.订立协议,以获得其控制的独家专利权的许可,从而在中国内地开发、生产及商业化XTR005作为神经退行性疾病的诊断用放射性配体。
2023年9月,XTR005获得药监局的NDA 批准,用于AD诊断。作为中国批准的第一个靶向Aβ的PET示踪剂,XTR005将成为患者筛查及评估靶向Aβ的治疗疗效的重要工具。2025年1月,先通医药开始销售XTR005。截至目前,先通医药已与京津冀鲁地区和广东省超过50家医疗机构建立合作关系销售XTR005。
在研核心管线:
XTR008:一种处于注册阶段的177Lu标记生长抑素受体(“SSTR”)靶向的放射配体,用于神经内分泌肿瘤(“NENs”)的治疗。基于已经完成XTR008G1或G2 SSTR阳性GEP-NETs的Ⅲ期临床试验中期分析,先通医药已于2025年3月向药监局提交NDA。
XTR006:一种潜在的同类最佳18F 标记的微管蛋白相关单元(“tau”)靶向的正电子发射断层扫描(“PET”)诊断用放射性配体,用于诊断疑似阿尔茨海默病(“AD”)或AD痴呆引起的轻度认知功能障碍(“MCI”),在中国尚无获批同类产品。目前该产品正处于Ⅲ期临床开发阶段,用于针对AD引起的疑似MCI或AD痴呆症患者的早期诊断、筛查及疾病进展评估,预计将于2027年完成试验。
XTR004:一种18F标记的线粒体复合体I靶向的诊断用放射性配体,用于PET-心肌灌注成像(“MPI”)。根据招股书,XTR004中国首个且唯一临床在研的PET-MPI示踪剂。目前,先通医药已完成心肌缺血诊断的Ⅱ期临床试验,并计划于2025年第四季度启动Ⅲ期试验。
XTR003:一种潜在的同类首创18F标记的PET诊断用放射性配体,用于心肌脂肪酸代谢成像,以检测心肌存活性。目前先通医药已完成XTR003的I期临床试验及Ⅱ期临床试验,预计于2025年开展IIb期临床试验。根据招股书,XTR003为全球首个且唯一临床在研的PET心肌脂肪酸代谢示踪剂。
此外,先通医药正在开发的其他创新放射性配体候选药物,包括 XTR022、XTR016、XTR017、XTR024及XTR025,该等候选药物目前正在中国进行临床前研究或IIT。招股书显示,上述管线均具有在中国首个上市、同类首创或同类最佳的潜力。
拥有两个在营生产基地,
2024年收益4410万
为了确保成本效益以及解决核药供应链痛点,先通医药已建立两个自有的生产基地并已投产,用于生产自有产品、候选产品及放射性核素,并提供合同研发生产组织 (CDMO) 服务。其中一家位于江苏省无锡市,一家位于广东省中山市。其生产基地总建筑面积超2万平方米,共设有12条商业化规模的生产线(其中3条已取得生产许可证并通过GMP合规检查)。
此外,先通医药还在四川省绵阳市另设有一个自有生产基地,现已完成施工,目前正在办理申领相关牌照及许可证的手续,预计该基地将于2025年第三季度投产。
基于上述技术平台、核心管线、生产基地,先通医药获得了产品及放射性核素、许可收入、CRO/CDMO服务和市场推广服务等各方面的营收。根据招股书显示,于2023年及2024年,先通医药分别录得收益人民币1020万元及人民币4410万元;分别录得净亏损人民币3.092亿元及人民币1.561亿元。不难预见,接下来,先通医药凭借三项进入商业化或临近商业化阶段的产品,其收益将会快速上升。
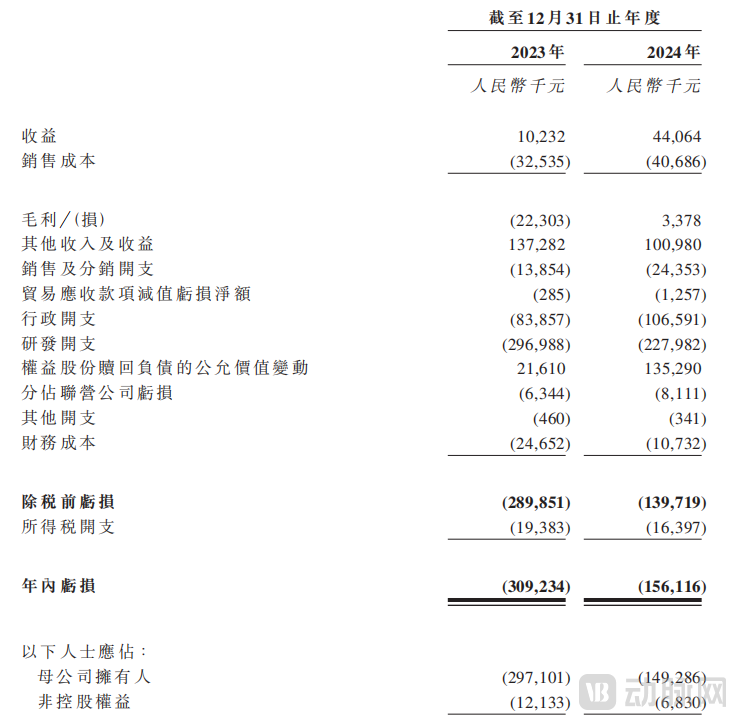
先通医药收益,图源招股书
作为国内最早一批进入创新核药领域的企业,先通医药入行核药已有11年。虽然近年来国内核药赛道火爆,但其基础仍然十分薄弱,产业各方面配套均不成熟,面临着医用同位素长期依赖进口、监管政策滞后、CRO服务空白等难题。多年来,先通医药基于行业痛点与需求,不断延伸产业链,同时覆盖上游和下游。先通医药在挑战中抓住了机遇,在产业刚兴起时抓住了先机,借此打造了产学研销一体化平台,不仅有利于自身创新核药的研发,同时也推动着行业的发展。
目前,核药已经向市场端展示出了其精准靶向、强力杀伤、有限损伤和诊疗一体等优势,逐步成为肿瘤治疗领域下一波重要的创新浪潮。不难预见,未来,核药行业的IPO、并购、合作将更加频繁。期待先通医药在资本市场的助力下,能够加速赋能核药产业,更快为临床患者带来更好、更可及的核药产品。





























