
商务合作

动脉网APP
2024年10月11日至10月17日,动脉橙产业智库重点整理了医疗器械产品国内外获批资讯及数据,涉及10个器械获FDA批准,2个器械获欧盟及其它批准,另有381个器械获NMPA批准注册文件。
海外获批
一、FDA
1. 适用于肿瘤的可穿戴医疗器械获得FDA批准用于治疗癌症
美国食品和药物管理局(FDA)批准了一种来自Novocure的可穿戴医疗设备,称为Optune Lua,用于治疗铂类化疗后进展的转移性非小细胞肺癌(NSCLC)。该设备产生交变电场,称为“肿瘤治疗场”(TTFields),通过放置在皮肤上的可穿戴阵列传递。这些场对分裂癌细胞施加物理力,杀死它们,同时使健康细胞不受影响。该设备每天可佩戴约18小时。
2. 血栓保护装置开发商Contego Medical支架+球囊扩张+栓塞防护三合一颈动脉支架获FDA批准上市
Contego Medical宣布其独特三合一颈动脉支架Neuroguard获FDA批准上市,该支架集成支架、球囊扩张和栓塞防护一体,能够在颈动脉运重建过程中精简手术步骤,并且能够捕获术中的栓子,从而保护患者避免中风。Neuroguard临床研究(PERFORMANCE I和PERFORMANGE II IDE)都显示出高度安全性:30天和1年内无重大中风、无神经死亡和无支架血栓形成。比波科刚刚收购Silk Road的TCAR技术更低栓子引发卒中。
3. 肩关节置换术提供商Catalyst OrthoScience肩部骨折系统获FDA 510(k)批准并获首例病例
Catalyst OrthoScience Inc.是肩关节置换术医疗技术的领导者,其Catalyst骨折肩关节系统已获得FDA批准。这种反向骨折关节成形术系统治疗肱骨近端骨折(PHF)。传统的植入物侧重于肩关节炎,但PHF需要不同的解决方案。Catalyst的系统专门解决PHF的复杂性。Matthew D.Budge博士成功地使用该系统进行了首批手术之一。
4. 超声波图像深度学习算法开发商iCardio.ai人工智能超声心动图获FDA 510(k)批准
总部位于洛杉矶的公司iCardio.ai已经获得FDA 510(k)的许可,该公司的人工智能软件EchoMeasure设计用于超声心动图解释。该软件提供了全面的成像工作流程和自主的初步报告。iCardio.ai专门为超声波应用开发机器学习和深度学习算法,特别是经胸回声。FDA的批准是未来算法的基础,特别是结构性心脏病检测。此外,一些算法可以检测瓣膜性心脏病,吸引了卫生系统和人工瓣膜制造商的兴趣。该公司计划利用预测收入为未来的计划提供资金,最近与雅培合作为其成像设备开发人工智能应用程序。
5. 腹腔镜手术机器人公司CMR Surgcial旗下Versius手术机器人系统获批FDA
腹腔镜手术机器人Versius获FDA批准,将进军美国市场。该系统已完成全球26000例手术,现正进行儿科临床试验,评估其在多种手术中的安全性与有效性,涉及150名患者,并获多家权威机构批准。
6. 美国食品药品监督管理局批准Momentis的疝气修复机器人手术装置
Momentis Surgical的Anovo机器人手术平台已获得美国FDA 510(k)的许可,可用于单部位腹壁疝修补术。该设备具有仿人机器人手臂,旨在模仿外科医生的手臂,肩膀,肘部和手腕的灵活性,允许通过小切口进行360度旋转和屈曲。这项技术代表了对传统手术工具的重大改进,减少了对健康组织的潜在创伤。
7. 眼科诊断解决方案提供商Heidelberg Engineering诊断成像专用平台SPECTRALIS Flex模块获FDA批准
2024年10月14日,眼科诊断解决方案提供商Heidelberg Engineering宣布SPECTRALIS® Flex模块获得美国食品药物监督管理局(FDA)认证。这种创新的多模态诊断成像专用平台设计独特,适用于仰卧位儿童和成人患者眼后段成像。Flex模块将著名的SPECTRALIS安装在带有铰接式可调臂的活动支架上,提供了前所未有的灵活性,将成像功能扩展到各种体位和采集环境。这对于无法使用传统台式OCT设备成像的患者尤其有利。与传统的台式SPECTRALIS设备类似,Flex模块提供多种成像模式,包括高分辨率OCT、OCT血管造影(OCTA)、荧光素血管造影(FA)、吲哚青绿血管造影(ICG)、蓝激光自发荧光、多色以及宽场和超宽场成像。这种多模式成像方法有助于确保为所有患者提供方便的检查。
8. 博士伦enVista® Envy™全视力人工晶状体获得FDA批准
2024年10月14日,博士伦宣布,美国食品药品监督管理局(FDA)已批准enVista ® Envy™全视力人工晶状体(IOL),该人工晶状体在广泛使用的enVista IOL平台上提供连续的视野范围和出色的视觉障碍耐受性。一项评估了332名受试者的多中心、随机和对照临床试验表明,enVista Envy IOL在美国的长期疗效极佳。平均而言,86%的患者报告几乎没有或完全没有视觉障碍(眩光、光晕、星光)的困扰,总体上显示出令人印象深刻的耐受性。在一项评估了110名受试者的加拿大临床研究中,94%的患者报告几乎没有或完全没有观看近距离物体的困难,93%的患者对术后视力完全或中等满意。Envy在所有照明条件下均能提供出色的性能,这得益于ActivSync Optic智能能量分配,可优化多种照明条件下的视觉效果。Envy还能让外科医生更准确、更精确地治疗更多散光患者,在整个镜筒范围内达到0.5D或更小的度数。
9. 优时比2mL预充式注射器和预充式自动注射器获FDA批准
全球生物制药公司UCB宣布,FDA已批准一种2毫升预填充注射器和预填充自动注射器,其中含有320毫克BIMZELX®(bimekizumab bkzx)。这些新设备增加了现有的1毫升选项,并允许需要320毫克剂量的患者进行单次注射给药选择。该批准得到了生物等效性研究数据的支持。这是继欧盟委员会批准后,全球第二次批准320毫克单次注射方案。建议使用320 mg剂量的bimekizumab bkzx的适应症包括患有中度至重度疾病的成年人。
10. 临床诊断产品研发商Surmodics宣布Pounce XL血栓切除系统获FDA 510(k)许可
Surmodics公司的Pounce XL血栓切除系统获FDA批准,适用于5.5-10mm外周动脉血管,可快速恢复血流,减少后续手术需求。该系统扩大了Pounce平台的适应症范围,预计2025年上半年在部分市场发布。
二、欧盟及其它
1. 心通医疗第二代瓣膜球囊扩张导管Alwide® Plus在墨西哥获批上市
心通医疗自主研发的第二代瓣膜球囊扩张导管Alwide® Plus在墨西哥获批上市,已成功进入10个国家和地区。其优异性能获广大术者认可,将提升“中国智造”的国际影响力,为全球更多心脏病患者带来福音。
2. 医疗设备研发商Endostart磁导航球囊获CE批准,用于小肠诊疗
Endorail是磁导航球囊,新获CE批准用于小肠诊疗,有望改变手术方式,提高小肠疾病治疗水平,并扩大肠镜诊断至社区医院,降低操作难度。
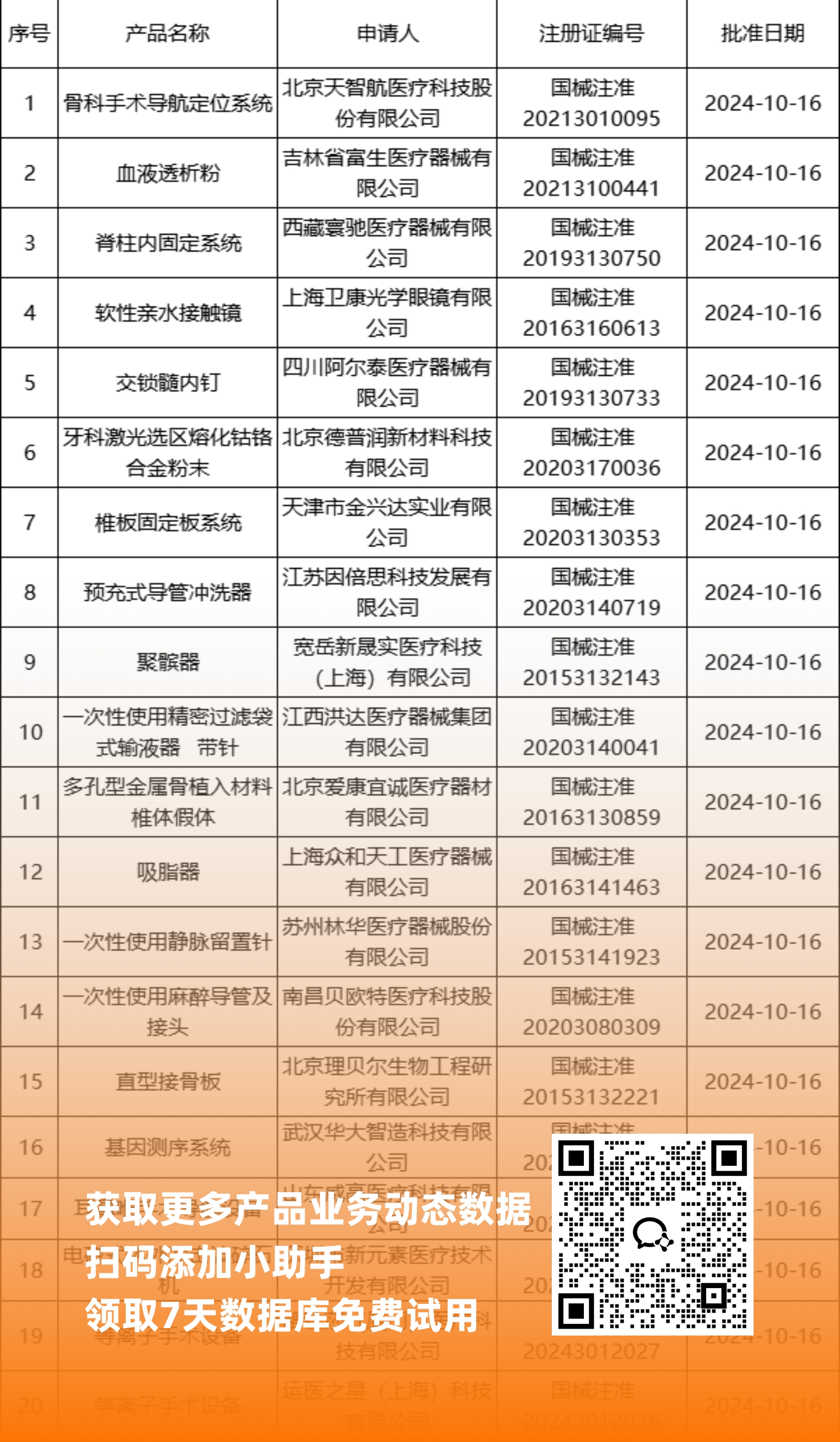
国内获批
NMPA最新获批器械产品明细
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉橙仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。
————🔓点击图片,解锁【华山医院】供需对接专场————