
商务合作

动脉网APP
2024年11月15日至11月21日,动脉橙产业智库重点整理了医疗器械产品国内外获批资讯及数据,涉及8个器械获FDA批准,两个器械获NMPA创新产品批准,另有380个器械获NMPA批准注册文件。
海外获批
1. 器械研发商Novocure创新型HFE传感器阵列与Optune Gio®配合使用治疗胶质母细胞瘤获FDA批准
Novocure宣布,FDA已批准其新的头部柔性电极(HFE)换能器阵列与Optune Gio®一起用于治疗成人多形性胶质母细胞瘤(GBM)。Optune Gio是一种可穿戴设备,可产生交变电场,称为肿瘤治疗场,以破坏癌细胞分裂。新的HFE阵列使用柔性聚合物材料,比目前的阵列更轻,更薄,更舒适。Novocure计划在2025年上半年将美国的Optune Gio用户过渡到新阵列。
2. 美敦力新型InPen™应用程序获FDA批准,为智能MDI系统与Simplera™ CGM的推出铺平道路
美敦力新型InPen™应用程序获FDA批准,为智能MDI系统与Simplera™ CGM的推出铺平道路。这一许可使美敦力的智能MDI系统能够与Simplera™连续血糖监测仪(CGM)一起推出。智能MDI系统将InPen™智能胰岛素笔与新型一次性一体式Simplera™CGM结合在一起,该CGM的尺寸是以前美敦力CGM的一半。
3. 医疗设备研发商CorVent宣布Respond重症监护呼吸机获FDA批准
CorVent Medical宣布其Respond重症监护呼吸机系统已获得FDA 510(k)许可。Respond是一款经济高效、重量轻、易于使用的呼吸机,将传统的机械通风与耐用的部件结合在一起。它不需要服务合同,并使用非专有电路和低压氧气以实现经济实惠。呼吸机满足从儿科到成人的所有患者的需求,包括标准呼吸模式,有创和无创通气,以及患者优先报警系统等功能。这位首席执行官对FDA的批准表示高兴,并指出这是对他们承诺的证明。
4. AR手术导航公司Augmedics宣布xvision脊柱系统®的新注册方法获FDA 510(k)批准
Augmedics是增强现实(AR)手术导航领域的领导者,已宣布FDA批准其xvision Spine System®的新注册方法。CT-to-fluoroscopy(CT-Fluoro)方法使外科医生能够使用术前CT扫描和标准2D C臂透视图像进行导航,从而无需进行3D术中成像。芝加哥拉什大学医学中心的弗兰克·菲利普斯(FrankPhillips)博士成功完成了第一例使用这种方法的手术,他赞扬了这项新技术的效率和可视化质量。这一进步有望扩大脊柱手术中AR导航的使用范围,从而提高准确性和减少辐射暴露。
5. BrightHeart用于检测先天性心脏缺陷的AI超声软件获FDA批准
BrightHeart的AI超声软件获FDA批准,用于检测先天性心脏缺陷,可提高产前诊断准确性和效率,帮助临床医生及早发现异常,减轻超声医师负担。
6. 基因组测序分析服务商Foundation Medicine宣布FDA批准FoundationOne® Liquid CDx作为TEPMETKO®的伴随诊断
Foundation Medicine, Inc.已获得FDA批准FoundationOne®液体CDx作为TEPMETKO®(tepotinib)的伴随诊断,由EMD Serono开发,用于治疗具有间充质上皮转化(MET)外显子14跳跃改变(METex14)的转移性非小细胞肺癌(NSCLC)。NSCLC占肺癌的85%,3-4%与METex14相关,与晚期疾病和预后不良有关。Foundation Medicine首席医学官Mia Levy表示,这种高质量的液体活检可以增强NSCLC患者的精准医学。Foundation Medicine是唯一一家获得FDA批准的基于组织和血液的基因组分析测试的公司。
7. 医疗机器人设备制造商Think Surgical手术机器人再次获FDA批准
Think Surgical宣布获得FDA 510(k)许可,将其TMINI手术机器人与LinkSymphoKnee一起使用,从而与Waldemar Link GmbH&Co.KG合作。这将LinkSymphoKnee添加到Think Surgical ID中心,扩大了开放平台TMINI系统的植入模块选项。2023年5月,美国食品和药物管理局(FDA)批准了TMINI,它拥有一个无线机器人手机,可协助全膝关节置换术。它可以自动调整外科医生的手部动作,确保精确的骨针放置和准确的骨切除。Think Surgical对开放平台方法的承诺旨在为外科医生提供更多的植入选择。
8. GE医疗3.0T头部MRI获批FDA
GE医疗的3.0T头部专用MRI扫描仪SIGNA MAGNUS获FDA批准,其创新设计和高效梯度线圈为神经成像提供更高精度和效率,有助于神经、肿瘤和精神疾病的检测。
国内获批
一、创新器械获批
1. 氧化锆陶瓷股骨头获批上市
2024年11月21日,国家药品监督管理局批准了北京安颂科技有限公司“氧化锆陶瓷股骨头”创新产品注册申请。该产品为髋关节假体组件,由氧化锆陶瓷材料制成,与同企业同系列组件配合,适用于髋关节置换。该产品采用高低温循环烧结技术,降低了烧结的高温温度,既为晶界扩散提供驱动力,又可避免高温温度过高引起的性能不佳问题。与金属股骨头相比,氧化锆陶瓷股骨头的化学惰性可有效避免金属离子释放,减少假体松动问题发生,同时还具有更好的生物相容性。
2. 植入式心脏起搏电极导线获批上市
国家药品监督管理局批准了创领心律管理医疗器械(上海)有限公司的“植入式心脏起搏电极导线”创新产品注册申请。该产品由电极导线及附件组成,联合配套的心脏起搏器构成一个植入式心脏起搏系统,主要用于心房和心室的起搏和感知。该产品可有效降低MRI扫描时心肌组织的温升,更好满足心律失常患者临床1.5T磁共振成像检查需求。
二、NMPA最新获批器械产品明细
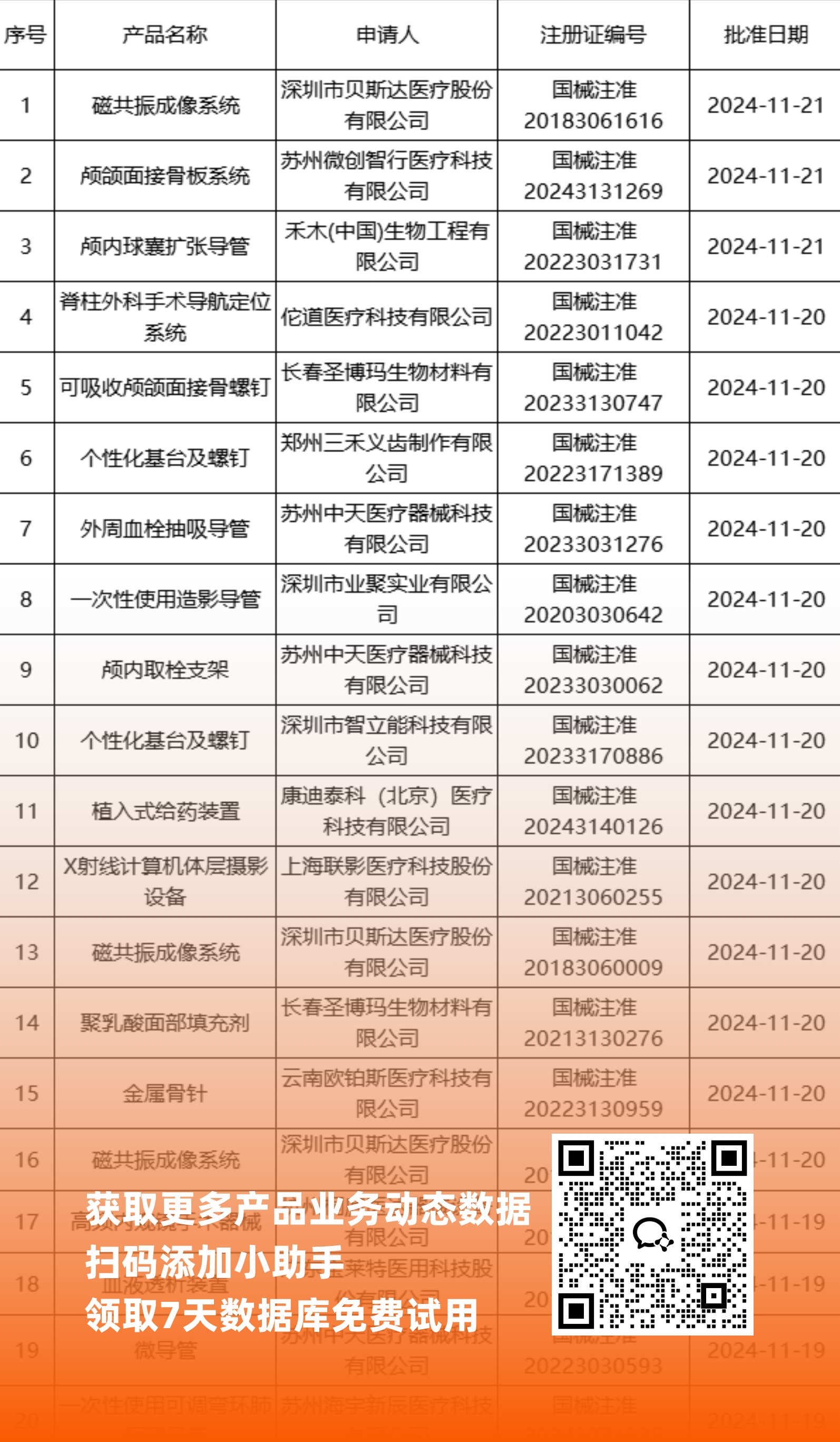
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉橙仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。
————🔓点击图片,解锁【脑机接口】资源对接专场————