
商务合作

动脉网APP
2024年12月6日至12月12日,动脉橙产业智库重点整理了医疗器械产品国内外获批资讯及数据,涉及5个器械获FDA批准,1个器械获欧盟及其它批准,另有212个器械获NMPA批准注册文件。
海外获批
一、FDA
1. 血管药物输送公司Liquet Medical同时治疗双侧肺栓塞的溶栓导管获FDA批准上市
Liquet Medical宣布其开创的“血流动力学引导的溶栓(HLT)”技术——Versus获FDA批准上市。血流动力学引导的溶栓(HLT)技术通过提供实时肺动脉压力监测来增强肺动脉溶栓的治疗效果,使临床医生能够根据个体患者的反应优化治疗,从而降低治疗风险。Versus的解决方案将使医生能够根据每位患者独特的临床需求提供个性化治疗。Versus为医生、患者和医院带来的好处,包括:主肺动脉的实时压力监测,使医生能够优化输送的药物量;辅助导管头端允许一根导管能够治疗双肺并降低每次手术的设备成本;以及可选的流向气球,用于快速紧急放置。
2. 医疗临床诊断产品研发生产商BioMerieux获FDA 510(k)许可,用于检测热带热病原体的综合征PCR面板
BioMérieux获FDA批准推出检测热带热病原体PCR面板,可快速诊断疟疾、基孔肯雅等,有望提高全球热带疾病诊断能力、减少疾病负担。
3. 内成像解决方案提供商Pentax Medical宣布i20c视频内窥镜系列新款获得FDA 510(k)批准
Pentax Medical宣布,其i20c视频内窥镜系列的新型号已获得FDA 510(k)许可,包括视频结肠镜EC34-i20cL,视频上GI镜EG27-i20c和附加右/左轮延长器OE-B17。新的超薄模型保留了前几代的标志性功能,例如可调刚度和人体工程学控制,改善了医疗专业人员的体验并优化了临床工作流程。该附加部件提高了双手较小的内镜医师的可接近性。
4. 试剂盒制造商Copan Diagnostics尿液收集和运输设备获FDA批准
Copan Diagnostics的UriSponge尿液收集和运输系统已获得FDA批准。它解决了临床实验室每年处理的大量尿液样本,占所有样本的近70%。UriSponge提供了一种用户友好且经济高效的方法来收集,保存和运输尿液样本。该设备使用快速浸泡和闭合方法简化了尿液从无菌容器转移到试管的过程,简化了工作流程。它的螺旋盖管配有塑料涂抹器和含有防腐剂的海绵,这些海绵在接触尿液时会活化,保持样品的稳定性并减少污染或降解风险。
5. 医疗器械供应商AngioDynamics用于前列腺组织消融的NanoKnife系统获FDA批准
AngioDynamics已获得FDA 510(k)的纳米刀系统许可,该系统用于中危前列腺癌患者的前列腺组织消融。在成功完成PRESERVE临床研究之后,该研究在121名患者中显示了该系统的安全性和有效性。该研究报告了积极的生活质量结果,包括尿失禁保留和勃起功能的最小降低。纳米刀系统使用非热无辐射技术精确消融前列腺组织,为传统治疗提供了微创替代方法。
二、欧盟及其它
1. MicroPort®CardioFlow的VitaFlow Liberty®在韩国获得上市批准
VitaFlow Liberty®经导管主动脉瓣和可回收输送系统是MicroPort®CardioFlow的第二代TAVI解决方案,已获得韩国MFDS的上市批准。它具有混合密度支架,牛心包小叶和双层PET裙子,可提供高径向支撑,同轴释放和减少术后泄漏。其升级的输送系统允许快速,稳定和精确的释放和回收,具有360°阀段灵活性,可提高手术精度。VitaFlow®系列和Alwide®球囊导管已使全球10000多名患者受益。MicroPort®CardioFlow成立于2015年,专注于开发创新的经导管解决方案。
国内获批
NMPA最新获批器械产品明细
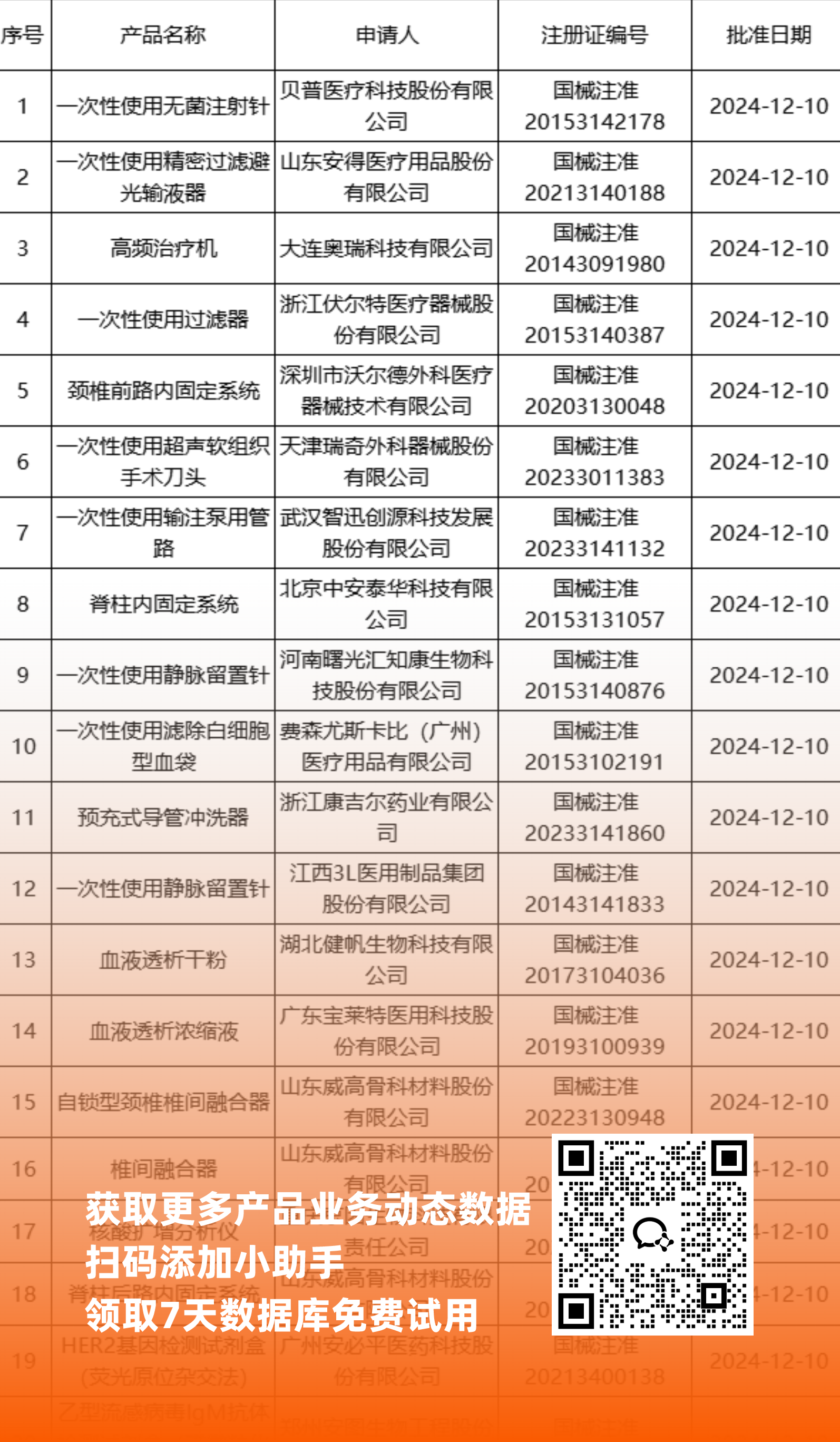
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉橙仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。
————🔓点击图片,解锁【手术导航系统】资源对接专场————