
商务合作

动脉网APP
2025年1月3日至1月9日,动脉橙产业智库重点整理了医疗器械产品国内外获批资讯及数据,涉及3个器械获FDA批准,2个器械获欧盟及其它批准,1个器械获NMPA创新产品批准,另有445个器械获NMPA批准注册文件。
海外获批
一、FDA
1. 成像设备研发商OXOS Medical宣布MC2 X射线系统获得FDA批准
MedTech创新者OXOS Medical宣布其MC2便携式X射线系统已获得FDA 510(k)许可,现已上市销售。MC2设备是便携式的、无绳的,并且提供清晰的成像以进行可靠的诊断。它具有动态数字射线照相(DDR)和荧光透视功能,易于使用的功能,以及轻巧的人体工程学设计,可以实现高效的X射线处理并减少办公室等待时间。这将使临床医生最大限度地利用其有限的空间并提供快速诊断,使患者恢复正常活动。
2. 大洲医学获批FDA首张3D打印多孔仿骨钽植入器械注册证
深圳大洲医学获FDA首张3D打印多孔仿骨钽植入器械注册证,创始人杨景周博士深耕生物医学材料领域,立志将科研成果应用于实践,造福患者。公司专注于研发新型再生医学材料与创新植入器械,已获多项国内外认证,成为医疗器械行业科技先锋。
3. Nuclein快速COVID/Flu分子检验系统获得FDA许可和CLIA豁免
Nuclein的DASH SARS-CoV-2和流感A/B测试已获得FDA 510(k)许可和CLIA豁免,该测试可在大约15分钟内从鼻拭子中检测出COVID-19和流感感染。总部位于德克萨斯州奥斯汀的Nuclein计划扩大DASH系统的测试菜单,以包括其他感染。该公司于2023年与Minute Molecular合并,并于2022年获得FDA对新型冠状病毒检测的紧急使用授权,并得到了RADx计划2130万美元合同的支持。
二、欧盟及其它
1. 凯利泰椎体后凸成形系统新加坡医疗器械注册证获批
凯利泰(300326.SZ)宣布,其椎体后凸成形系统已获新加坡卫生科学局注册证书,该系统主要用于治疗骨质疏松性椎体压缩性骨折。这一批准为公司在国际市场拓展提供了新机遇,有望增强其在全球医疗器械市场的竞争力,同时为患者提供更多治疗选择。此次获批也标志着凯利泰在医疗器械领域的创新实力和市场影响力得到进一步认可。
2. 美敦力Harmony TPVR系统获得CE批准
美敦力Harmony TPVR系统获CE批准,可在欧盟销售,此前已获FDA批准。该系统为严重肺动脉瓣反流患者提供微创治疗,临床数据显示一年后99%的患者无复合临床结果。
国内获批
一、创新器械获批
有晶体眼人工晶状体获批上市
2025年1月7日,国家药品监督管理局批准了爱博诺德(北京)医疗科技股份有限公司“有晶体眼人工晶状体”创新产品注册申请。该产品用于成年人有晶状体眼的治疗,矫正/降低成年人-3.25D~-18.00D的近视度数。产品采用零球差大光学区及双凹面型的稳定拱高设计,可提升视觉质量,带来更开阔的周边拱高。
二、NMPA最新获批器械产品明细
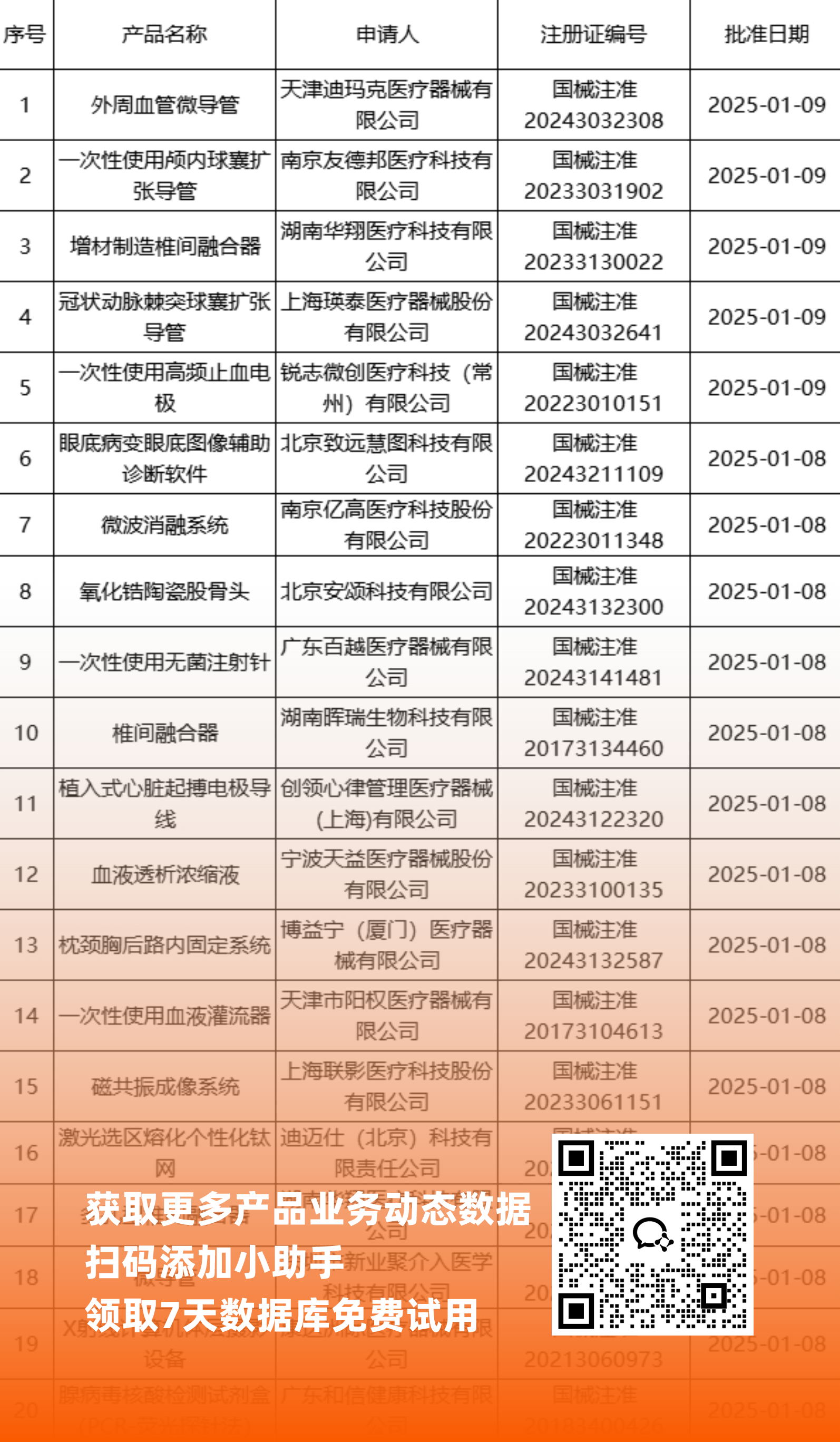
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉橙仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。
————🔓点击图片,解锁【内窥镜】资源对接专场————