
商务合作

动脉网APP
2025年1月17日至1月23日,动脉橙产业智库重点整理了医疗器械产品国内外获批资讯及数据,涉及5个器械获FDA批准,1个器械获欧盟及其它批准,2个器械获NMPA创新产品批准,另有417个器械获NMPA批准注册文件。
海外获批
一、FDA
1. Inflammatix获得美国食品药品监督管理局批准进行一流的TriVerity™检测
Inflammatix宣布,FDA已授权销售TriVerity测试系统,这是一种针对疑似急性感染或败血症患者的分子测试。TriVerity是第一个可以在评估重症监护需求的同时识别细菌和病毒感染的测试。它使用对患者免疫反应的精确测量,将高度准确的感染评分与疾病严重程度风险评估相结合,为临床医生提供对患者状况的快速而全面的了解。
2. 罗氏子公司,伴随诊断产品获批
罗氏子公司Foundation Medicine的FoundationOne CDx产品获美国FDA批准,可作为儿科低级别胶质瘤的伴随诊断工具,通过NGS技术检测BRAF等基因变异,指导治疗决策。
3. 医疗器械开发商Nalu周围神经刺激技术用于全身MRI获FDA批准
Nalu Medical宣布,FDA已批准对其全身MRI使用的周围神经系统进行扩展标记,为治疗慢性疼痛提供了更大的灵活性,并最大程度地减少了MRI相关的限制。这家总部位于加利福尼亚州卡尔斯巴德的公司提供FDA批准的脊髓和周围神经刺激技术,旨在通过向神经系统传递温和的电脉冲来治疗慢性神经性疼痛。Nalu的系统包括一个通过智能手机应用程序控制的无电池植入式脉冲发生器(IPG),预计使用寿命为18年。扩大的MRI条件性标记使该疗法能够以较少的限制接触到更广泛的受众,从而进一步推动了Nalu的使命,使更广泛的患者群体能够接受周围神经刺激疗法。
4. Pure Global助电子根尖定位仪成功获FDA 510(k)认证
Pure Global成功帮助客户的电子根尖定位仪通过FDA 510(k)认证,可在美国市场销售,展现了Pure Global的专业优势和全球医疗设备企业合规支持实力。
5. 美国食品药品监督管理局批准MediBeacon的TGFR系统用于肾功能评估
美国食品和药物管理局(FDA)已批准MediBeacon透皮GFR(TGFR)系统用于评估肾功能正常或受损人群的肾功能。该系统包括TGFR监测器,Lumitrace注射液和TGFR传感器。Lumitrace是一种非放射性示踪剂,静脉注射,其清除率可测量肾功能。TGFR传感器记录通过皮肤的Lumitrace荧光强度,监视器显示平均TGFR读数。该方法经验证可用于评估肾功能稳定者的肾小球滤过率(GFR),无需抽血或尿液检查。
二、欧盟及其它
赛诺医疗产品在秘鲁获得注册证
赛诺医疗的SC HONKYTONKTM冠脉球囊扩张导管在秘鲁获得注册证,这标志着公司海外业务拓展的重要一步,有望推动其产品在海外的销售。
国内获批
一、创新器械获批
1. 冷冻消融仪创新产品获批上市
2025年1月20日,国家药品监督管理局批准了心诺普医疗技术(北京)有限公司的冷冻消融仪创新产品注册申请。该产品由主机、同轴流体连接管和连接电缆组成,与该公司生产的球囊型冷冻消融导管配合使用,采用压力流量双控制技术,通过实时监测和控制制冷剂流量与球囊压力,实现球囊在充气和消融过程中的压力稳定。该技术可有效降低球囊在封堵肺静脉和消融过程中因压力波动而产生的弹跳移位风险,用于成人患者药物难治性、复发性、症状性的阵发性房颤治疗。
2. 人CDO1/AJAP1/GALR1基因甲基化检测试剂盒(荧光PCR法)创新产品获批上市
2025年1月20日,国家药品监督管理局批准了武汉凯德维斯生物技术有限公司的人CDO1/AJAP1/GALR1基因甲基化检测试剂盒(荧光PCR法)创新产品注册申请。该产品由引物、探针、聚合酶等材料组成,对人宫腔脱落细胞样本中基因甲基化状态进行定性检测,用于疑似子宫内膜癌患者的辅助诊断,对子宫内膜癌的防治、提升患者生存率具有重要意义。
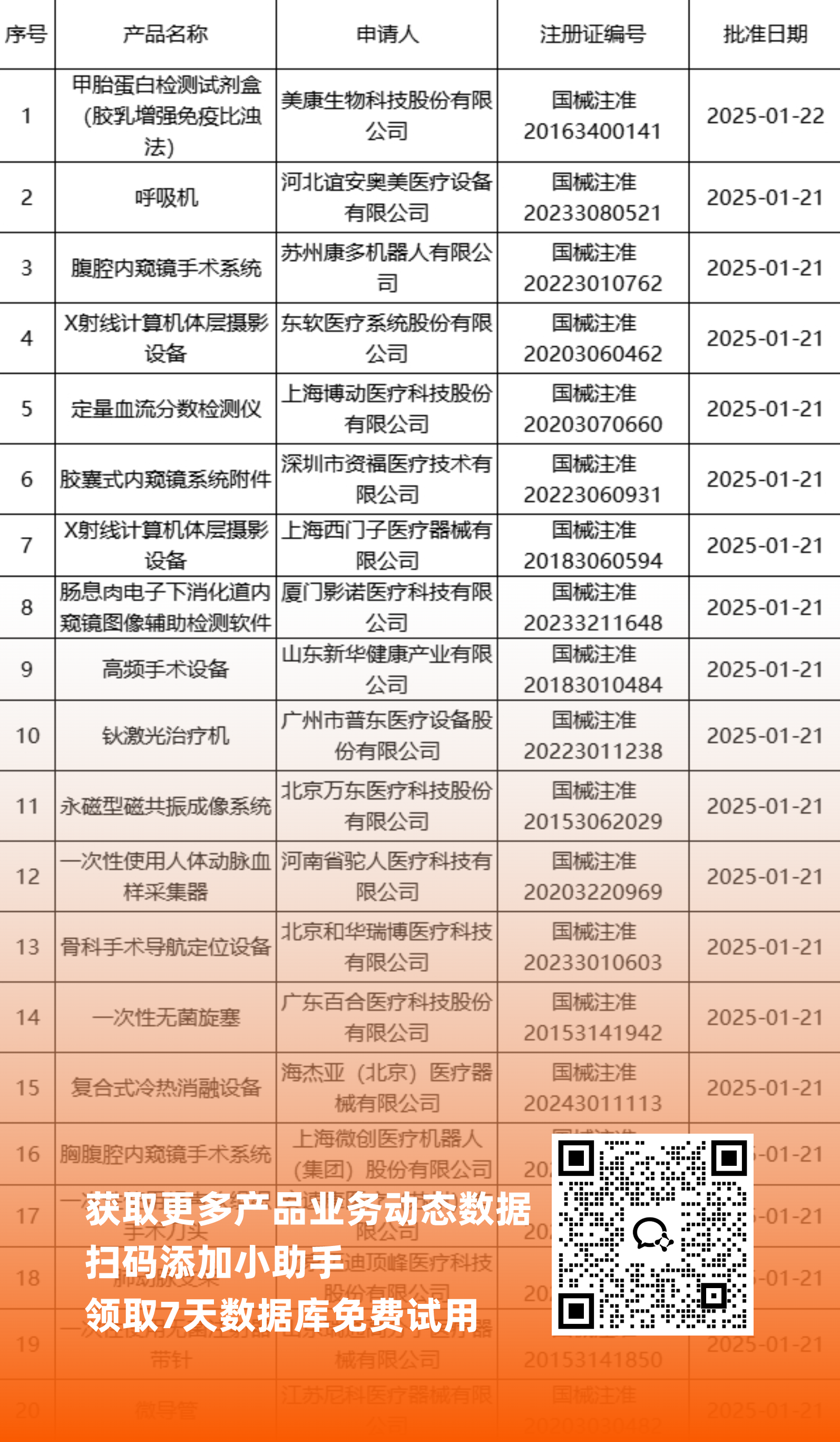
二、NMPA最新获批器械产品明细
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉橙仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。
————🔓点击图片,解锁【脑机接口】资源对接专场————