
商务合作

动脉网APP
2025年2月14日至2月20日,动脉智库重点整理了医疗器械产品国内外获批资讯及数据,涉及8个器械获FDA批准,5个器械获欧盟及其它批准,2个器械获NMPA创新产品批准,另有333个器械获NMPA批准注册文件。
海外获批
一、FDA
1. Aidoc获得FDA批准用于AI辅助的肋骨骨折分诊
Aidoc已获得FDA批准,其计算机辅助肋骨骨折分类产品CADt AI由其CARE1基金会模型提供支持。与传统的人工智能模型不同,该模型是为可扩展性而构建的,可以更快地开发和改进人工智能解决方案,同时确保更大的临床实力。Aidoc的研究得到了与亚马逊网络服务合作的支持,该合作为增强Aidoc的aiOS平台和CARE基金会模型技术提供了投资。Aidoc还正在开发下一个版本CARE2,计划在未来几个月发布。该公司的AIO分析和汇总医疗数据,使护理团队能够“操作意外事件并无缝工作”。
2. FDA批准了Hologic公司的Aptima SARS-CoV-2检测方法
美国食品和药物管理局(FDA)已批准Hologic的Aptima SARS-CoV-2检测510(k)许可,这是其2020年5月首次紧急使用许可的进步。该测试使用转录介导的扩增化学来鉴定和定量遗传序列,从患有呼吸道感染症状的个体的鼻咽或鼻拭子样本中检测SARS-CoV-2 RNA。鼻拭子不那么令人不舒服。该检测在Hologic的Panther系统上运行,在三个小时内即可获得初步结果,并且可以在24小时内处理1000多个测试。它的发展由美国卫生与公众服务部资助。
3. AI医学影像增强软件Subtle Medical宣布MRI加速和增强软件SubtleHD™获FDA批准
人工智能医学成像领域的领导者Subtle Medical宣布FDA批准其先进的MRI加速和增强软SubtleHD™。这标志着包括SubtleHD™、SubtleSYNTH™和SubtleALIGN™在内的人工智能套件微妙精英™的推出,旨在提高图像质量,将某些序列的MRI扫描时间减少多达80%,提供前所未有的速度和工作流程自动化。
4. 骨科医疗技术公司Gyder Surgical创新型髋关节导航系统获批FDA
Gyder Surgical的GYDER® Hip System获FDA批准,这是全球首个无针、无影像的髋关节置换导航系统,旨在提高手术准确性,降低并发症风险,并适用于门诊手术中心,已在多国成功应用。
5. 获批FDA,新型腹壁吻合器
Suturion公司的SutureTOOL™腹壁吻合器获FDA批准,计划2025年春在美国上市。该吻合器通过标准化缝合提高手术安全性和效率,反映了医疗器械行业向自动化、标准化转变的趋势。全球腹腔手术吻合器市场规模庞大,持续增长,SutureTOOL™的推出有望在该市场占据重要地位。
6. 罗氏子痫前期测定Nabs FDA 510(k)许可
罗氏诊断公司子痫前期检测工具获得FDA 510(k)许可,通过检测SFlt-1和PlGF比率来预测孕妇子痫前期风险,辅助临床医生制定护理计划。
7. 30分钟出结果,分子POCT29联检获上市许可
Inflammatix公司的TriVerity™检测系统获FDA上市批准,可30分钟快速检测急性感染和脓毒症,通过测量免疫反应提供细菌感染、病毒感染及疾病严重性评估。
8. 分子POCT平台再出新品,11重PCR胃肠道感染检测FDA获批
生物梅里埃的FilmArray平台推出11重胃肠道PCR检测组合,获FDA批准,可快速准确检测引起胃肠炎的病原体,简化诊断流程,改善患者预后。该产品预计2025年上半年在美国上市。
二、欧盟及其它
1. 中国呼吸道抗原7联检产品,泰国上市
北京英诺特生物自主研发的呼吸道抗原7联检产品成功在泰国上市,可同步检测7种病原体,助力提升筛查效率。英诺特专注于体外诊断,已构建6大技术平台。
2. 全球第一家人工晶体制造商Rayner三焦点预装式人工晶状体获批加拿大
Rayner公司的RayOne EMV非球面人工晶状体获加拿大卫生部批准,其利用正球面像差扩展视力,无衍射环设计,适合白内障等治疗,减少眼镜依赖,提供广泛视力范围。
3.生物可吸收植入物开发商Bioretec生物可吸收创伤螺钉获批CE
Bioretec的RemeOs创伤螺钉获得CE认证,将在欧盟等地销售。该产品由可吸收材料制成,适用于四肢骨折固定,具有显著的骨促进特性,临床研究显示高愈合率,且安全性高,特别适用于儿科应用。
4. 奥精医疗产品在印度尼西亚获得注册证
奥精医疗(688613.SH)宣布,其人工骨修复材料产品已于2024年12月向印度尼西亚卫生部递交注册申报资料,并成功获得批准。
5. MicroPort®CardioFlow的VitaFlow Liberty®在印度获得上市批准
MicroPort CardioFlow的第二代经导管主动脉瓣植入(TAVI)解决方案VitaFlow Liberty®已获得印度中央药物标准控制组织的上市批准。VitaFlow Liberty®以其前身的瓣膜设计为基础,采用自膨胀支架、牛心包小叶和先进的宠物裙,提供强大的径向支撑和减少渗漏。其创新的输送系统允许快速,稳定和精确的释放和检索。作为世界上唯一的电动可回收TAVI系统,VitaFlow Liberty®已被700多家医院采用,数千名患者受益。印度的TAVI市场预计会增长,这一批准有望提高印度医生的手术经验。
国内获批
一、创新器械获批
1. 一次性使用球囊型冷冻消融导管创新产品获批上市
2025年2月18日,国家药品监督管理局批准了心诺普医疗技术(北京)有限公司的一次性使用球囊型冷冻消融导管创新产品注册申请。该产品由球囊型冷冻消融导管和手动回缩器套包组成,与该公司生产的冷冻消融仪配合使用,主要用于成人患者药物难治性、复发性、症状性的阵发性房颤的治疗。一次性使用球囊型冷冻消融导管采用特殊流体喷射装置和球囊内压力监测技术。特殊流体喷射装置可保证球囊前半球表面温度的均匀分布,实现有效消融;球囊内压力监测技术可保证球囊稳定贴靠,实现球囊内部压力稳定。该产品可有效降低消融过程中球囊因压力波动而产生的弹跳移位风险,使更多阵发性房颤的患者受益。
2. 经皮肾小球滤过率测量设备创新产品获批上市
2025年2月18日,国家药品监督管理局批准了美德康公司的经皮肾小球滤过率测量设备创新产品注册申请。该产品由主机、传感器和固定贴组成,与该公司生产的瑞玛比嗪注射液配合使用,主要用于评估患者肾小球滤过率。该产品采用漫反射校正和背景分离校正的荧光示踪剂无创测量方法,通过皮肤表面获取具有时变光学性质的荧光信号衰减数据,实现对肾小球滤过率的连续测量,具有操作简单、无创、快速、准确和可重复测量等优点,使更多需要肾功能监测的临床诊疗患者受益。
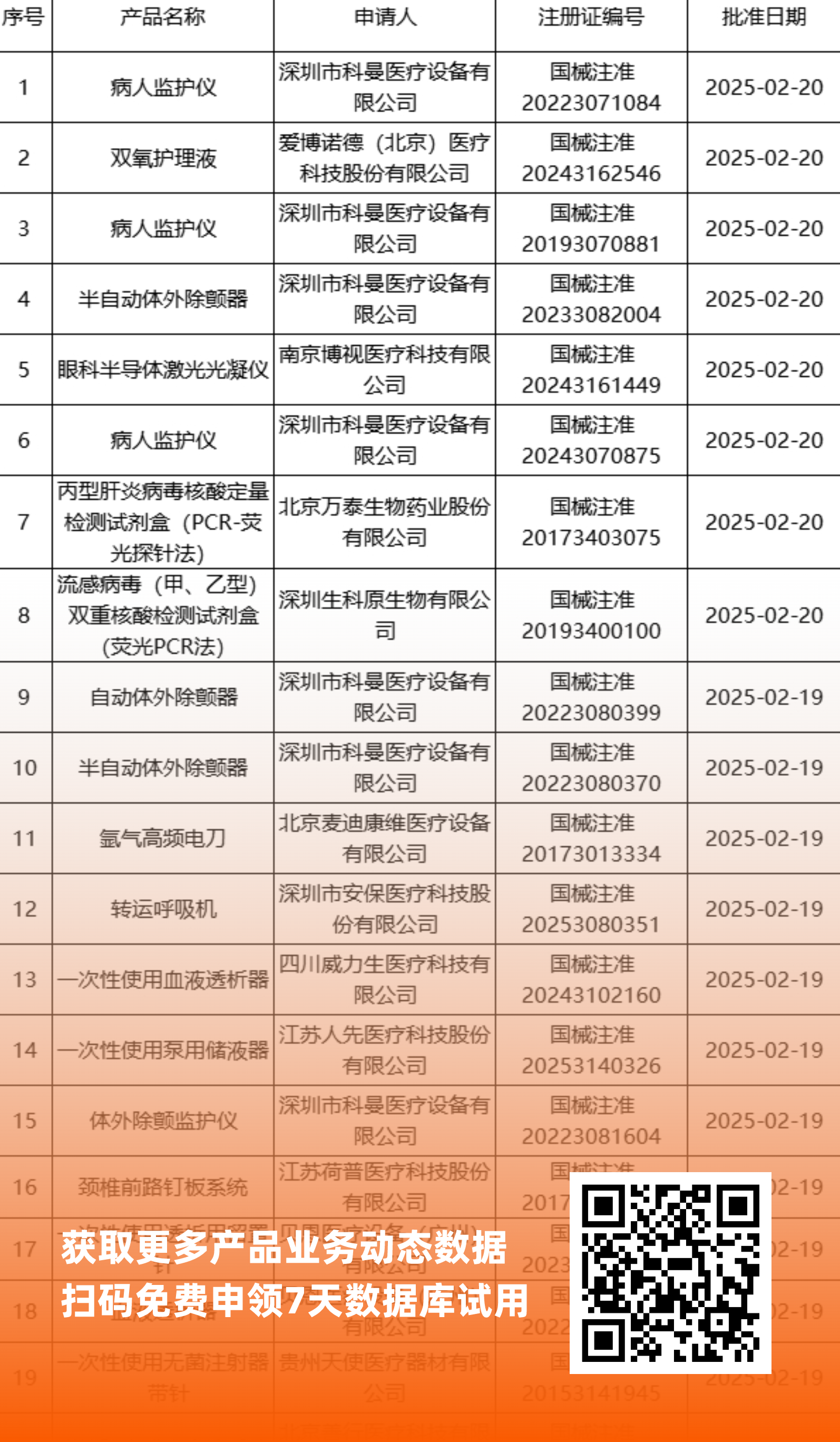
二、NMPA最新获批器械产品明细
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉智库仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。