
商务合作

动脉网APP
2025年3月7日至3月13日,动脉智库重点整理了医疗器械产品国内外获批资讯及数据,涉及9个器械获FDA批准,3个器械获欧盟及其它批准,2个器械获NMPA创新产品批准,另有355个器械获NMPA批准注册文件。
海外获批
一、FDA
1. MONARCH QUEST:强生智能软体手术机器人获FDA批准上市
强生新款智能软体手术机器人MONARCH QUEST获FDA批准上市,搭载AI算法,可与3D影像系统互联,提高肺癌活检精准度,助力早期癌症诊断与治疗。
2. 脊柱外科公司Spineart和eCential Robotics宣布FDA批准PERLA®应用程序用于Op.nTM机器人导航平台
Spineart 和 eCential Robotics 宣布 PERLA® 应用程序已获得 FDA 批准,可与 Op.n™ 机器人导航平台配合使用。这标志着机器人辅助脊柱手术的一个重要里程碑,结合了两家公司的专业优势。PERLA® 应用程序将 Spineart 的螺钉系统与 eCential 平台整合,提供专为导航设计的界面和专用工具,以提高手术精度和操作流程。公司还扩展了与系统兼容的 3D C 臂范围,展示了他们提供尖端解决方案同时优化资源的能力。
3. Elute获得美国FDA批准其新型合成可吸收骨缺损填充剂
Elute公司宣布其创新的骨缺损填充植入物BonVie+™已获得FDA批准。BonVie+旨在通过新骨的生长实现可控的吸收与替代,解决了现有骨移植替代材料(如不可生物降解和无法支持骨再生)的局限性。这款新型植入物凝聚了十多年的创新成果,为临床医生提供了更可靠的骨修复解决方案。
4. 胃肠装置系统开发商GT Metabolic™扩展了MagDI™系统,50mm磁铁获得FDA许可
磁性手术领域的领导者GT Metabolic Solutions, Inc.宣布FDA已批准了更大的50毫米MagDI™系统磁铁,与现有的40毫米磁铁形成互补。这一扩展使外科医生能够在磁铁辅助的十二指肠-回肠吻合术中适应更广泛的患者群体,彰显了GT Metabolic Solutions, Inc.致力于推动创新手术解决方案以改善患者预后的承诺。MagDI系统是一种自对齐、无切口、无缝合且无钉的技术,旨在促进吻合的同时不留异物。通过新增的磁铁尺寸选择,该系统为外科医生提供了更大的灵活性。
5. 心脏病检测公司Caristo人工智能CAD诊断软件获FDA批准
美国食品药品监督管理局 (FDA) 批准了 Caristo Diagnostics 的 CaRi-Plaque,这是一款用于诊断冠状动脉疾病 (CAD) 的人工智能辅助软件。该软件利用常规的冠状动脉计算机断层扫描血管造影 (CCTA) 来量化冠状动脉炎症和动脉斑块堆积。2022 年,冠心病在全球造成约 37 万人死亡,其原因是斑块堆积导致破裂和血栓形成。Caristo 首席执行官 Frank Cheng 表示,人工智能使得心脏病的治疗可以更加主动,摆脱了等待症状出现的被动方法。
6. 贝克曼库尔特宣布集成临床化学和免疫测定系统的DxC 500i临床分析仪获FDA批准
贝克曼库尔特诊断公司宣布,其新型 DxC 500i 临床分析仪已获得 FDA 510(k) 许可。该分析仪整合了临床化学和免疫分析功能,结合了先进技术与直观界面,适用于各种规模的实验室以满足现代医疗需求。DxC 500i 每小时可完成多达 800 次临床化学测试和 100 次免疫测定测试,提供精确可靠的结果,对及时的临床决策至关重要。此外,随着全球医疗系统逐渐转向网络化实验室运营模式,DxC 500i 符合这一趋势,有助于提升效率和护理质量。
7. 医疗技术公司Zimmer Biomet宣布Persona® Revision SoluTion™股骨获得FDA批准
Zimmer Biomet宣布,美国食品药品监督管理局(FDA)已批准其Persona® Revision SoluTion™股骨组件,这是一种专为对某些金属敏感的患者设计的膝关节翻修植入物。该植入物是全面的Persona翻修膝关节系统的一部分,采用专有的表面硬化处理技术以提高耐磨性能,并为外科医生提供解剖学组件。Zimmer Biomet的膝关节部门总裁Joe Urban表示,自豪于推出一种未故意添加镍、钴和铬等常见金属过敏原的全膝关节翻修结构,解决金属敏感性这一可能导致翻修手术的潜在问题。考虑到皮肤金属超敏反应影响10-15%的人口,这一创新解决了肌肉骨骼健康领域的一个重大挑战。
8. 分子检测解决方案技术提供商Qiagen肠胃迷你检测组合获得FDA许可
Qiagen的QiaStat-Dx系统新获FDA许可,可检测五种胃肠道病原体,加强了其满足不同患者需求的能力,并计划扩大产品组合。
9. 次抛型手掌式PCR呼吸道三联检获FDA批准
Visby Medical的手持式PCR呼吸道三联检获FDA批准及CLIA豁免,可30分钟检测新冠病毒及甲型/乙型流感病毒,适用于偏远或资源有限医疗环境,但高成本仍是市场扩张的阻碍。
二、欧盟及其它
1. 心通医疗VitaFlow Liberty®和Alwide® Plus在哈萨克斯坦获批上市
杏泽资本伙伴企业心通医疗的VitaFlow Liberty®和Alwide® Plus在哈萨克斯坦获批上市,将助力公司全球化,惠及更多心脏病患者。两款产品已进入20余个国家和地区,治疗超10,000位患者。VitaFlow Liberty®是全球首款电动可回收TAVI产品,Alwide® Plus则采用创新设计,实现更精准球囊扩张。
2. 生物医学公司Femasys宣布FemBloc分娩系统在欧洲获批
Femasys Inc. 是一家专注于女性健康的生物医学创新公司,近日宣布其 FemBloc® 输送系统获得了欧洲合格认证(CE 标志),这是全球首个非手术女性永久避孕方法的监管批准。公司还完成了针对 FemBloc 混合聚合物(该系统的重要组成部分)的加速 G12 特殊 MDR 审计,CE 标志的批准正在等待欧洲药品管理局(EMA)的审查,预计可能在 2025 年年中获得批准。这一里程碑为女性提供了一种更安全、更易获取的永久避孕选择,成为手术方法的替代方案。Femasys 正在为 FemBloc 在部分欧洲国家的潜在市场推出做准备。
3. Body Vision Medical的LungVision®在澳大利亚获得监管批准,扩大了用于肺癌诊断的人工智能高级成像技术的使用范围
Body Vision Medical是一家人工智能驱动的术中成像领域的领导者,宣布其LungVision高级成像系统已获得澳大利亚治疗用品管理局(TGA)的监管批准。这标志着该公司在改善早期且准确的肺癌诊断使命中迈出了重要的一步。肺癌是澳大利亚癌症相关死亡的主要原因,随着政府推出国家肺癌筛查计划(NLCSP),对于可疑肺结节患者明确的诊断路径需求日益增长。LungVision可以将任何C型臂转变为3D成像系统,提供实时导航和增强的可视化功能,以实现更精确的支气管镜活检,支持NLCSP的临床目标,并有可能改善患者的治疗效果。
国内获批
一、创新器械获批
1. 经导管三尖瓣环成形系统获批上市
2025年3月11日,国家药品监督管理局批准了上海汇禾医疗科技股份有限公司经导管三尖瓣环成形系统创新产品注册申请。经导管三尖瓣环成形系统包括三尖瓣环夹系统和输送鞘套件,其中三尖瓣环夹系统包括夹合部件、锚钉部件和输送系统,输送鞘套件包括输送鞘和扩张器。该产品用于缓解患者的三尖瓣反流和心衰的临床症状。适用于无需同期行左侧瓣膜手术的孤立性重度三尖瓣反流伴有非严重的瓣环扩张或右心室扩大,有右心衰的临床症状;无严重肺动脉高压,无严重右心室/左心室收缩功能障碍,且经过指南指导药物治疗30天以上药物治疗疗效不佳,经心脏团队评估为不适合外科手术的65岁以上的高危禁忌患者。
2. 消化道内窥镜手术器械控制设备创新产品获批上市
2025年3月12日,国家药品监督管理局批准了深圳市罗伯医疗科技有限公司的消化道内窥镜手术器械控制设备创新产品注册申请。该产品由电控单元、驱动装置、操作手单元组成,与该公司生产的一次性使用消化道内窥镜组织钳配合使用,适用于食管、胃内镜黏膜下剥离术中对病变组织进行钳夹、提拉。该产品为国内首个消化内镜整合型机器人,采用消化内镜外挂柔性机械臂,通过主从控制模式实现末端执行器4自由度运动,精确控制夹取位置与方向,并对有重复夹取需求的组织进行提拉,确保手术视野清晰,降低手术风险。该产品具有设计简洁、操作简便、成本低廉等优势,对推进我国消化道早癌早诊早治,降低全社会消化道癌症医疗负担具有积极意义。
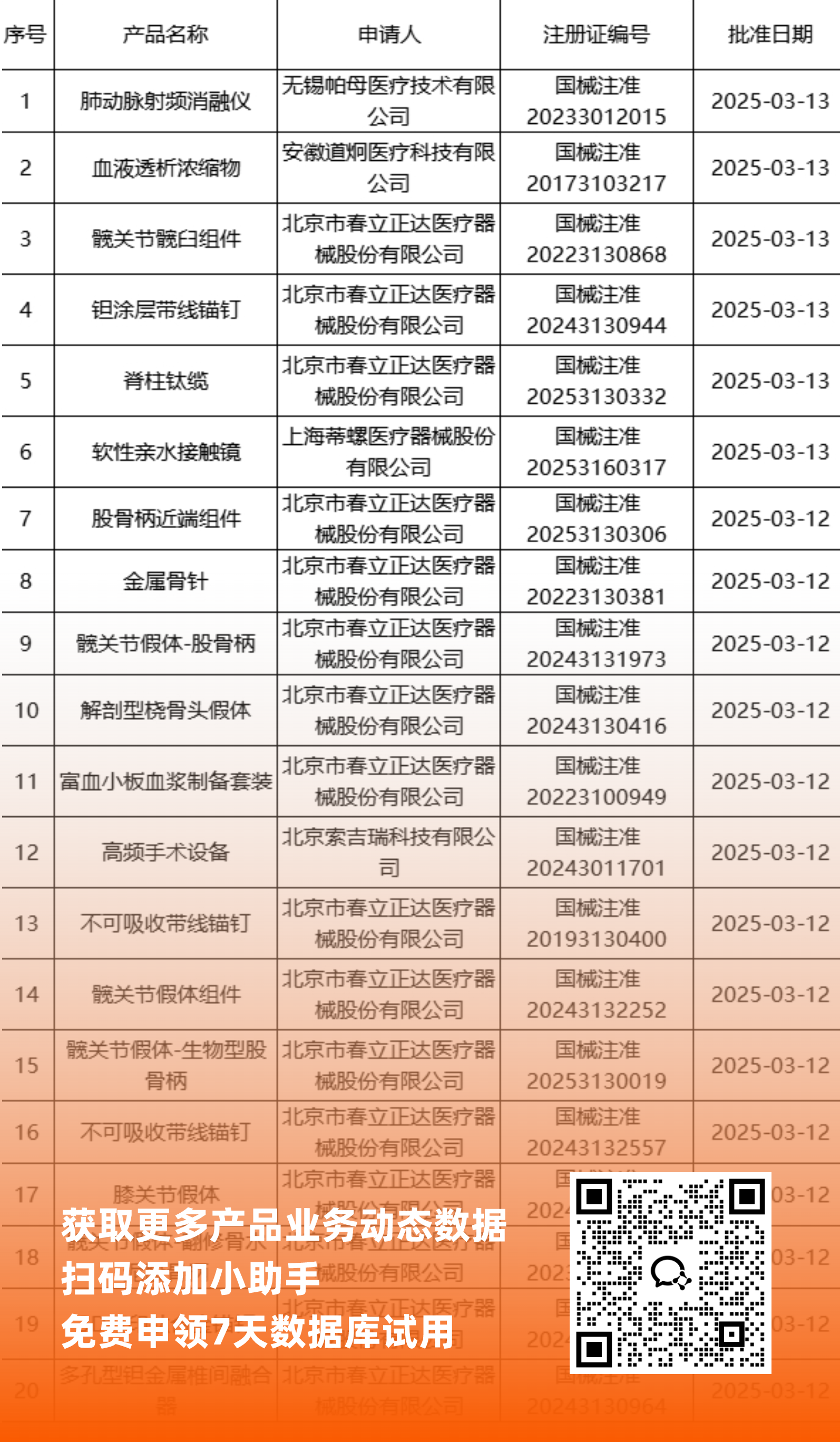
二、NMPA最新获批器械产品明细
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉智库仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。