
商务合作

动脉网APP
2025年3月21日至3月27日,动脉智库重点整理了医疗器械产品国内外获批资讯及数据,涉及11个器械获FDA批准,2个器械获欧盟及其它批准,2个器械获NMPA创新产品批准,另有370个器械获NMPA批准注册文件。
海外获批
一、FDA
1. 医疗设备生产商Vasorum宣布Celt ACD® PLUS血管闭合装置获得FDA批准
Vasorum USA, Inc. 宣布其 Celt ACD® PLUS 系统获得 FDA 批准,该系统采用 Blood Signal 技术,用于在血管手术中实现精确定位和闭合。这款下一代设备提供 5F、6F 和 7F 三种尺寸,可减少出血和血肿等并发症。首次使用 Celt ACD® PLUS 的商业病例已在 Prime 血管研究所成功完成,展示了术后麻醉护理中的效率提升和成本节约。
2. 医疗技术公司MedCAD宣布AccuStride足踝系统获FDA 510(k)许可
MedCAD公司旗下的AccuStride足踝系统已获得FDA 510(k)许可,该系统能够为外科医生提供针对患者的定制设备,以在单一手术中矫正多种足部和踝关节疾病。该系统由紫外线固化丙烯酸聚合物或钛合金制成,标志着MedCAD正式进入下肢市场。首席执行官南希·海尔斯顿表示,这些定制的3D打印设备预计将减少手术频率和时长,带来持久且高质量的效果。足踝骨科专家对该系统表现出极大兴趣。该系统旨在改善各类手术的效果,并为特定的足部矫正提供定制化解决方案。
3. 强生推出机器人电外科能量系统
强生医疗科技(Johnson & Johnson MedTech)宣布推出其已获得美国 FDA 批准的 Dualto 能量系统。Dualto 是一种外科手术解决方案,将多种能量模式整合到一个集成平台上,适用于开放手术和微创手术。此外,DUALTO 还设计为未来与公司的 OTTAVA™ 机器人手术系统配合使用。
4. 手术机器人公司Restore Robotics获得FDA 510(k)许可,可再制造达芬奇Xi 8mm单极弯剪
截至2025年3月11日,Restore Robotics通过其子公司Iconocare Health获得了FDA 510(k)许可,可对达芬奇Xi单极剪进行再制造。这为医院和手术中心提供了一种相较于从原厂购买更具成本效益和可持续性的替代方案。通过与Encore Medical Device Repair合作,Restore Robotics旨在高效地将再制造器械推广至全美,扩大获得经济实惠、高质量手术工具的机会。Restore Robotics首席执行官Clif Parker表示,这一许可是机器人器械再利用的一项突破。参与再制造计划的医院能够大幅节省开支,释放预算资源。Encore总裁兼首席运营官Tom Milano强调了器械管理在降低成本和保护环境方面的重要性。
5. FDA批准TLX007-CDx试剂盒
美国食品药品监督管理局(FDA)已批准TLX007-CDx,这是一种新一代前列腺特异性膜抗原(PSMA)-PET影像剂,用于男性前列腺癌患者PSMA阳性病灶的PET扫描。该批准基于临床试验数据,评估了镓-68戈泽妥肽注射液(Gozellix)在因PSA水平升高而疑似转移或复发的患者中的疗效。Telix精密医学公司首席执行官凯文·理查森表示,这一批准是前列腺癌患者的重要里程碑,为他们提供了更先进的影像技术。Telix致力于将这种新一代前列腺癌扫描技术带给更多美国男性,提供可靠性、服务和灵活性。
6. 奥卡米医疗宣布扩充产品组合,新增SENDERO® MAX输送导管
奥卡米医疗公司于2025年3月24日宣布,其SENDERO MAX输送导管已获得FDA批准。此举扩展了奥卡米的栓塞产品组合,为阻断直径1.5毫米至9.0毫米的外周动脉血管血流提供了全面解决方案。SENDERO导管经过优化,可与LOBO封堵器配合使用,具有亲水涂层、不锈钢编织层和显影标记环,以实现精确定位。LOBO设计能够减少血流并加速血管闭合。奥卡米总裁兼首席执行官对扩展后的产品组合表示兴奋,而北卡罗来纳大学的一名介入放射科医生则强调了该系统的完整性。
7. 眼科医疗设备公司AI Optics宣布Sentinel Camera手持式视网膜成像系统获批FDA
2025年3月24日获悉,眼科医疗设备公司AI Optics宣布,其Sentinel Camera手持式视网膜成像系统已获得美国FDA 510(k)许可,标志着眼科筛查技术迈入轻量化、智能化新阶段。Sentinel Camera能够捕捉高质量的图像,且无需进行瞳孔扩张。一项临床试验显示,无需瞳孔扩张的AI筛查设备在检测糖尿病视网膜病变方面的灵敏度超过85%。据公司介绍,这消除了部分患者前往眼科诊所的需求。此外,Sentinel Camera支持符合DICOM标准的图像格式,能够与电子健康记录(EHR)系统集成,从而简化护理协调、计费和数据共享。Sentinel Camera主要用于如糖尿病视网膜病变、与年龄相关的黄斑变性(AMD)和青光眼的筛查,医生可以根据相机的成像结果,观察视网膜的形态、结构等情况,判断是否存在病变。
8. 3D手术规划工具提供商Vent Creativity用于膝关节置换手术的软件解决方案获FDA批准
美国食品药品监督管理局 (FDA) 已批准 Vent Creativity 公司的 Hermes Knee,这是一款用于膝关节置换手术的人工智能驱动软件解决方案。该解决方案基于 Minerva 平台,利用深度学习为各种对齐技术创建手术计划,还可以规划和分析其他适应症的研究应用。它通过专利的“点云”格式提供骨骼结构交互,能够评估人类表型和关节炎状态的变化。手术前可以可视化最终操作,便于与以往病例进行比较。
9. 血栓清除器械研发商Perfuze脑卒中新型导引导管获批FDA
爱尔兰公司Perfuze的新型导引导管Zipline获FDA批准上市,并完成2200万欧元融资。该导管可提升血栓清除效率,简化手术流程,改善中风治疗。
10. 获批FDA,脊柱机器人导航平台再升级
脊柱外科公司Spineart的PERLA® App获得FDA 510(k)许可,可用于eCential Robotics的机器人导航平台,提高手术精度和效率。该平台集成2D/3D成像、导航和机器人技术,简化手术流程。
11. 梅里埃新品获批,微生物诊断护城河再度加宽
梅里埃的Vitek Compact Pro系统获得美国FDA 510(K)许可,其人体工程学设计和简单工作流程提升检测效率,且能快速精准识别微生物及其对抗生素敏感性,助力抗菌管理。
二、欧盟及其它
1. 大脑可植入医疗设备开发商Newronika第二款自适应脑起搏器获批上市
Newronika公司推出的AlphaDBS是第二款获CE批准的自适应脑起搏器,采用先进的AI算法实时监测、分析患者大脑活动信号并自动调整刺激参数,实现个性化治疗,临床数据显示其相比传统模式具有显著优势,有望重新定义帕金森病治疗标准。
2. 国产创新骨修复材料再获认证
奥精医疗的BonGold™人工骨修复材料获得越南卫生部批准,正式进入越南市场。该产品具有高度仿生的骨组织再生修复能力,已在多国获批,助力公司海外市场拓展。
国内获批
一、创新器械获批
1. 冠状动脉介入手术控制系统创新产品获批上市
2025年3月21日,国家药品监督管理局批准了北京唯迈医疗科技股份有限公司的冠状动脉介入手术控制系统创新产品注册申请。该产品由控制机柜、液晶显示器、触摸屏、控制盒、导丝与导管执行机构组成,适用于经皮冠状动脉介入手术期间对导管和导丝的输送与操作。该产品属于支架递送型机器人,采用隔室控制介入机器人手术系统、基于仿生学的导丝控制技术和柔性导丝阻力检测技术。隔室控制介入机器人手术系统采用主从架构设计,具有低延时、高安全操作特点;基于仿生学的导丝控制技术模拟医生手指导丝运动,具有小体积、高精度控制特点;柔性导丝阻力检测技术实时获取动态变化的受力信号,具有高灵敏、高稳定信息传输特点。该产品可有效提高经皮冠状动脉介入手术的操作精度、稳定性和灵活性,使更多患者受益。
2. 一次性使用压力监测射频消融导管创新产品获批上市
2025年3月26日,国家药品监督管理局批准了湖南埃普特医疗器械有限公司的一次性使用压力监测射频消融导管创新产品注册申请。该产品由头端、管身、手柄、线缆、盐水接头和光电混合插头组成,与上海宏桐实业有限公司的心脏射频消融仪配合使用,主要用于药物难治性、复发性、症状性的阵发性房颤的治疗。一次性使用压力监测射频消融导管通过内置光学压力传感器,实现临床使用过程中压力的实时监测和反馈,确保消融效果稳定性。该产品可有效降低术中导管与组织贴靠过紧造成蒸汽爆裂或贴靠不足引起消融不完全等风险,使更多阵发性房颤的患者受益。
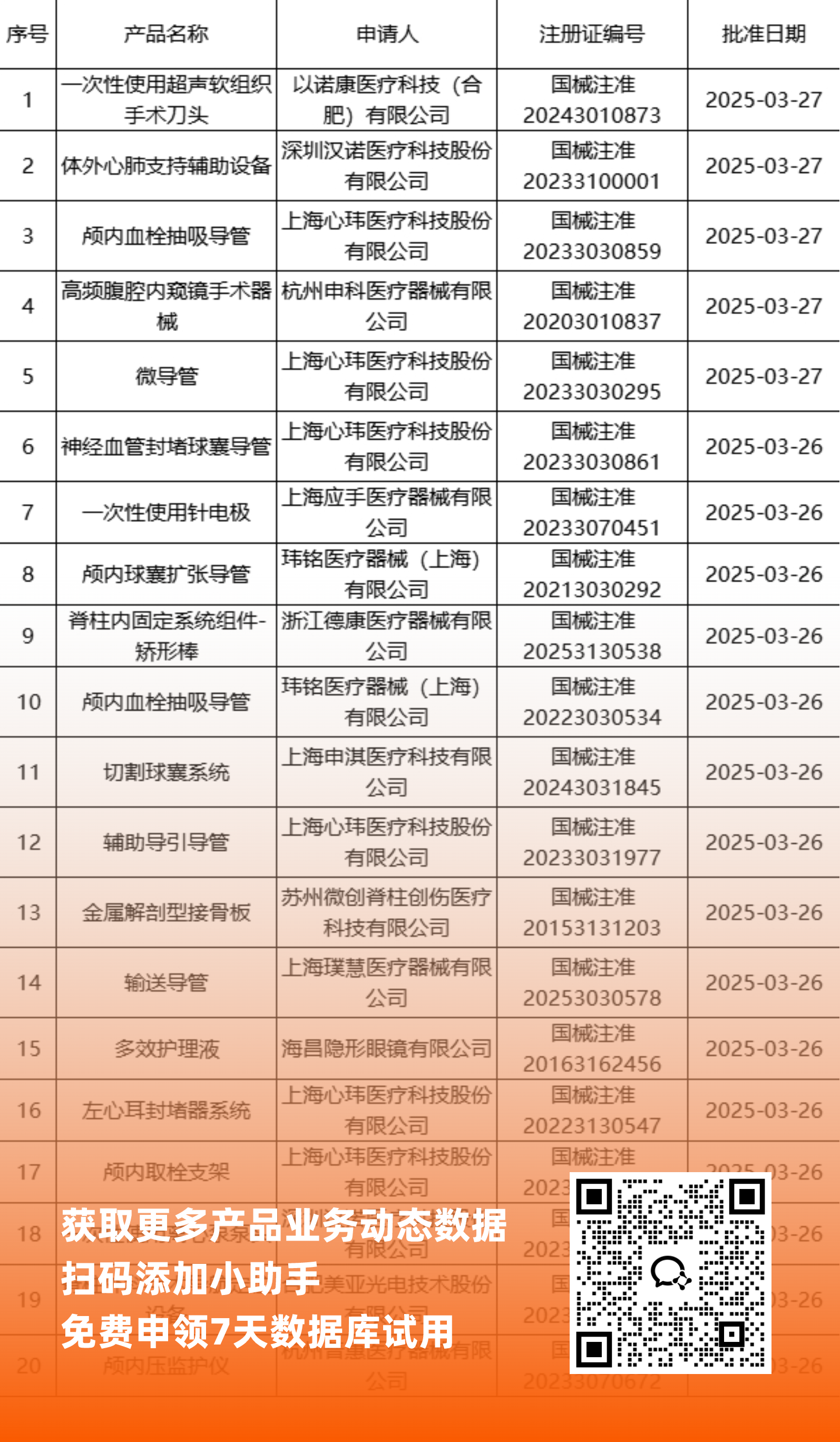
二、NMPA最新获批器械产品明细
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉智库仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。