
商务合作

动脉网APP
2025年4月4日至4月10日,动脉智库重点整理了医疗器械产品国内外获批资讯及数据,涉及6个器械获FDA批准,1个器械获欧盟及其它批准,5个器械获NMPA创新产品批准,另有201个器械获NMPA批准注册文件。
海外获批
一、FDA
1. 蔡司术中放疗机器人INTRABEAM 700获FDA批准上市
蔡司医疗技术公司是神经外科解决方案的领导者,其全新的术中放疗平台正在塑造现代肿瘤学的未来。该公司最近获得了INTRABEAM 700的FDA批准,这是一款尖端的平台,为术中放射治疗(IORT)提供机器人辅助的精准操作。凭借其数字化优先的架构,该平台为神经肿瘤学和乳腺癌治疗提供了高效的工作流程、无缝连接以及真正的附加价值。
2. Proprio获得全球首个AI手术指导平台的FDA认证
Proprio,一家在人工智能驱动的外科技术领域的领导者,宣布其人工智能引导平台Paradigm已获得FDA批准用于术中测量。该技术能够实现解剖结构的3D、动态和分段视图,使外科医生能够在手术过程中实时测量效果。Duke Health作为领先的医疗机构,已采用这项技术以推动外科创新并改善患者预后。在此批准之前,外科医生在手术过程中难以测量进展,通常依赖 X 光和 CT 扫描。
3. CardioVia宣布 ViaOne获得 FDA批准,开创微创心脏表面治疗新领域
CardioVia是一家专注于先进心脏护理的医疗设备公司,其ViaOne系统已获得FDA批准。该设备能够在不使用裸露针头的情况下安全、精确地接触到心脏表面,降低了当前技术相关的心脏穿孔风险。ViaOne有望为微创心脏手术树立新标准,提供一种优于传统方法的先进替代方案。在获得FDA批准之前,ViaOne因其在治疗复杂心律失常方面提供更有效治疗的潜力,已被FDA的突破性设备认定计划认可。
4. 组织再生公司Ventris Medical椎间盘Backpack®骨移植技术获FDA额外批准
Ventris Medical是一家私营的骨生物制品和组织再生公司,宣布FDA已授予Backpack® 510(k)许可。Backpack®是一类新型生物材料,用于促进骨科和脊柱融合手术中的细胞增殖和骨形成。它有两种版本:一种含有骨诱导性Allocell® AF纤维,另一种含有表面激活的Amplify®颗粒,两者均包裹在胶原蛋白网袋中。Allocell® AF同种移植物纤维具有类似支架的结构,可促进骨细胞附着和增殖,从而促进自然愈合。该移植物系统独特之处在于网袋和同种移植物纤维均参与骨重塑过程。
5. 医疗设备开发商ICU Medical宣布Plum Solo™和Plum Duo™精密静脉输液泵获FDA批准
ICU Medical Inc. 宣布其 Plum Solo™ 精密静脉输液泵获得 FDA 510(k) 认证,该产品是对双通道 Plum Duo™ 的补充,同时更新了 Plum Duo 精密静脉输液泵和 LifeShield™ 输液安全软件的版本。这些认证标志着 ICU Medical 新一代精密静脉输液泵类别的推出及其 IV Performance 平台的扩展。与传统输液泵不同,精密静脉输液泵旨在解决输液传输的差异性问题,并在实际条件下提供 ±3% 的精确度,消除输液不一致性。
6. T-SPOT被收购4年后,推出新一代自动化系统
生命科学公司Revvity宣布,其整合了奥盛生物Auto-Pure 2400全自动核酸纯化系统的T-SPOT.TB潜伏性结核检测方案正式获得美国食品药品监督管理局(FDA)批准。这是全球首款结合磁珠法细胞分离技术的自动化结核检测系统,标志着潜伏性结核筛查进入智能化新时代。
二、欧盟及其它
1. 首个无源冲击波球囊获批上市
LithiX作为首个无源冲击波球囊获CE批准上市,完成首批欧洲临床应用,颠覆传统IVL产品,无需主机即可碎石,简化手术流程,降低成本,具备广泛钙化病变处理能力,为医疗行业带来创新。
国内获批
一、创新器械获批
1. 经导管主动脉瓣膜系统获批上市
2025年4月9日,国家药品监督管理局批准了金仕生物科技(常熟)有限公司“经导管主动脉瓣膜系统 ”创新产品注册申请。该产品适用于经心脏团队评估无法耐受等待常规经导管主动脉瓣膜预装时间的患者,且经心脏团队结合评分系统评估后认为患有症状的、钙化的、重度退行性自体主动脉瓣狭窄,不适合接受常规外科手术置换瓣膜,年龄≥70岁的患者。该产品为预装式、可回收的经导管主动脉瓣膜系统,采用干瓣工艺制成,在提升临床使用便利性的同时,减少了瓣叶长期处于压缩状态导致的瓣叶变形风险。
2. 一体式人工血管术中支架系统获批上市
2025年4月9日,国家药品监督管理局批准了北京华脉泰科医疗器械股份有限公司 “一体式人工血管术中支架系统”创新产品注册申请。该产品适用于Standford A型主动脉夹层的升主动脉、主动脉弓部置换和降主动脉支架象鼻术,采用一体式远端免缝合固定技术,可缩短远端循环时间,减少可能发生的并发症。
3. 可降解耳鼻止血绵获批上市
2025年4月9日,国家药品监督管理局批准了合肥启灏医疗科技有限公司 “可降解耳鼻止血绵”创新产品注册申请。该产品为多聚醚型聚氨酯海绵,由(DL-丙交酯-co-ε-己内酯)-氨酯共聚物组成,具有多孔层状结构,对液体有一定的吸收容量,适用于鼻腔、中耳与外耳术后的暂时压迫止血与支撑。
4. 血流导向密网支架获批上市
2025年4月9日,国家药品监督管理局批准了江苏暖阳医疗器械有限公司“血流导向密网支架”创新产品注册申请。该产品适用于成人患者颈内动脉(岩骨段至末端)与椎动脉未破裂的囊状宽颈(瘤颈≥4mm或瘤体/瘤颈比<2)或梭形动脉瘤;载瘤血管直径2.0~6.0mm。该产品可完全推出微导管后再回收进微导管,支架与输送系统机械链接,通过释放手柄完成支架的机械解脱,实现支架的可控释放。
5. 人工韧带获批上市
2025年4月9日,国家药品监督管理局批准了北京万洁天元医疗器械股份有限公司“人工韧带”创新产品注册申请。该产品采用表面改性技术,在人工韧带与软组织接触部分接枝聚苯乙烯磺酸钠亲水涂层,与骨道接触部分通过矿化工艺涂覆羟基磷灰石涂层,植入后具有良好的固定效果。产品配合该公司不可吸收韧带固定螺钉,适用于补偿或加强损伤的膝关节交叉韧带。
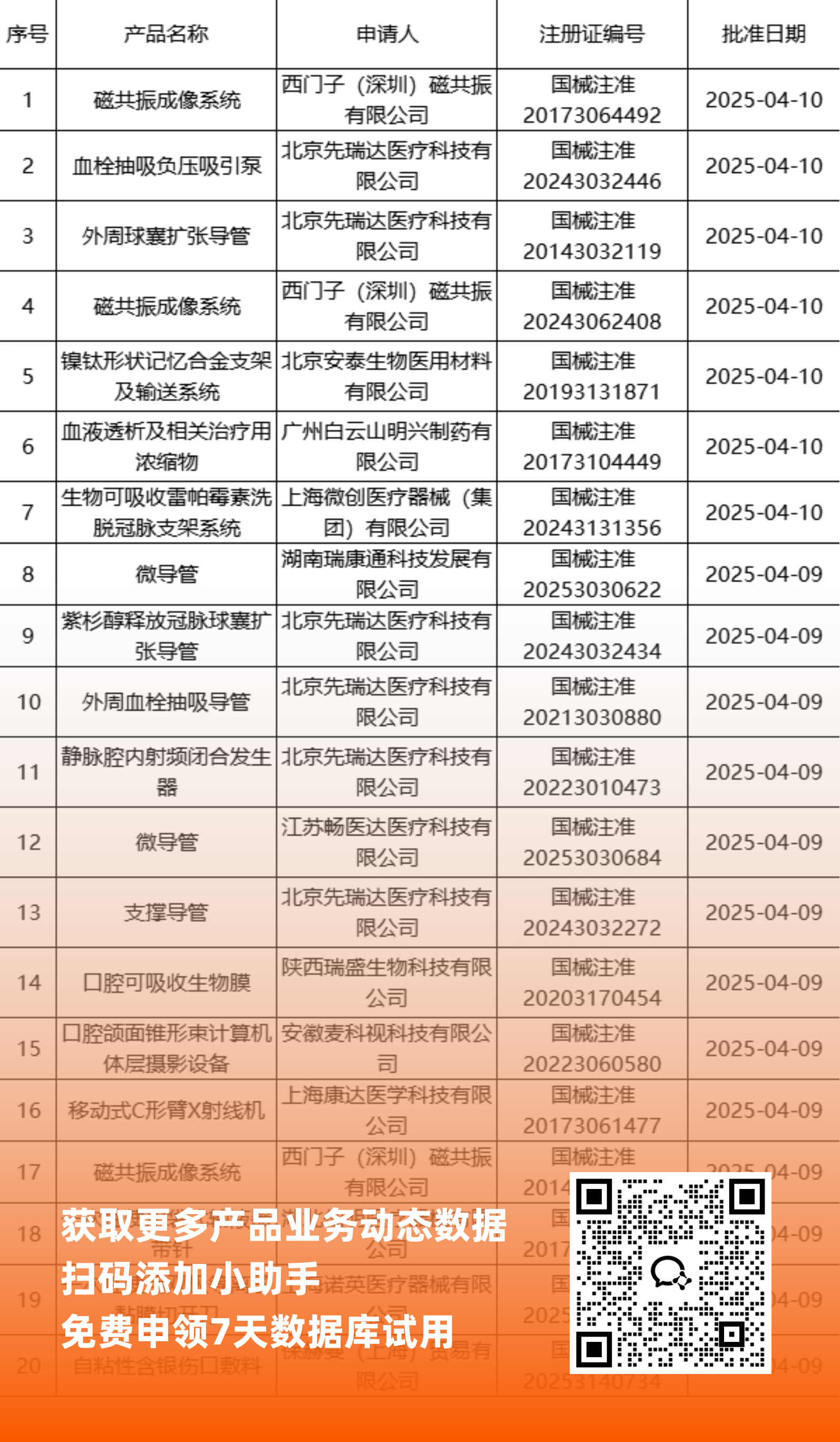
二、NMPA最新获批器械产品明细
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉智库仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。