
商务合作

动脉网APP
2025年4月11日至4月17日,动脉智库重点整理了医疗器械产品国内外获批资讯及数据,涉及9个器械获FDA批准,2个器械获欧盟及其它批准,2个器械获NMPA创新产品批准,另有360个器械获NMPA批准注册文件。
海外获批
一、FDA
1. 医疗科技公司Solo Pace Incorporated用于TAVR的SoloPace™临时起搏系统获FDA批准并首次用于人体
2025年4月17日,Solo Pace公司宣布其用于经导管主动脉瓣置换术(TAVR)手术中临时起搏的SoloPace控制系统已获得FDA批准,并已在首例人体病例中使用。该系统旨在提高TAVR临时起搏效率并降低患者风险,最初在斯克里普斯诊所的病例中应用。它具有针对操作者的特定协议、自动起搏捕获检查功能,并兼容所有常见的手术起搏方法,易于整合到当前医疗实践中。直观的界面和无菌遥控操作旨在减少沟通错误,而系统预编程起搏设置的功能简化了TAVR手术过程,减轻了医生和工作人员的工作负担。
2. FDA批准了WiSE®系统,这是世界上首个且唯一的无导线左心室心内膜起搏(LVEP)心脏再同步治疗(CRT)设备
EBR Systems公司获得了美国食品药品监督管理局(FDA)对其WiSE®系统的批准,这标志着心力衰竭治疗领域的一个重大进展。WiSE系统是首个实现无导线左心室心内膜起搏(LVEP)的系统,与心脏的自然传导路径相一致。这种生理性的再同步方法为无法使用基于导线设备或难以获得传统CRT疗法的患者提供了一种新的治疗选择。主要研究者尼拉吉·瓦尔玛描述WiSE系统为一款改变游戏规则的技术,消除了传统CRT的局限性,并扩大了因解剖结构或导线故障而此前无法治疗患者的可及性。
3. 医学突破,Terumo Neuro首款双层颈动脉支架获FDA批准,引领治疗新方向
Terumo Neuro的前身为MicroVention,现推出首款获FDA批准的双层颈动脉支架,其双层微网设计可降低脑栓塞风险,为颈动脉疾病治疗带来新突破。
4. 心脏成像技术开发商LUMA Vision宣布VERAFEYE 2D/4D心脏可视化平台获FDA批准
LUMA Vision Ltd. 宣布其 VERAFEYE™ 可视化平台获得 FDA 批准,这是一种基于导管的成像系统,可提供实时、二维和四维、360 度可视化功能。该技术显著提升了临床医生在复杂电生理和结构性心脏手术中的精确度和信心。该系统结合了前沿成像技术与数字化操控能力,能够捕捉高度细致、实时的四维图像,从而实现动态高分辨率的心脏导航和可视化。这对于使用各种技术进行高级手术至关重要。与传统的二维成像导管不同,VERAFEYE 能够实现增强深度和清晰度的全面 360 度可视化。
5. 医疗黑科技,全球首个AI手术引导平台获得FDA批准
CCI创新快讯:Proprio公司的AI手术引导平台Paradigm获FDA批准,标志AI在医疗领域应用达新高度。该平台利用AI、AR技术,实现实时3D医学成像,提高手术精准度。
6. Ventrax:经主动脉电生理消融逆行输送系统获批上市
麦瑞通推出新型左心室消融逆行输送系统Ventrax,获美国上市批准。该系统简化逆行主动脉入路,实现精准治疗,提升心脏介入治疗效果,为室性心动过速治疗提供重要工具。
7. Turbett Surgical获得FDA 510(k)许可,增强其器械舱产品组合
Turbett Surgical的Instrument Pods增强系列,包括TS1500、TS1200和TS1000,已获得FDA 510(k)许可。该许可支持了Turbett在手术器械管理方面对创新、安全和性能的承诺,并通过新验证的功能声明,如TS1200的承重能力提升至300磅以及扩展的管腔验证以实现更好的手术器械处理,进一步强化了这一点。
8. 直觉医疗首款单孔机器人吻合器获批FDA
直觉医疗的首款单孔机器人吻合器SureForm 45获FDA批准,配备SmartFire技术,可实时监测组织压缩、优化缝钉线、降低损伤风险,提高手术安全性和效果。
9. Halozyme宣布FDA批准Argenx的VYVGART® Hytrulo预充式注射器,该注射器与ENHANZE®共同配制,用于全身性重症肌无力和慢性炎症性脱髓鞘多发性神经病的自我注射
Halozyme Therapeutics, Inc. 宣布,Argenx 已获得 FDA 批准的 VYVGART® Hytrulo 预充注射器,用于自我注射,适用于患有全身性重症肌无力(gMG)和慢性炎性脱髓鞘性多发性神经病(CIDP)的成年患者。这种皮下注射仅需 20 到 30 秒,可由患者、护理人员或医疗专业人员进行。该预充注射器采用了 Halozyme 的 ENHANZE® 药物递送技术,能够快速、大容量地递送生物制剂。FDA 的批准代表了重大进展,使患者能够自行给药,并可能减轻患者的治疗负担。
二、欧盟及其它
1. 加拿大卫生部批准了NanoSpeed的维生素D检测方法
加拿大卫生部已批准 NanoSpeed Diagnostics 的 Test4D 血清测试,这是一种旨在测量血清中维生素 D 水平的检测方法。此次批准是在该公司位于加拿大的生产设施获得 ISO 13485 MDSAP 认证之后进行的。该测试声称利用 NanoSpeed 的技术对维生素 D 缺乏进行定性和定量评估,最初于 2013 年推出,是首个用于此目的的即时检测。此次批准为该测试增添了其已获得的欧盟 CE 认证。维生素 D 缺乏在加拿大是一个普遍问题,与多种健康问题相关,例如骨骼代谢受损、心血管疾病、糖尿病和某些癌症。
2. 爱德华全球首款经股静脉经导管二尖瓣置换系统
爱德华生命科学的SAPIEN M3经导管二尖瓣置换系统获CE认证,成为全球首款经股静脉治疗二尖瓣反流的系统。该系统适用于中重度或重度二尖瓣反流患者,为二尖瓣反流治疗提供新手段。
国内获批
一、创新器械获批
1. 血管外植入式心脏除颤电极导线和血管外植入式心脏除颤电极导线导入器获批上市
2025年4月17日,国家药品监督管理局批准了美敦力公司的“血管外植入式心脏除颤电极导线”和“血管外植入式心脏除颤电极导线导入器”两个创新产品注册申请。血管外植入式心脏除颤电极导线由电极导线、固定套管和分析仪电缆接口工具组成。血管外植入式心脏除颤电极导线导入器由胸骨下导入器和皮下导入器组成,胸骨下导入器包含手柄、不锈钢穿隧杆、体外导杆,皮下导入器包含手柄、穿隧杆。上述两个产品配套使用,与血管外植入式心律转复除颤器组合构成血管外植入式心律转复除颤器系统,放置在胸骨下,对发生或可能发生危及生命的室性心动过速的重大风险患者进行自动治疗。该产品具有心脏和血管外抗心动过速起搏和停搏预防起搏功能,可减少经静脉导线引起的相关并发症,更好满足患者临床1.5T和3.0T场强的磁共振成像检查需求。
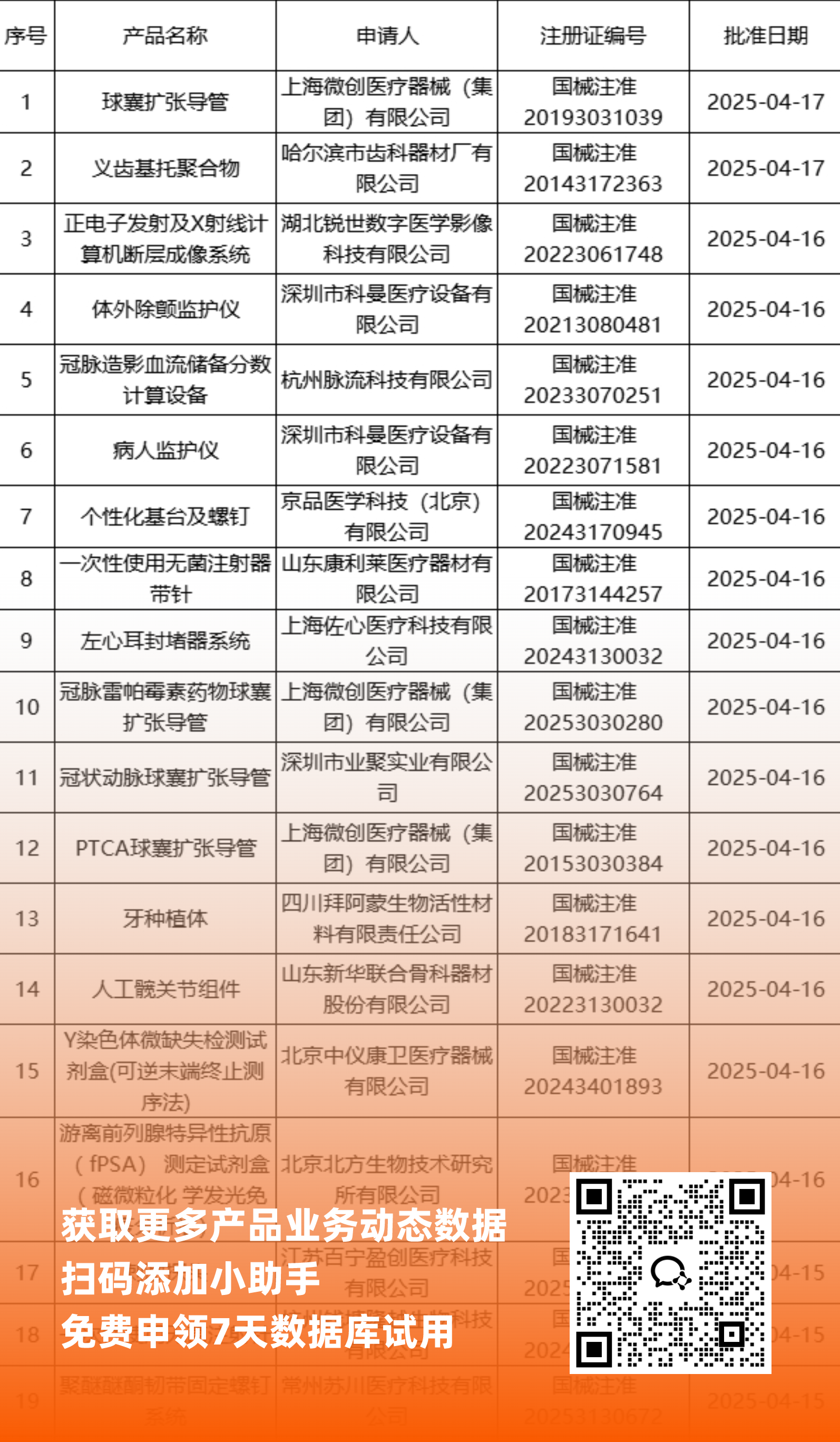
二、NMPA最新获批器械产品明细
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉智库仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。