
商务合作

动脉网APP
2025年5月9日至5月15日,动脉智库重点整理了医疗器械产品国内外获批资讯及数据,涉及5个器械获FDA批准,1个器械获欧盟及其它批准,3个器械获NMPA创新产品批准,另有453个器械获NMPA批准注册文件。
海外获批
一、FDA
1. Element Science可穿戴除颤器贴片获批
Element Science的可穿戴除颤器贴片获得FDA批准,该非侵入式设备为心脏骤停高风险患者提供创新解决方案,临床试验显示成功检测并矫正危险心律,且公司已获1.45亿美元融资。
2. 罗氏肺癌检测新品获FDA批准上市
罗氏宣布,其 Ventana MET (SP44) RxDx 测定已获得美国食品药品管理局批准,可作为伴随诊断,用于确定哪些肺癌患者适合接受 AbbVie 的 Emrelis (telisotuzumab vedotin-tllv) 治疗。该测定可检测 MET 蛋白,这种蛋白在某些非鳞状非小细胞肺癌患者中过度表达,可作为预测患者对 Emrelis 等靶向治疗反应似然性的生物标志物。罗氏在一份声明中指出,免疫组织化学测定由病理学家根据染色肿瘤细胞的比例和染色强度进行评分。
3. 足踝外科产品开发商Medline UNITE足踝外科创新解决方案REFLEX® HYBRID镍钛合金植入系统获批FDA
Medline UNITE的REFLEX® HYBRID镍钛合金植入系统获FDA批准,结合动态压缩与锁定板稳定性,专为足踝外科手术设计,具有术中调整、术前压缩功能,适应多种骨质,临床测试表现优异,填补市场空白。
4. 联影医疗首款介入性X射线系统现获得FDA批准
全球医疗影像技术制造商联影医疗宣布,其首款介入X射线系统uAngio AVIVA已获得FDA批准。这款悬吊式系统集成了智能机器人、语音控制和先进成像功能,旨在协助介入室中的临床工作人员。通过智能语音辅助和3D视觉功能,该系统实现了免手操作的图像查看与移动辅助,使医务人员能够专注于患者。系统的8轴机器人提供了卓越的灵活性,可覆盖整个手术室并实现便捷操作。此外,uVERA IQ成像技术利用人工智能算法提供高质量图像,优化工作流程并提升用户体验。
5. 初创公司Teal Health获得FDA批准,推出家用宫颈癌筛查测试
美国食品和药物管理局批准了首个家用宫颈癌筛查测试,该测试由Teal Health公司开发。这款名为Teal Wand的设备,使用方式类似于卫生棉条置入器,用户可以在家中自行进行测试。在临床试验显示其精确度与医生在诊室进行的筛查相当(准确率达96%)后,FDA将其指定为突破性设备。Teal计划于六月首先在加州推出该设备,并正在商讨将这项测试作为预防性筛查的保险覆盖事宜。
二、欧盟及其它
1. 医疗可穿戴设备研发商Rethink Medical带开关的导尿管获批上市
T-Control导尿管获CE批准上市,其独特设计允许患者自主控制尿流,减少感染风险,提升生活质量,并优化护理流程,是导尿管领域的一大创新。
国内获批
一、创新器械获批
1. 经导管瓣中瓣系统获批上市
2025年5月14日,国家药品监督管理局批准了北京佰仁医疗科技股份有限公司经导管瓣中瓣系统创新产品注册申请。该产品由生物瓣膜、输送器、球囊扩张导管、导管鞘套件、压握器、充压泵组成。生物瓣膜由牛心包瓣叶、钴铬合金瓣架、PET包覆物、缝线(PET、PTFE)组成。该产品适用于因先前置入的外科生物二尖瓣瓣膜衰败(狭窄、反流或二者均存在)导致的症状性心脏病,且经心脏团队结合评分系统评估为外科手术高风险或不适合接受常规外科手术的患者,进行经心尖的二尖瓣瓣膜置换。
2. 含镁可降解高分子骨修复材料获批上市
2025年5月14日,国家药品监督管理局批准了深圳中科精诚医学科技有限公司含镁可降解高分子骨修复材料创新产品注册申请。该产品由丙交脂-乙交脂共聚物(PLGA)、β-磷酸三钙(β-TCP)、金属镁(Mg)组成,采用低温增材制造技术及后处理制备而成。该产品适用于不影响骨结构稳定性的四肢骨缺损的填充和修复。
3. 主动脉弓支架系统获批上市
2025年5月15日,国家药品监督管理局批准了先健科技(深圳)有限公司主动脉弓支架系统创新产品注册申请。该产品包括主动脉弓主体支架系统和主动脉弓分支支架系统,与同公司主动脉覆膜支架破膜系统配合使用,适用于治疗需要重建左锁骨下动脉血运的Stanford B型夹层患者。
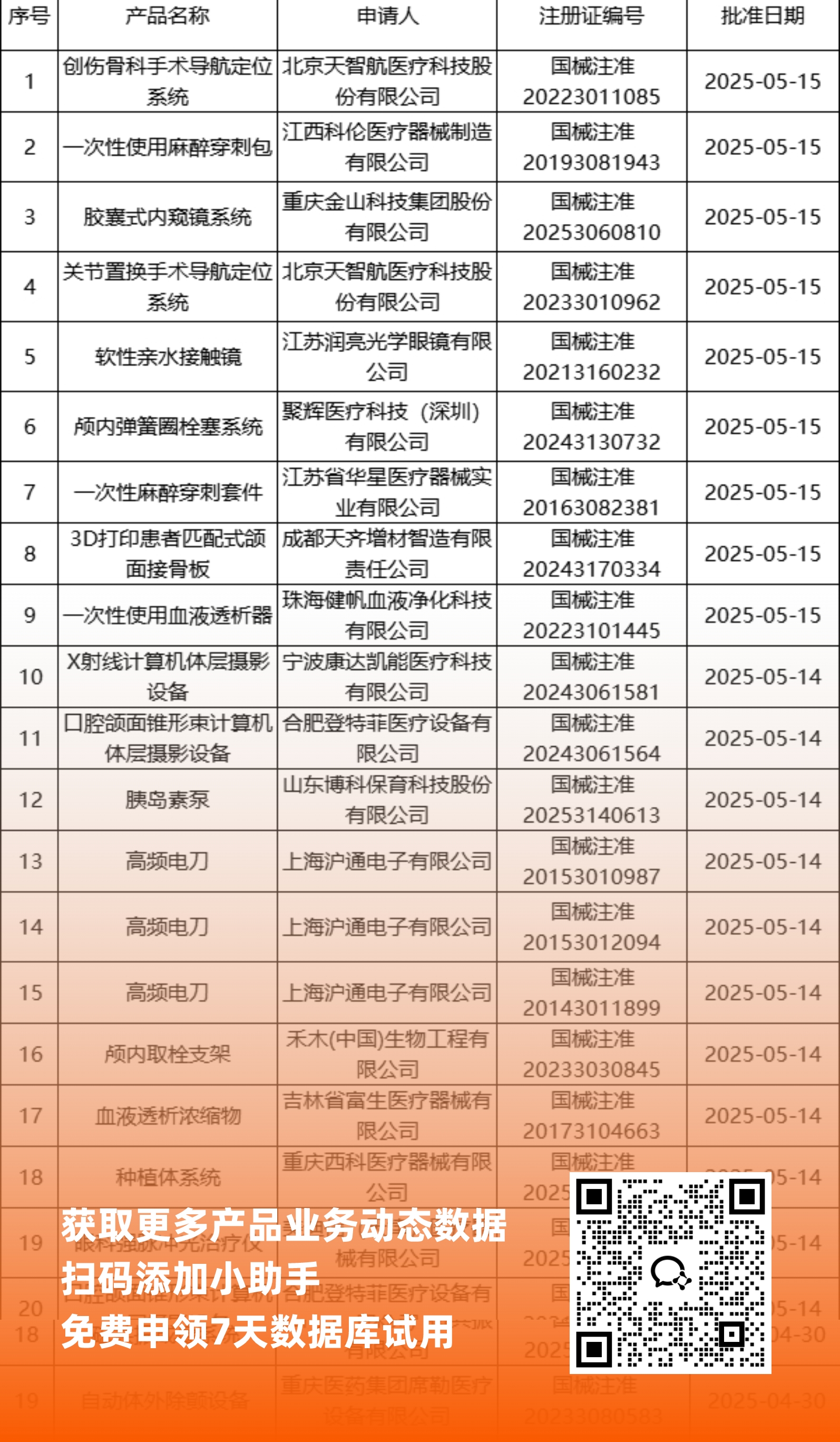
二、NMPA最新获批器械产品明细
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉智库仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。