
商务合作

动脉网APP
2025年5月16日至5月22日,动脉智库重点整理了医疗器械产品国内外获批资讯及数据,涉及6个器械获FDA批准,2个器械获欧盟及其它批准,另有276个器械获NMPA批准注册文件。
海外获批
一、FDA
1. 血液透析解决方案提供商Phraxis宣布用于血管内静脉吻合的EndoForce™连接器获FDA批准,推进透析通路创新
明尼阿波利斯的医疗设备公司Phraxis Inc.取得了重要里程碑,其用于血管内静脉吻合的EndoForce™连接器获得了FDA批准。该专利血管内植入物旨在简化和现代化血液透析用动静脉移植物(AVGs)的创建,无需手术解剖,并促进血管与移植物的精确对齐。它旨在减少组织损伤、优化操作流程并提高移植物的长期性能。该设备兼容标准的6毫米ePTFE AVG,包含锚定倒钩、柔性镍钛诺段和可压缩部分。这种新颖的方法解决了血管通路中的关键挑战,并有望改善透析患者的治疗效果。
2. 史赛克OptaBlate® BVN基椎体神经消融系统获得FDA批准
史赛克(Stryker),作为全球医疗技术领域的领导者,宣布其OptaBlate基椎神经消融系统(OptaBlate BVN)已获得美国食品药品监督管理局(FDA)的510(k)许可。该系统通过靶向基椎神经,为慢性椎源性下背痛患者提供持久缓解。这种微创手术扩展了史赛克的疼痛治疗解决方案,结合了其在射频消融技术和椎体通路方面的专长。脊柱外科医生贾德·哈利勒博士表示,该系统为那些尝试多种治疗却未能获得持久缓解的患者提供了显著改善,并有助于避免更具侵入性的治疗方式,例如手术。其主要特点包括在7分钟内实现至少1厘米的损伤范围。
3. 国内首个全球双认证的射频产品
威脉医疗的YOUMAGIC高能射频治疗仪获FDA和NMPA认证,标志中国医械全球化突破。产品具独家闪脉冲技术,提供个性化能量选择,将拓展全球市场,传递中国科技与美学能量。
4. FDA批准Fujirebio公司阿尔茨海默(AD)血液产品
FDA批准首个通过血液检测辅助诊断阿尔茨海默病的体外诊断试剂上市:Fujirebio公司Lumipulse®G pTau 217/β-淀粉样蛋白1-42血浆比值体外诊断(IVD)检测,用于评估阿尔茨海默病(AD)和其他认知能力下降原因患者中的淀粉样病理情况。该检测曾获FDA“突破性器械”认定,是美国首个获批的、用于帮助识别与阿尔茨海默病相关淀粉样病理的血液体外诊断测试。
5. 骨科产品开发商Trax Surgical镍钛合金缝合钉系统获得FDA 510(k)批准
2025年5月19日,骨科产品公司Trax Surgical宣布其LINKT™压缩钉系统获得了FDA 510(k)许可,可以上市销售。该系统由镍钛诺植入物和部署工具组成,提供了一系列用于骨折修复、关节融合和截骨手术的镍钛诺钉。这些钉子技术上更易于操作且应用更快,为骨骼愈合创造了稳定的环境。这一进步使Trax Surgical能够更好地服务客户,并提升了四肢骨科护理的标准,体现了公司对创新、质量和满足外科医生与患者需求的承诺。LINKT系统通过其可调节的插入器改进了过时的设计,允许外科医生在植入前调整钉子的支脚。
6. 罗氏VENTANA MET (SP44) RxDx检测获FDA批准
罗氏VENTANA MET (SP44) RxDx检测获FDA批准,用于评估非鳞状非小细胞肺癌患者MET蛋白表达,指导c-Met靶向疗法,提高精准医疗可能性。
二、欧盟及其它
1. 美敦力 Evolut TAVR瓣膜获关键批准
美敦力Evolut TAVR瓣膜获欧洲CE标志批准,可用于Redo-TAVR,为患者提供新治疗选择,体现美敦力对推进患者护理和扩大治疗选择的承诺。该平台现已获批用于所有风险类别的有症状严重主动脉瓣狭窄患者。
2. 心脉医疗™Minos®腹主动脉支架在埃及获批上市,开辟非洲市场
心脉医疗自研的Minos®腹主动脉支架在埃及获批上市,标志其全球业务版图拓展的突破性进展,该产品已在全球25国应用。
国内获批
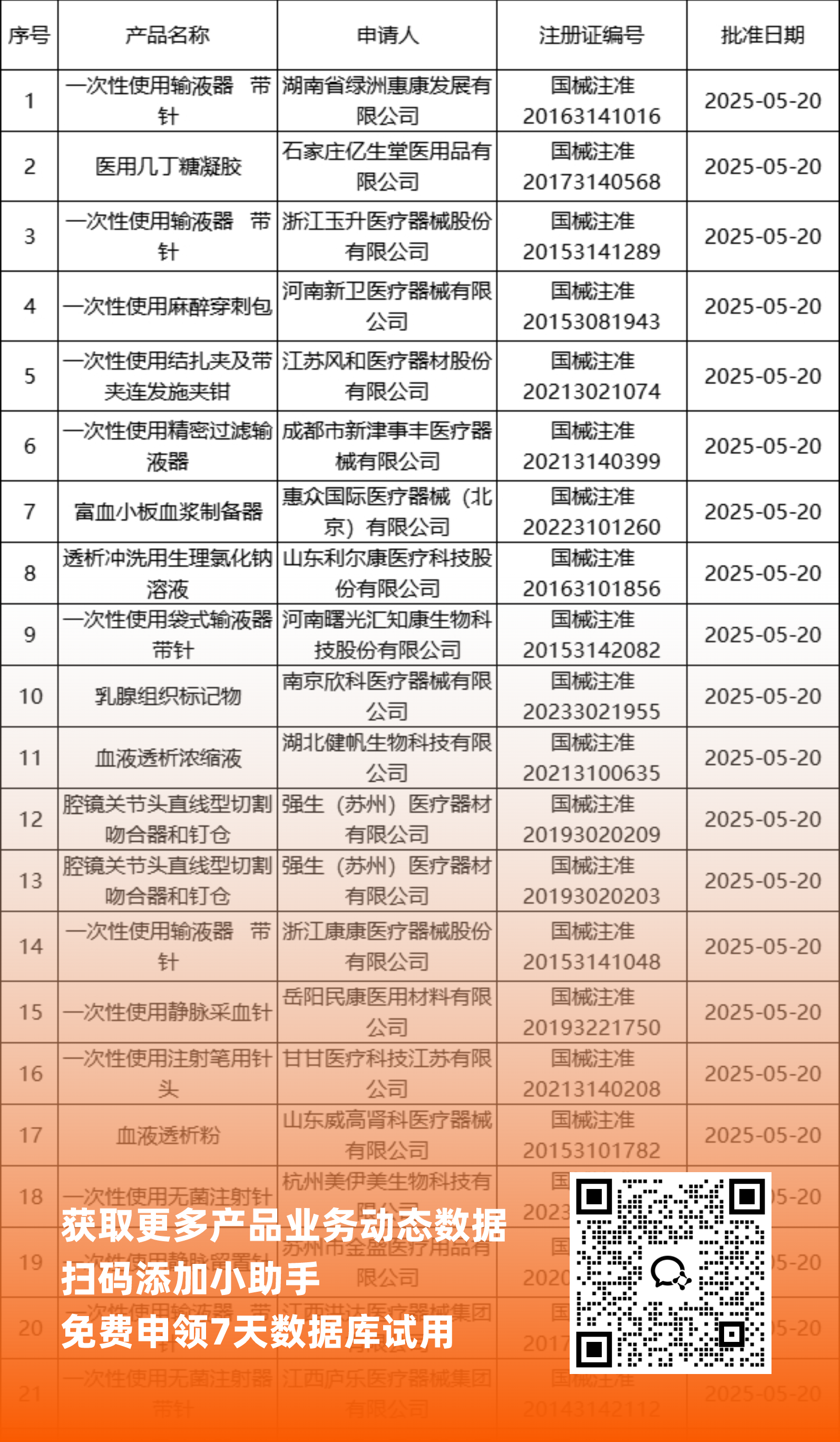
NMPA最新获批器械产品明细
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉智库仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。