
商务合作

动脉网APP
2025年5月23日至5月29日,动脉智库重点整理了医疗器械产品国内外获批资讯及数据,涉及8个器械获FDA批准,3个器械获欧盟及其它批准,1个器械获NMPA创新产品批准,另有414个器械获NMPA批准注册文件。
海外获批
一、FDA
1. Hyperfine宣布Optive AI™软件获得FDA批准,为Swoop®系统带来前所未有的最大图像质量提升
Hyperfine, Inc.是一家健康技术公司,近日宣布其下一代Swoop®系统软件获得FDA批准,该系统是全球首个获FDA批准的AI驱动便携式脑部MRI系统。全新的Optive AI™ 软件显著提升了超低场MRI成像的图像质量,提供更高的清晰度、均匀性和解剖细节。部分临床站点的早期用户对这些改进给予了积极反馈,一些用户表示图像质量接近传统的1.5特斯拉MRI扫描仪。
2. 奥林巴斯宣布其最先进的成像内窥镜获得FDA批准
奥林巴斯是一家全球医疗技术公司,近日宣布其EZ1500系列内窥镜获得FDA 510(k)许可,该系列采用扩展景深(EDOF™)技术。GIF-EZ1500胃镜和CF-EZ1500DL/I结肠镜是EVIS X1™内窥镜系统的最新成员,提供先进的成像和创新功能。EDOF技术使医生能够以最少的焦距调整捕获清晰图像,保持病灶聚焦,可能有助于检测胃肠道问题。这项技术通过将光线分为近焦和远焦光束,然后将其合并为一个具有宽景深的图像,从而实现比之前奥林巴斯内窥镜更好的可见性和更少的模糊。
3. Tendyne:FDA批准首款经导管二尖瓣置换瓣膜上市
雅培的经导管二尖瓣置换瓣膜Tendyne获FDA批准上市,为严重二尖瓣环钙化患者提供微创治疗方案,填补治疗空白。Tendyne由镍钛合金双层D型支架、三叶牛心包瓣膜等组成,已在欧洲上市并早于竞争对手爱德华的SAPIEN M3。
4. 磁控胶囊内窥镜开发商AnX Robotica下一代胃肠道动力监测解决方案获得FDA 510(k)许可
AnX Robotica,胃肠道诊断领域的领导者,宣布其MotiliCap™及其配套软件MotiliScan™已获得FDA 510(k)许可。这一许可标志着胃肠道动力监测的重大进步,为临床医生提供了一种无创工具,能够精确且舒适地评估全肠道通过时间。MotiliCap取代了已停产的SmartPill™,在无需辐射或镇静的情况下,提供有关胃排空、小肠通过时间和结肠动力的详细信息。数据导出至MotiliScan进行可视化和分析,使临床医生能够更快、更准确地获得诊断见解。
5. FDA批准了第一款AD血液诊断产品
FDA批准首款用于辅助诊断阿尔茨海默病的体外诊断设备,基于LumipulseG平台的血浆比值检测,针对55岁及以上人群,具有技术突破与市场潜力。
6. 获批FDA,史赛克射频消融系统
史赛克的OptaBlate基椎神经消融系统获得FDA批准,该系统结合射频消融和脊柱精准通道技术,可快速定位消融基椎神经,为慢性腰痛患者提供微创手术治疗,临床试验显示显著减轻疼痛并改善活动能力。
7. 脊柱手术机器人系统研发商Lem Surgical用于硬组织手术的多臂机器人获得FDA许可
美国食品药品监督管理局 (FDA) 已授予LEM Surgical公司的Dynamis机器人手术系统510(k)许可,这标志着机器人辅助硬组织手术的一个重要里程碑。该系统是一个基于导航集成的机器人平台,旨在提高脊柱手术中的精确性和控制力,结合了实时成像、动态引导和适应性强的器械兼容性。首席执行官约西·巴尔表示,推出全球首个用于硬组织手术的多臂手术机器人令他深感自豪,这也使LEM Surgical有望引领下一代智能手术机器人的发展。该系统配备了三个机械臂,可支持多种手术器械。
8. 血液透析解决方案提供商Phraxis宣布用于血管内静脉吻合的EndoForce™连接器获FDA批准,推进透析通路创新
明尼阿波利斯的医疗设备公司Phraxis Inc.取得了重要里程碑,其用于血管内静脉吻合的EndoForce™连接器获得了FDA批准。该专利血管内植入物旨在简化和现代化血液透析用动静脉移植物(AVGs)的创建,无需手术解剖,并促进血管与移植物的精确对齐。它旨在减少组织损伤、优化操作流程并提高移植物的长期性能。该设备兼容标准的6毫米ePTFE AVG,包含锚定倒钩、柔性镍钛诺段和可压缩部分。这种新颖的方法解决了血管通路中的关键挑战,并有望改善透析患者的治疗效果。
二、欧盟及其它
1. Illumina获得日本监管机构批准的全面基因组分析测定
Illumina于周二宣布,其TruSight Oncology(TSO)全面癌症基因组分析检测已获得日本监管机构的批准。该检测被日本厚生劳动省批准为III/IV类医疗器械,能够检测500多个基因的变异,并报告肿瘤突变负荷(TMB)评分。Illumina表示,这一批准将扩大日本患者的精准肿瘤学选择,有助于治疗方案的选择和临床试验的入组。Illumina日本总经理Catherine Ohura强调了基因组学在肿瘤学结果中的重要性,并表示公司致力于与政府、患者及医学界合作,将基因组学整合到日本的标准癌症护理中。此前,Illumina于2022年获得了TSO检测版本的CE认证,并于2024年8月获得美国FDA的伴随诊断批准。
2. 医疗设备公司ReGelTec用于椎间盘增强的水凝胶器械HYDRAFIL获CE批准上市
HYDRAFIL,一种温敏型水凝胶,获批上市为慢性腰痛提供新疗法,可微创手术植入,减轻疼痛并改善功能,填补现有治疗空白,有望降低医疗成本。
3. 美敦力Evolut TAVR瓣膜获关键批准
美敦力Evolut TAVR瓣膜获欧洲CE标志批准,可用于Redo-TAVR,为患者提供新治疗选择,体现美敦力对推进患者护理和扩大治疗选择的承诺。该平台现已获批用于所有风险类别的有症状严重主动脉瓣狭窄患者。
国内获批
一、创新器械获批
1. 经导管二尖瓣修复系统获批上市
2025年5月27日,国家药品监督管理局批准了科凯(南通)生命科学有限公司经导管二尖瓣修复系统创新产品注册申请。该产品由夹合器及输送系统、导管鞘组件组成。夹合器及输送系统由夹合器、植入导管和可操控套管组成。导管鞘组件由导管鞘和扩张器组成,导管鞘包括可调弯鞘和手柄。该产品采用经皮方式,适用于经心脏团队评估后认为存在外科手术高风险,且二尖瓣瓣膜解剖结构适合的退行性二尖瓣反流(MR≥3+)患者。
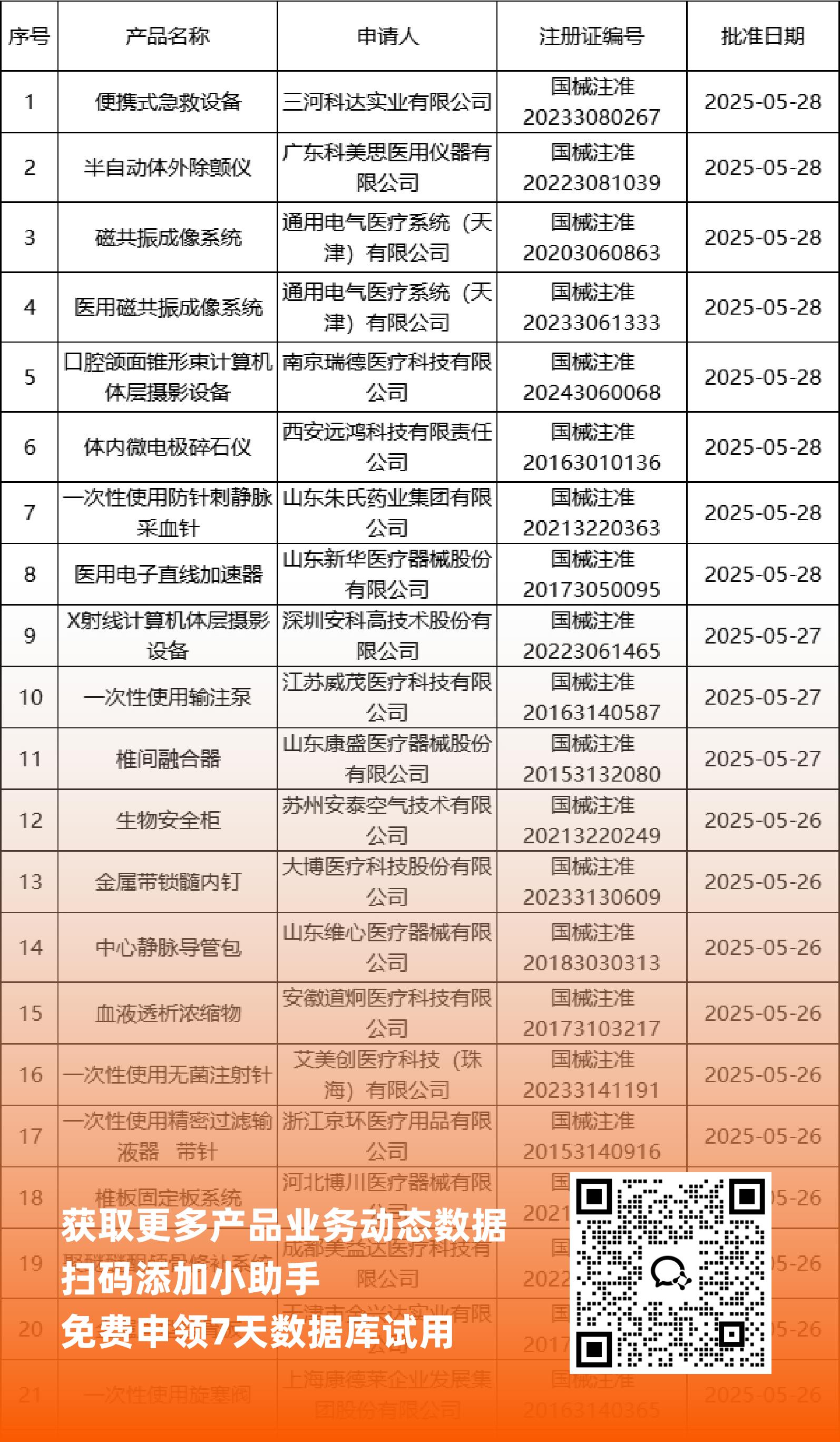
二、NMPA最新获批器械产品明细
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉智库仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。