
商务合作

动脉网APP
2025年6月13日至6月19日,动脉智库重点整理了医疗器械产品国内外获批资讯及数据,涉及9个器械获FDA批准,7个器械获欧盟及其它批准,另有266个器械获NMPA批准注册文件。
海外获批
一、FDA
1. 高性能手持式超声平台和AI开发商Exo两款AI肺病超声应用获得FDA批准
成像初创公司Exo已获得FDA批准,其两款基于人工智能的应用可通过Exo Iris床旁超声设备检测胸腔积液以及实变/肺不张。这些应用专为非专家用户设计,操作简单,且无需互联网或云连接即可运行。这些应用检测到的病症是感染的关键指标,可能危及生命。GlobalData预测,到2034年,POCUS市场将达到434亿美元。
2. 脊柱公司Expanding Innovations宣布N-GAGE™腰椎板系统获得FDA批准
Expanding Innovations™,一家快速增长的脊柱公司,专注于非螺钉基础的可扩展技术,宣布其N-GAGE™腰椎板系统已获得美国FDA 510(k)许可,这是该公司的首个脊柱固定平台。这款低轮廓、模块化的结构为侧向和前外侧腰椎融合术提供了灵活的固定解决方案,并通过非螺钉基础的多轴耦合器,与X-PAC® LLIF可扩展椎间融合器系统独特结合。这一里程碑反映了EI致力于解决脊柱手术中的挑战,并从基于产品技术的公司转型为完整的手术解决方案提供商。
3. 国产神外自主手术导航机器人获FDA批准上市
钛隼生物科技的自主手术导航机器人NaoTrac获FDA批准上市,这是继TFDA和CE批准上市之后又一个里程碑。NaoTrac是一个专为神经外科手术设计的智能机器人,通过人工智能、机器视觉与机器人辅助手术技术优化手术流程、缩短学习曲线,从而提升手术精确性和安全性,缩短手术时间和患者的恢复时间。
4. 国产首款DSA设备获得美国FDA 510(k)认证
联影医疗自主研发的DSA设备uAngio AVIVA CX获得美国FDA 510(k)认证,标志我国首款DSA设备进入美国市场,提升国际竞争力。
5. 眼科健康解决方案开发商OcuSciences线粒体功能型眼底影像设备获批FDA
2025年6月18日获悉,眼科健康解决方案OcuSciences宣布其非侵入式功能成像设备OcuMet Beacon正式通过美国FDA 510(k)审批。这意味着,医生有望首次在门诊中以无创方式“看见线粒体功能状态”,让视网膜代谢异常从隐性病灶变为可量化指标,也让功能型眼底影像真正走上临床舞台。OcuSciences计划通过与顶级眼科中心和医疗机构的合作,推动OcuMet Beacon在美国市场的推广,并计划在2025年第二季度开始设备的首批部署。OcuMet Beacon基于光学代谢成像(OMI)技术,通过检测视网膜对特定波长激发光的荧光寿命反应,间接评估线粒体功能状态。与传统OCT等结构成像不同,它提供的是组织代谢活动的实时指标。对于主打结构影像的传统企业而言,该产品的获批意味着技术评价体系正从“成像清晰度”转向“代谢状态可读性”。
6. 外周血管治疗公司Inquis Medical新一代机械血栓切除系统获批FDA
Inquis Medical的Aventus机械血栓切除系统获FDA批准,用于治疗肺栓塞。该系统采用组织感应技术,可精准、安全清除大血栓并降低手术复杂度和风险。肺动脉栓塞是高度致死的急症,机械性血栓切除因无需高剂量溶栓药、快速恢复血流而受重视。
7. BTK治疗革命性装置Spur外周可回收支架已获FDA批准上市
Reflow Medical推出的可回收支架Spur获FDA批准,为膝下动脉疾病提供新治疗方案,避免长期异物留存问题。
8. NEUROMARK:新型的慢性鼻炎消融导管获批上市
NEUROMARK,新型慢性鼻炎消融导管,获FDA批准上市。其操控性、治疗确认机制提升,实时反馈、精准定位、治疗确认三大创新,使鼻炎治疗更简单、快速、有效。
9. 基因组诊断公司Genes2Me一体化分子诊断系统OnePCR获得FDA批准,进入美国市场
Genes2Me的OnePCR一体化分子诊断系统获FDA批准,可在美销售,该系统整合了检测卡盒技术,可快速检测多个靶标。
二、欧盟及其它
1. 加拿大卫生部批准——Zilia Ocular:有望彻底改变眼科护理的全球首创技术
加拿大健康技术公司Zilia宣布,其旗舰产品Zilia Ocular™已获得加拿大卫生部的批准。Zilia Ocular是全球首个获授权测量眼部氧饱和度的设备,可能重新定义眼科护理。这款视网膜相机在魁北克市开发,采用专利光学技术,能够以非侵入方式测量眼部氧合水平,为眼科专业人士提供关于眼睛生理状态和早期问题检测的新视角。
2. 医疗器械研发商Anaconda Biomed新一代漏斗状取栓导管获CE批准上市
ANA5是ANACONDA Biomed的新一代漏斗状取栓导管,已获CE批准上市。其基于完整证据体系,包括临床前试验及ANAIS研究数据,证实具有高再灌注率和首次通过成功率。ANA5的独特漏斗型设计可优化机械取栓,提升血栓捕获与清除效率。此外,正在美国推进IDE临床研究,为美国上市奠定基础。
3. 奥精医疗人工骨产品越南获批
奥精医疗的SkuHeal™人工骨修复材料在越南获批,该产品已在多国获批并广泛应用于神经外科骨缺损修复。
4. 雅培i-STAT TBI测试用于疑似脑震荡获加拿大卫生部批准
加拿大卫生部已批准雅培的i-STAT TBI测试卡,该测试卡允许临床医生使用全血更有效地评估疑似脑震荡,并在15分钟内获得实验室质量的结果。这一批准将检测的可能性扩展到各种医疗环境,可能包括药房、无放射科的诊所和体育赛事场边。i-STAT TBI测试专为18岁及以上疑似轻度创伤性脑损伤(mTBI)的人群设计,可帮助确定是否需要进行头部CT扫描并指导后续护理步骤。
5. 维力医疗收到加拿大医疗器械产品注册证
维力医疗(603309.SH)宣布,其尿道扩张器套件产品近日成功获得加拿大卫生部颁发的2类医疗器械产品注册证,标志着该产品在加拿大市场的准入。这是维力医疗在国际化布局上的又一重要进展,有望进一步提升公司在海外市场的竞争力,同时,也为公司未来在加拿大及其他国际市场的拓展奠定了坚实基础。此次获得注册证的尿道扩张器套件,将为加拿大患者提供更多高质量的医疗选择。
6. InspireMD新一代颈动脉支架系统获批CE
InspireMD公司的新一代颈动脉支架系统CGuard Prime获CE批准上市,采用MicroNet微网技术,可预防栓塞,降低中风风险,是公司向商业化阶段迈进的关键一步。
7. 威高介入集团旗下金属药物支架系统正式获得俄罗斯医疗器械注册证
威高介入旗下公司金属药物支架系统获俄罗斯医疗器械注册证,标志国际认可,助力开拓欧亚市场,彰显公司创新与质量实力,及服务全球医疗决心。
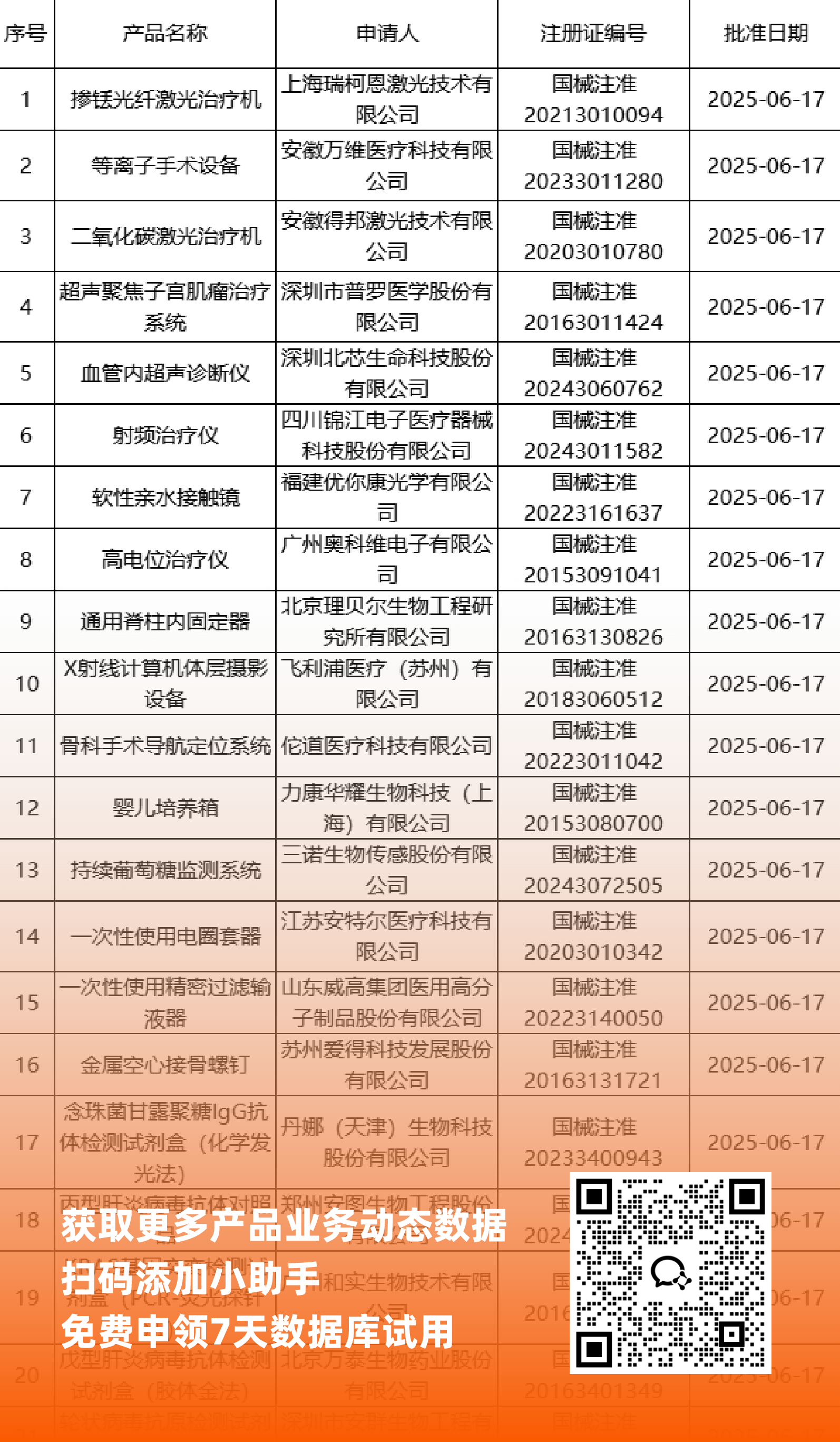
国内获批
NMPA最新获批器械产品明细
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉智库仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。