
商务合作

动脉网APP
2025年6月20日至6月26日,动脉智库重点整理了医疗器械产品国内外获批资讯及数据,涉及10个器械获FDA批准,2个器械获欧盟及其它批准,2个器械获NMPA创新产品批准,另有450个器械获NMPA批准注册文件。
海外获批
一、FDA
1. 获批FDA,全球首款非金属外周弹簧圈
专注于血管栓塞技术的公司Embolization宣布,其研发的非金属弹簧圈获FDA认证,适用于外周血管动静脉栓塞,该产品采用聚合物材料,显著减少CT/MRI成像伪影,为介入治疗提供新技术路径。
2. InspireMD宣布CGuard® Prime颈动脉支架系统获得FDA批准用于预防中风
InspireMD公司宣布,美国食品药品监督管理局(FDA)已批准其用于预防中风的CGuard Prime颈动脉支架系统的上市前申请(PMA)。该批准得到了公司C-GUARDIANS关键试验数据的支持,该试验评估了CGuard Prime在治疗颈动脉狭窄方面的安全性和有效性。这项涵盖美国和欧洲316名患者的研究显示,30天和1年的主要不良事件发生率极低。
3. 首个获FDA的无导线心脏起搏器,EBR Systems攻克心脏再同步治疗临床难题
2025年6月,美国克利夫兰诊所使用EBR Systems研发的WiSE CRT系统,完成了首例无线左心室起搏手术,该系统获FDA批准,通过三大关键技术突破,解决了传统心脏再同步治疗的临床难题,如治疗门槛高、感染风险大和疗效不佳等问题,为全球心衰患者提供新希望。
4. 一次性内镜aScope 5 Cysto HD获批
Ambu公司的一次性柔性膀胱肾镜aScope 5 Cysto HD获得FDA批准,用于经皮肾镜取石术,标志泌尿外科手术向微创、高效发展,并强化Ambu在一次性内窥镜领域的领导地位。该产品已在欧洲获得CE认证,与Ambu其他设备兼容,支持双重可视化,提高手术效率。一次性内窥镜解决传统复用型内窥镜的消毒、交叉感染等问题,降低医疗机构成本。
5. 生物聚合物研发生产商TISSIUM无缝线神经修复平台获得FDA批准
美国食品药品监督管理局 (FDA) 已批准 TISSIUM 公司的 COAPTIUM CONNECT,这是一种用于修复周围神经损伤的新型无创解决方案。该技术由一个 3D 打印的腔室和一种光激活液体聚合物组成,能够固定在神经上,促进神经在腔室内生长和附着。腔室可生物吸收,不会留下永久性植入物。这项创新解决了当前缝合技术的局限性,这些技术可能造成组织损伤并阻碍神经的长期修复。
6. 骨科公司Cerapedics宣布PearlMatrix™ P-15肽增强骨移植材料获FDA批准
Cerapedics公司宣布,FDA已批准PearlMatrix™ P-15肽增强骨移植产品,这是一种III类药械组合产品,用于治疗退行性椎间盘疾病患者的单节段经椎间孔腰椎椎间融合手术。ASPIRE研究表明,PearlMatrix在融合速度上具有统计学上的显著优势,在六个月时融合的患者数量是局部自体移植物的两倍以上,并且研究中约60%为高风险患者。PearlMatrix由专有的P-15成骨细胞结合肽驱动,是首个也是唯一被证实可加速腰椎融合的骨生长促进剂。
7. 胎儿超声诊断公司DeepEcho胎儿超声分析平台获FDA批准
美国食品药品监督管理局 (FDA) 已授予 DeepEcho 的人工智能胎儿超声分析平台 510(k) 许可。该平台利用深度学习算法,自动实现实时胎儿超声视图检测,提高诊断准确性和图像评估质量。平台包含用于胎儿生物测量和羊水体积评估的结构分割,提供标准化分析。DeepEcho 业务遍及欧洲、非洲和美国,专注于胎儿超声诊断。该解决方案由一支人工智能科学家、医生和医学影像专家团队开发。
8. Neuspera:首款微型骶骨神经刺激器获FDA批准打破美敦力、波科在急迫性尿失禁垄断
Neuspera Medical的微型骶骨神经刺激器获FDA批准,用于治疗急迫性尿失禁,打破了市场垄断。其创新集成式设计减少了并发症,临床研究显示84.2%的患者急迫漏尿减少≥50%,显著提升了患者生活质量。
9. 获批FDA,肺部超声床旁检测AI应用
Exo Imaging的手持超声平台Exo Iris获FDA批准,其肺部AI功能可实时检测胸腔积液与肺实变/肺不张,提高肺部疾病初诊效率和病变识别精准度,适用于急诊和基层医疗场景,弥补传统影像不足。
10. 迈杰医学PD-L1检测试剂盒获批新增食管鳞癌适应症——精准诊疗再升级,引领ESCC免疫治疗新纪元
迈杰医学PD-L1检测试剂盒获批新增食管鳞癌适应症,可精准筛选PD-L1阳性患者,提升治疗获益。经临床验证,该试剂盒染色性能卓越,一致率高。FDA强调PD-L1检测对ESCC免疫治疗的重要性。
二、欧盟及其它
1. Acclaro Medical获得加拿大卫生部对UltraClear® 2910 nm冷消融光纤激光器的批准
Acclaro Medical是一家全球能量技术领域的创新者,近日宣布其旗舰产品UltraClear® 2910 nm光纤激光器已获得加拿大卫生部批准。这一进展标志着一次重要的扩展,将最先进的皮肤焕新平台之一引入加拿大市场,供医疗服务提供者和患者使用。UltraClear采用专有的MID IR光纤激光和3DIntelliPulse™技术,是全球首款也是唯一一款2910 nm冷消融光纤,能够提供精确且可定制的治疗,具有极短的恢复时间和卓越的患者舒适度。Acclaro与能量型美容设备分销领域的领导者Xcite Technology合作,引领该产品在加拿大的商业化进程。
2. Quanterix单分子免疫分析仪韩国获批
Quanterix的HD-X免疫分析仪获韩国1类医疗器械注册,可用于临床测试,提高了体外诊断和临床实验室市场影响力。该仪器能高灵敏同时检测多种生物标志物,且在阿尔茨海默病等领域有重要应用。
国内获批
一、创新器械获批
1. 数字PCR分析仪创新产品获批上市
2025年6月20日,国家药品监督管理局批准了苏州思纳福医疗科技有限公司的数字PCR分析仪创新产品注册申请。该产品由温控模块、液滴生成模块、光学模块、运动控制模块、电源模块和软件组成,主要用于对来源于人体血液样本中白血病融合基因的核糖核酸进行定量检测。该产品基于数字PCR检测原理,通过注射振动技术将反应体系分割为数万个液滴,每个液滴均可独立完成PCR扩增反应。经PCR扩增反应后,有靶标核酸分子的液滴会产生荧光,无靶标核酸分子的液滴则不产生荧光,通过检测每个液滴的荧光信号,计算出整个反应体系内的目标基因片段拷贝数,实现白血病融合基因的定量检测。该产品与检测试剂配套使用,为白血病诊断提供更精准的判断依据,使更多患者受益。
2. 肺动脉取栓系统获批上市
2025年6月23日,国家药品监督管理局批准了英纳瑞医疗股份有限公司的 “肺动脉取栓系统”创新产品注册申请。该产品由FlowTriever取栓支架,Triever抽吸导管,FlowSaver血液回收装置, 大口径抽吸注射器和FlowStasis可调节静脉压迫止血器组成。FlowTriever取栓支架采用“自膨胀圆盘”设计以捕获血栓,Triever抽吸导管采用“大口径”设计可快速抽吸血栓,FlowSaver血液回收装置用于过滤以回收大口径抽吸注射器抽吸的内容物。
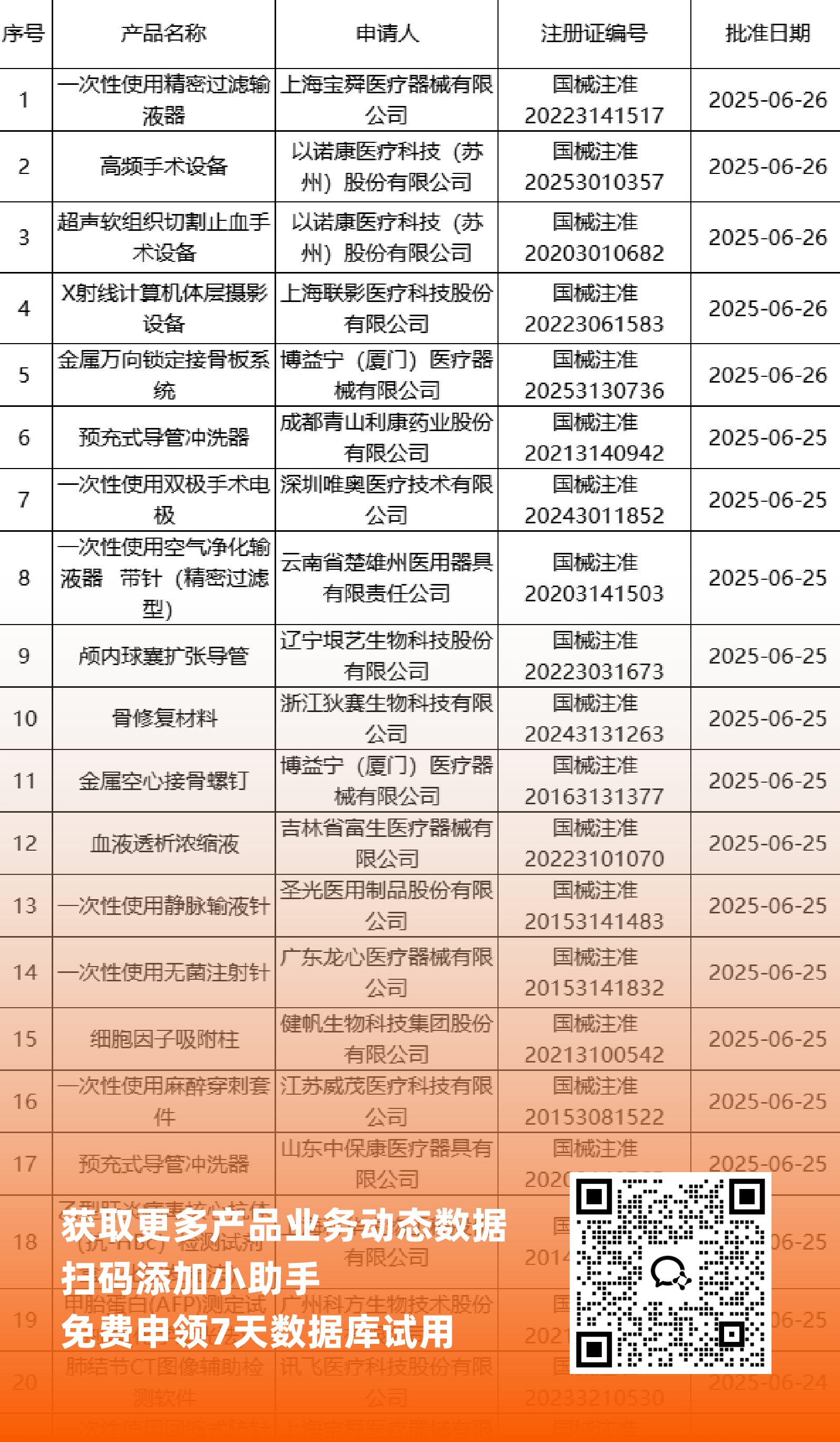
二、NMPA最新获批器械产品明细
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉智库仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。