
商务合作

动脉网APP
2025年7月4日至7月10日,动脉智库重点整理了医疗器械产品国内外获批资讯及数据,涉及15个器械获FDA批准,2个器械获欧盟及其它批准,另有348个器械获NMPA批准注册文件。
海外获批
一、FDA
1. 使用Us2.ai检测心脏淀粉样变性——现已获得FDA批准和CE认证
2025年7月7日,人工智能自动超声心动图分析领域的领导者Us2.ai宣布,其AI Echo Copilot™软件现在可以帮助检测常被漏诊的心脏病——心脏淀粉样变性。这项新功能已获得FDA批准和CE标志,授权其在全球范围内的医院和健康机构中进行临床使用。
2. 呼吸护理公司Synchrony Medical宣布LibAirty™气道清除系统获得FDA 510(k)批准,用于家庭呼吸缓解
Synchrony Medical是一家致力于推进呼吸护理的公司,已获得美国食品药品监督管理局(FDA)510(k)许可,可以在美国市场推广其LibAirty™气道清除系统。LibAirty系统满足了慢性肺病患者(如慢性阻塞性肺病、支气管扩张症和囊性纤维化)的需求。这是首个将控制呼吸与目标胸部按压同步的气道清除系统,经临床验证可提供更优的气道清除效果。研究表明,LibAirty的疗效是传统背心疗法的两倍。随着这一里程碑的达成,Synchrony Medical已在泽西市设立了美国总部,以支持计划中的市场扩展。
3. 全球医疗技术公司Exactech首款上市的肩胛骨重建系统获得FDA批准,治疗髋部应力性骨折
领先的医疗技术公司Exactech宣布,其用于治疗肩峰和肩胛骨脊柱骨折的Equinoxe®肩胛骨重建系统已获得FDA批准,这标志着在治疗此类骨折方面取得了显著进展。肩峰和肩胛骨骨折是每种反向全肩关节置换(rTSA)植入设计都可能引发的一种罕见但严重的并发症,报告的平均发生率为2.8%,但在某些患者诊断中可高达10.9%。Exactech开发了这一创新解决方案,以应对这一复杂rTSA并发症未被满足的临床需求。Equinoxe肩胛骨重建系统由一组经验丰富的外科医生设计,是唯一专门针对考虑rTSA情况的肩峰和肩胛骨骨折的创伤解决方案。
4. Aktiia的Hilo手环是首个获FDA批准的无袖带血压监测仪,可非处方使用
总部位于瑞士的光学血压监测公司 Aktiia 已获得 FDA 510(k) 许可,允许其 G0 无袖带血压监测系统在美国进行非处方销售。这是一个重要的里程碑,因为这是美国首个获 FDA 批准用于非处方销售的无袖带血压监测仪。该产品已通过 CE 认证,并以 Hilo 品牌在欧洲上市,预计将于 2026 年在美国推出。通过这一许可,Aktiia 旨在将 Hilo 打造成领先的无袖带血压监测可穿戴设备,为轻松监测血压树立新的全球标杆。
5. 获批FDA,可穿戴神经科技设备
Fasikl公司研发的Felix NeuroAI腕带获FDA批准,用于治疗原发性震颤,该设备利用AI技术实现非侵入式、个性化神经调节,临床效果显著,标志着神经科技治疗新进展。
6. 医疗机器人公司Mendaera手持超声引导介入机器人获批FDA
Mendaera公司的Focalist手持机器人系统获FDA批准,用于超声引导介入操作,计划2025年下半年初步临床推广,将提高介入手术精度与一致性,降低技术门槛,减少并发症风险。
7. 早期感染诊断新可能,ID-FISH双抗体检测获FDA认证,或重塑莱姆病临床实践
ID-FISH公司双抗体检测获FDA认证,可全面准确诊断莱姆病,其创新技术包含多种抗原,显著提高诊断灵敏度,有望改变莱姆病临床实践。
8. FDA批准全球首款智能人工耳蜗
Cochlear公司宣布FDA批准其全球首款智能人工耳蜗Nucleus Nexa上市,该耳蜗固件可升级,让患者始终得到卓越听觉体验。听力损失患者日益增多,而Nucleus Nexa通过智能技术满足患者恢复听力的需求。
9. 神经血管介入治疗公司Q'Apel Medical宣布Zebra神经血管通路系统获得美国FDA批准,并准备在美国全面上市
Q'Apel Medical是一家私人医疗器械公司,其Zebra神经血管通路系统已获得FDA批准,该系统专为神经血管介入手术设计。该系统提供6F和7F两种尺寸,适用于将介入设备引入外周和神经血管系统。它具有独特的内径/外径比例和激光切割技术,能够提供均衡的输送性能和稳定的支撑。宾夕法尼亚大学医学中心脑血管外科主任Jan-Karl Burkhardt博士表示,随着神经血管疾病发病率的上升,精细的介入治疗变得尤为重要,而Zebra系统的动态灵活性在处理复杂解剖结构时表现出色。
10. 术后粘连预防公司Fziomed获得FDA的De Novo分类授权和Oxiplex®凝胶在脊柱外科领域的上市许可
Fziomed公司是术后粘连预防领域的领导者,该公司宣布FDA已授予Oxiplex凝胶De Novo分类和上市许可。Oxiplex是首个也是唯一获得FDA授权的术中凝胶,专门设计用于减少接受腰椎手术的成年患者术后腿部疼痛和神经症状。凭借强有力的临床证据以及在美国以外超过20年的使用经验,Oxiplex有潜力作为一种辅助疗法成为新的护理标准,解决一项重大的未满足临床需求。
11. 赛默飞×迪哲医药,舒沃哲获批24小时内,首个NGS伴随诊断测试获FDA批准
赛默飞世尔的Oncomine Dx Express测试获FDA批准,可用于迪哲医药舒沃替尼片的伴随诊断和肿瘤分型,支持24小时内生成结果,助力及时治疗决策。
12. 全球第二款获批,西门子垄断终结
佳能医疗的光子计数CT系统TSX-501R获FDA批准,成为全球第二款获批设备,打破西门子医疗近四年的市场垄断。该技术以高空间分辨率、多能谱成像和超低辐射剂量为特点,关键在于佳能收购Redlen公司后整合的CZT探测器与自有深度学习算法。此举将改变全球光子计数CT市场格局。
13. 全球首个免缝合周围神经修复平台获批FDA
Tissium公司宣布其自主研发的Coaptium Connect神经接合系统与Tissium Light光固化平台获得美国食品药品监督管理局(FDA)市场准入许可。这是自2007年以来FDA首次批准基于新型聚合物平台的医疗设备,标志着Tissium在组织修复领域的重大突破。Tissium计划在未来几个月内在美国启动Coaptium Connect的商业化推广。这是该公司进入美国市场的首个产品,标志着其生物聚合物平台在全球医疗市场中的初步布局。
14. 赛默飞肺癌伴随诊断试剂,获批上市
赛默飞推出基于Ion Torrent测序仪的肺癌伴随诊断试剂,获FDA批准,可检测EGFR突变及46个癌症相关基因,24小时出结果,助力治疗决策。
15. 手术机器人公司MastOR宣布Maestro手术机器人系统的两项新功能获美国FDA 510(k)许可
腹腔镜机器人公司Moon Surgical的Maestro系统新增云端连接与AI功能,获FDA批准,助力中小医院微创手术升级,并推进数字化手术室战略。
二、欧盟及其它
1. 欧盟委员会批准用于肢端肥大症治疗的预填充自动注射器
欧盟委员会批准了一种新的预填充自动注射器用于治疗肢端肥大症,为患者提供了一种便捷的自我管理方法,以应对因生长激素过度分泌引发的激素紊乱。这项创新旨在提高患者的自主性,同时确保有效的疾病控制,标志着疾病管理方面的重要进展。
2. 蓝帆医疗可回收经导管主动脉瓣置换术输送系统获批CE
蓝帆医疗旗下德国NVT研发的可回收经导管主动脉瓣置换术输送系统IMPERIA™获欧盟CE认证,标志着其正式在欧盟上市,该系统搭配已上市的ALLEGRA™系列主动脉瓣膜使用,有望助推TAVR系统商业化突破。此外,随着人口老龄化,主动脉瓣疾病治疗需求增加,TAVR技术作为微创介入导管技术,已使全球80万例患者受益。
国内获批
NMPA最新获批器械产品明细
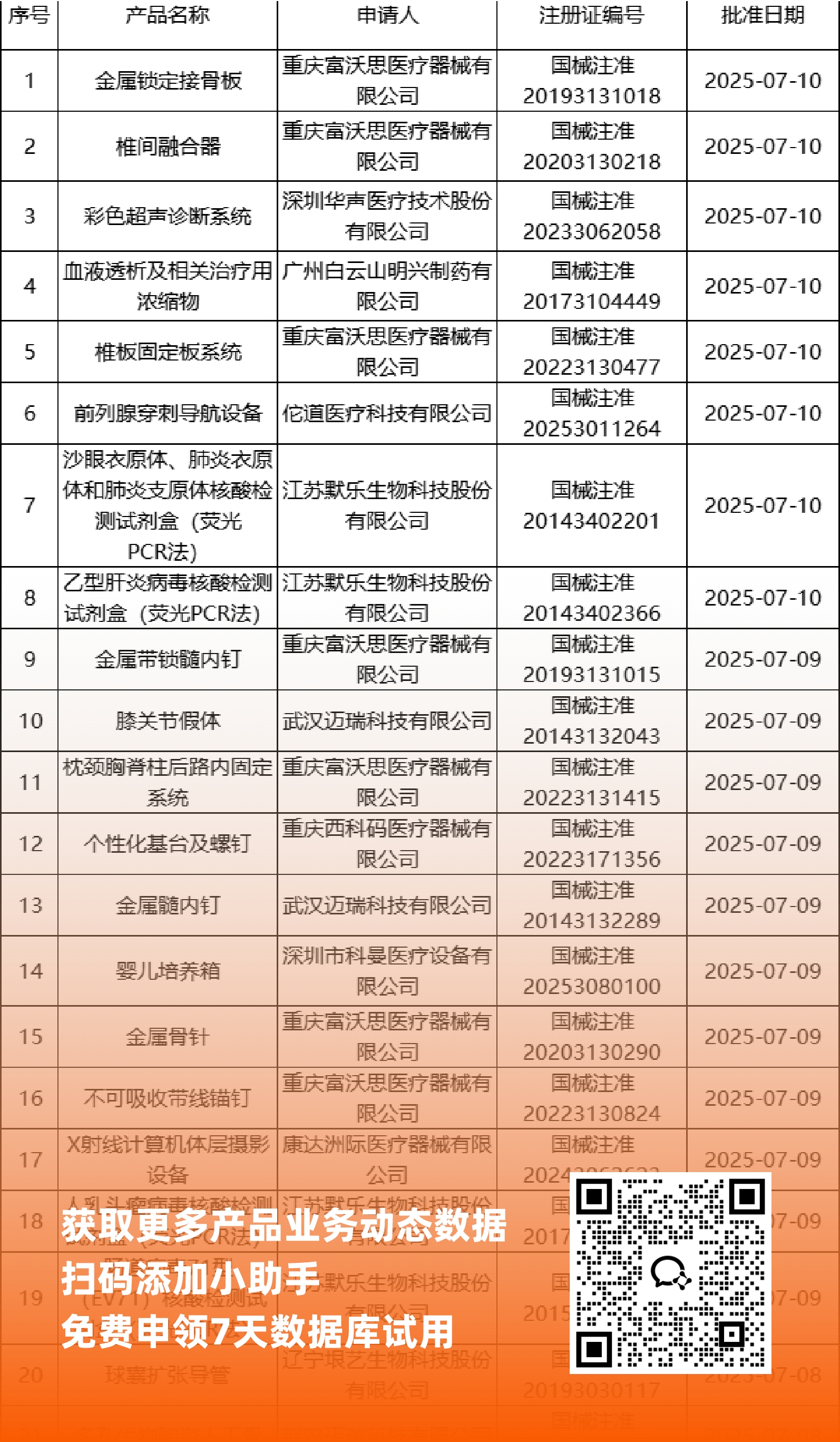
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉智库仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。