
商务合作

动脉网APP
2025年7月25日至7月31日,动脉智库重点整理了医疗器械产品国内外获批资讯及数据,涉及9个器械获FDA批准,1个器械获欧盟及其它批准,1个器械获NMPA创新产品批准,另有482个器械获NMPA批准注册文件。
海外获批
一、FDA
1. 首款神经免疫刺激器获FDA批准,针对类风湿关节炎
SetPoint Medical宣布其神经免疫刺激器SetPoint获FDA批准上市,这是全球首款神经免疫调节装置,适用于对现有生物制剂、靶向合成改善病情抗风湿药(DMARDs)等高级疗法响应不足或无法耐受的中重度类风湿关节炎(RA)成人患者。FDA批准IDE研究(RESET-RA)证实,SetPoint在对一种以上生物制剂或靶向合成DMARDs响应不足的中重度活动性RA患者中具有安全性和有效性。
2. 医疗器械公司EvoEndo超细经鼻一次性胃镜获FDA批准上市
EvoEndo LE超细经鼻一次性胃镜获FDA批准,适用于全年龄段患者,外径3.5mm且兼容多数儿科配件,结合VR提升诊疗体验,将挑战传统胃镜检查。
3. POCT产品升级,雅培血气分析仪获批
雅培的i-STAT CG4+血气分析仪获FDA批准,是POCT产品升级。它通过一次性测试卡与手持分析仪组合,可快速检测pH、PO₂、PCO₂和乳酸,满足急重症诊断需求,提升检测性能和准确性,适用于床旁或临床实验室环境,属处方使用产品。
4. Cardiosense可穿戴传感器获得FDA批准
Cardiosense 宣布其 CardioTag 可穿戴传感器获得 FDA 510(k) 许可,这是首款同时捕捉高保真 ECG、PPG 和 SCG 信号的多模态设备。它为临床医生和患者提供了一种无创解决方案,用于评估心脏功能、检测疾病的早期迹象、指导治疗并改善结果。该许可授权对这些信号、心率和脉搏率进行无创测量。SCG 测量胸壁振动,结合 ECG 和 PPG 分析时,有助于准确评估 LVET 等心脏时间间隔。
5. BD获得FDA 510(k)快速即时检测COVID-19的许可
BD是一家全球领先的医疗技术公司,其BD Veritor™系统已获得FDA 510(k)批准,用于检测SARS-CoV-2。这款数字测试旨在15分钟内检测有症状个体的COVID-19抗原,将于2025年早秋开始取代目前的EUA版本。该系统适用于CLIA豁免环境,通过BD Veritor™ Plus分析仪提供客观且易于读取的结果,帮助临床医生做出及时决策,并可能改善患者预后。
6. 全球首个,机器人导航电生理标测导管获批
Stereotaxis公司的Magic Sweep导航导管获FDA认证,成为全球首个机器人导航电生理标测导管,标志心脏消融手术精准化、微创化进展,将推动诊疗革命。该导管搭载20个电极,实现心脏复杂区域精准导航,降低手术风险。此举巩固了Stereotaxis在机器人心血管介入领域的领先地位。
7. 微生物诊断产品研发商Hardy Diagnostics检测CTX-M酶的新型快速检测获FDA批准
Hardy Diagnostics公司宣布,NG-TEST® CTX-M Multi已获得FDA批准,这是一种用于检测疑似产超广谱β-内酰胺酶(ESBL)的肠杆菌目中CTX-M酶的快速免疫测定法。该测试可在数分钟内确认CTX-M酶的存在,应对了日益严重的全球健康问题——赋予多种抗生素耐药性的超广谱β-内酰胺酶(ESBL)。CTX-M ESBL于1989年首次在德国被报道,现已在美国及全球范围内广泛流行,已知的CTX-M主要分为五个大组,包含超过100种变体。
8. 直立放射治疗解决方案提供商Leo Cancer Care革命性的直立放射治疗平台Marie获得FDA 510(k)许可
Leo Cancer Care 是直立放疗领域的领导者,宣布其旗舰产品 Marie® 已获得 FDA 的 510(k) 许可。Marie 结合了直立患者定位系统和 CT 扫描仪,重新构想治疗体验,并在尺寸和成本上较现有的粒子治疗方案有所减少。这一许可标志着 Leo Cancer Care 和癌症治疗未来的一个重要里程碑,为放射治疗提供了更具人性化和关怀的方式。Marie 消除了对旋转机架的需求,解决了传统系统在成本、尺寸和复杂性方面的障碍。
9. 岛津头部和乳房PET获批
岛津推出头部和乳房专用PET系统PositView SET-5002,获FDA批准。其28厘米内径检测环提升成像分辨率,有望助力阿尔茨海默病等神经退行性疾病的早期诊断。该设备填补区域专用PET市场空白,未来或扩展至其他浅表器官检查。
二、欧盟及其它
1.Body Vision Medical在巴西获得LungVision®的监管批准,扩大了用于肺癌诊断的AI驱动先进成像技术的使用范围
Body Vision Medical是一家人工智能驱动的术中成像领域的领导者,近日宣布其LungVision高级成像系统已获得巴西国家卫生监督局(ANVISA)的监管批准。这标志着该公司在全球范围内提升早期且精准的肺癌诊断使命中迈出了重要一步。在巴西,肺癌是导致癌症死亡的主要原因之一,而晚期诊断是一个重大挑战。LungVision将标准的C型臂转变为人工智能驱动的3D成像系统,提供实时导航和更清晰的可视化,从而实现更准确的支气管镜活检。该技术旨在促进肺结节的早期和更精确诊断,有望改善患者预后,同时保持较低的操作成本。
国内获批
一、创新器械获批
1. 生物型膝关节假体系统获批上市
2025年7月30日,国家药品监督管理局批准了嘉思特医疗器材(天津)股份有限公司生物型膝关节假体系统创新产品注册申请。该产品由股骨髁、胫骨平台、胫骨平台垫、定位柱和加压杆组成。其中,股骨髁部件由符合YY 0117.3标准规定的铸造钴铬钼合金材料制成,内表面采用等离子喷涂纯钛涂层,涂层材料符合YY/T 0988.2标准的规定;胫骨平台部件由Ti6Al4V ELI粉末经电子束熔融增材制造工艺制成,产品的化学成分和力学性能符合YY 0117.2标准的规定;胫骨平台垫部件由含维生素E的高交联超高分子量聚乙烯(牌号Chirulen® 1020EX)材料制成,符合YY/T 0811标准的规定;定位柱和加压杆部件由符合GB/T 13810标准规定的TC4钛合金材料制成。该产品作为非骨水泥型假体使用,适用于初次全膝关节置换。
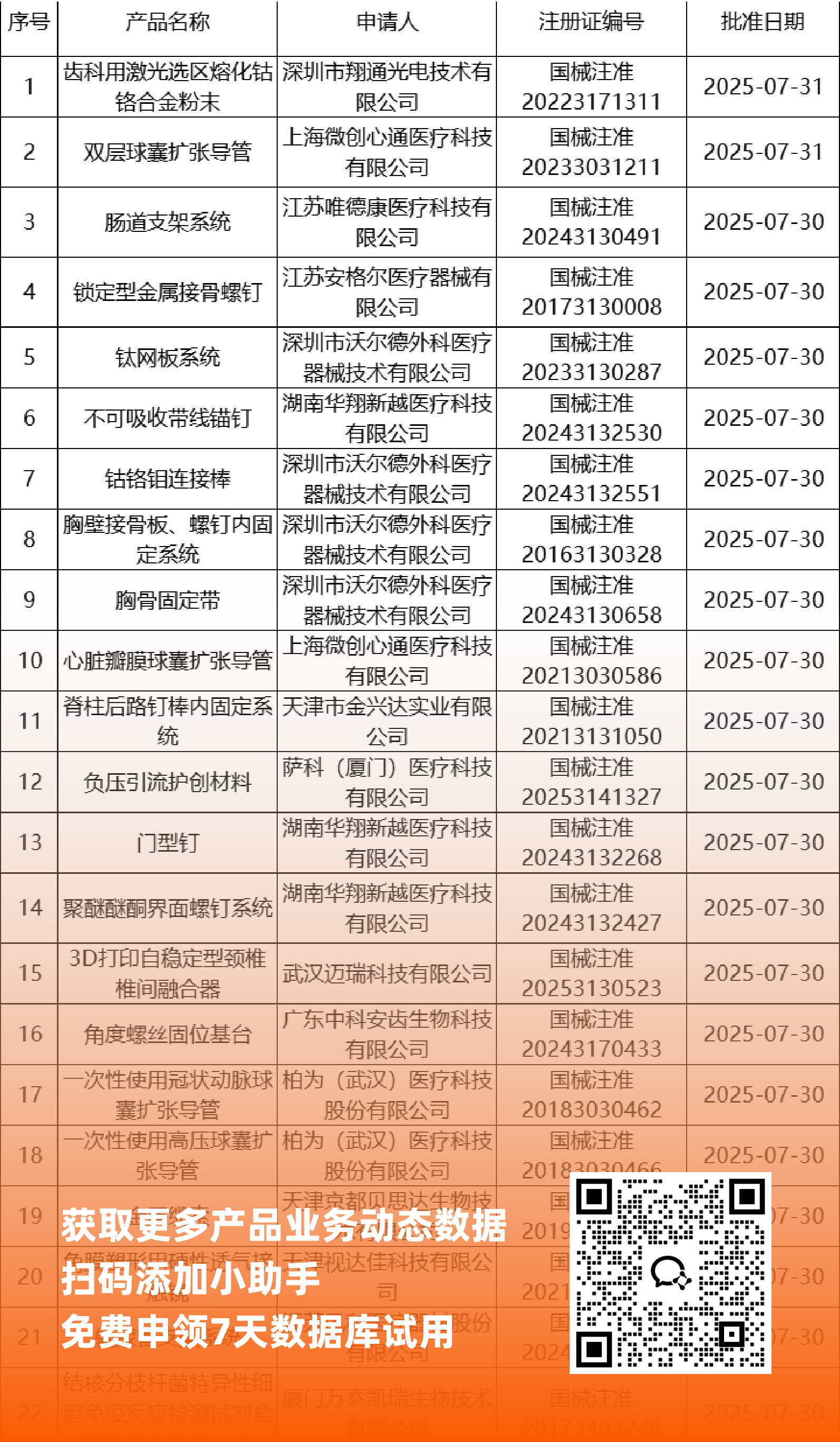
二、NMPA最新获批器械产品明细
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉智库仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。