
商务合作

动脉网APP
2025年8月22日至8月28日,动脉智库重点整理了医疗器械产品国内外获批资讯及数据,涉及7个器械获FDA批准,5个器械获欧盟及其它批准,4个器械获NMPA创新产品批准,另有557个器械获NMPA批准注册文件。
海外获批
一、FDA
1. 美敦力Evolut TAVR系统获FDA批准扩大Redo TAVR适应症
美敦力已获得美国食品药品监督管理局(FDA)对其Evolut™经导管主动脉瓣置换(TAVR)系统扩展Redo-TAVR适应症的批准。这使得在任何先前植入的失败TAV内部植入新的Evolut TAV成为可能。Redo-TAVR手术适用于TAV失效的患者,包括患有严重主动脉瓣狭窄且开胸手术风险较高的患者。迈克尔·卡斯基博士表示,这一批准标志着一个重要的里程碑,为高风险的经导管心脏瓣膜失效患者提供了一个关键的治疗选择,并有可能改善他们的长期预后和生活质量。
2. 尖端医学成像技术公司Brightonix Imaging高性能“PHAROS”PET获得FDA批准
Brightonix Imaging是医学影像技术的领导者,该公司宣布其旗舰产品PHAROS PET扫描仪已获得美国食品药品监督管理局(FDA)的商业分销许可。PHAROS PET扫描仪是一种最先进的临床正电子发射断层扫描系统,旨在提供卓越的图像质量,用于早期疾病检测、精确诊断和优化治疗计划。凭借其创新设计、增强性能和多功能特性,PHAROS扫描仪有望在神经学及其他医学领域树立新标准。其主要特点包括前所未有的图像清晰度和紧凑的设备尺寸。
3. 一次性多活检针产品开发商OnePass Medical超级活检针获FDA批准上市
InstaFAN,一款由五个活检针组成的超级活检针,获FDA批准上市。其旨在解决传统EUS-FNA不足,能获取更多病理组织,提高诊断准确度,具有操作简便、零出血、零渗漏和组织零损伤等优势,适用于胰腺癌等难以诊断的肿瘤。
4. FDA批准用于体重管理的非处方血糖监测系统
美国食品和药物管理局(FDA)批准了Signos血糖监测系统,这是一款用于体重管理的非处方血糖监测系统。Signos结合了Dexcom的血糖生物传感器与人工智能技术,实时展示食物、活动和睡眠等各种因素如何影响身体,从而帮助用户做出个性化的健康决策。其主要功能包括个性化的代谢指导,以及将血糖波动转化为健康习惯建议。Signos的订阅计划起价为每月139美元,旨在应对日益严重的代谢健康危机,因为研究预测到2050年糖尿病诊断人数将达到13亿。
5. 医学成像公司Esaote超声系统MyLab™ A50和MyLab™ A70已获得FDA批准
医学影像公司Esaote宣布其MyLab™ A50和MyLab™ A70超声系统已获得FDA批准,这标志着在安全性和临床性能方面取得了重要的里程碑。这些先进的平台此前已在国际上发布,现在已获准在美国分销。这些系统设计注重卓越的灵活性、性能和便携性,具有紧凑的尺寸和电池供电功能。百胜北美超声销售总监托马斯·威尔强调了多样化的界面选项以及直观且易于清洁的设计所带来的用户体验。MyLab™ A50和MyLab™ A70能够处理各种临床应用,从常规诊断到高级成像技术均能胜任。
6. 安捷伦MMR IHC Panel获FDA批准,结直肠癌免疫治疗有了新伴随诊断工具
安捷伦的MMR IHC Panel获FDA批准,成为结直肠癌免疫治疗新伴随诊断工具,可检测错配修复缺陷,帮助制定更精准免疫治疗方案,有望改善患者治疗效果和生活质量。
7. 万孚甲乙流联检获FDA首证
万孚生物美国子公司成功获得美国FDA510(K)许可(K251563),旗下两款呼吸道联检产品——甲型流感病毒及乙型流感病毒双联家庭检测试剂盒(OTC版)WELLlife™FluA&BHomeTest和甲型流感病毒及乙型流感病毒双联检测试剂盒(Professionaluse版)WELLlife™InfluenzaA&BTest两项产品,正式获准进入美国市场。
二、欧盟及其它
1.全球首款睫状体巩膜介入装置Intercil获CE批准上市
医疗器械公司Ciliatech宣布其葡萄膜间隔器Intercil获CE批准上市,Intercil通过增加葡萄膜巩膜流出途径来降低眼压,且无需穿透眼前房。Intercil是全球首款用于治疗青光眼的“睫状体巩膜介入装置”(CID),其设计旨在通过增加葡萄膜巩膜流出途径来降低眼压,且无需穿透眼前房。这种“无滤过泡无裂隙”的技术有望保持眼前房的完整性,具有降低角膜内皮细胞损失风险的潜在优势。这种手术技术改变了外科医生处理眼部睫状体上腔的方式,展现出高安全性,能最大限度减少并发症并为患者提供舒适的术后恢复。
2. 精锋®多孔腔镜手术机器人获巴西ANVISA注册批准,斩获拉美市场“最高通行证”
精锋®多孔腔镜手术机器人获巴西ANVISA注册批准,适用于多科室内窥镜手术,标志其国际化竞争力再获认可。此批准简化了拉美市场准入,加速了机器人辅助手术技术在拉美地区的推广与应用。
3. 首个,用于膝下(BTK)部位的可吸收支架获批
雅培研发的Esprit BTK可吸收支架系统获CE标志,专为膝下外周动脉疾病设计,植入后可随时间降解,已获FDA批准,现进军欧洲市场,为患者提供新治疗方案。
4. 心通医疗Alwide® Plus /敖广®Plus球囊获欧盟CE认证
心通医疗的第二代心脏瓣膜球囊扩张导管Alwide® Plus /敖广® Plus获欧盟CE认证,是公司在欧盟的第四款上市产品。该器械为TAVI手术提供更可靠操作体验,支持VitaFlow Liberty®/自由·维心流™在欧洲商业化,并增强整体解决方案竞争力。此前已有三款产品在欧盟上市。这四款产品将提升心通医疗在国际市场的影响力,为全球患者提供更优质医疗解决方案。
5. 金属药物支架系统正式获得俄罗斯医疗器械注册证
威高介入旗下公司金属药物支架系统获得俄罗斯医疗器械注册证,标志其品质与安全性获国际认可,助力开拓俄罗斯及欧亚市场,彰显公司全球服务决心。
国内获批
一、创新器械获批
1. 颅内动脉瘤辅助栓塞支架获批上市
2025年8月22日,国家药品监督管理局批准了江苏畅医达医疗科技有限公司“颅内动脉瘤辅助栓塞支架”创新产品注册申请。该产品由颅内支架、输送元件组成,部分规格含有输送导管;输送元件由输送杆和导入鞘组成;输送导管由微导管和塑形针组成。产品中支架是由单丝编织的两端封闭的自膨式弹性结构,两端喇叭张开角度和支架长度可调节,预期减少血管损伤及增强血管贴壁性,支架长度可调节预期可选择性增加局部金属覆盖率。
2. 肺动脉取栓支架系统获批上市
2025年8月22日,国家药品监督管理局批准了晨兴(南通)医疗器械有限公司“肺动脉取栓支架系统”创新产品注册申请。该产品适用于有肺动脉主干或主要分支血栓,并存在高出血风险或溶栓禁忌的患者、经溶栓或积极的内科治疗无效患者的急性高危肺栓塞或伴临床恶化的中危肺栓塞的经导管血栓清除治疗。产品使用了环间固定套设计,降低了取栓网篮的释放、回撤过程中各网盘之间的形变传导。
3. 全自动细胞形态学分析仪创新产品获批上市
2025年8月26日,国家药品监督管理局批准了深圳迈瑞生物医疗电子股份有限公司的全自动细胞形态学分析仪创新产品注册申请。该产品由玻片篮输入输出模块、玻片取放模块、显微成像模块、滴油模块、玻片回收模块等和软件(主机应用软件和PC应用软件)组成,其中PC应用软件包含:用户交互界面、数据管理模块、基于深度学习的细胞形态分析模块。主要用于对来源于人体外周血液样本中白细胞及有核红细胞分类计数、红细胞形态学分级和血小板数量估算。
4. X射线计算机体层摄影设备创新产品获批上市
2025年8月26日,国家药品监督管理局批准了东软医疗系统股份有限公司的X射线计算机体层摄影设备创新产品注册申请。该产品由扫描架、高压发生器、X射线管组件、光子计数探测器、检查床、激光定位灯、控制台、限束器、选配件和附件组成。主要用于常规CT检查,支持冠状动脉CT血管造影和能谱检查。该产品采用光子计数探测器替代传统的积分型探测器,通过对探测器材料施加高偏置电压,促使电流载体定向移动,形成电流脉冲,产生测量数据。与传统CT相比,该产品具有更高的空间分辨率,可通过一次扫描获得多个能量图像,更好地满足临床影像诊断需求。
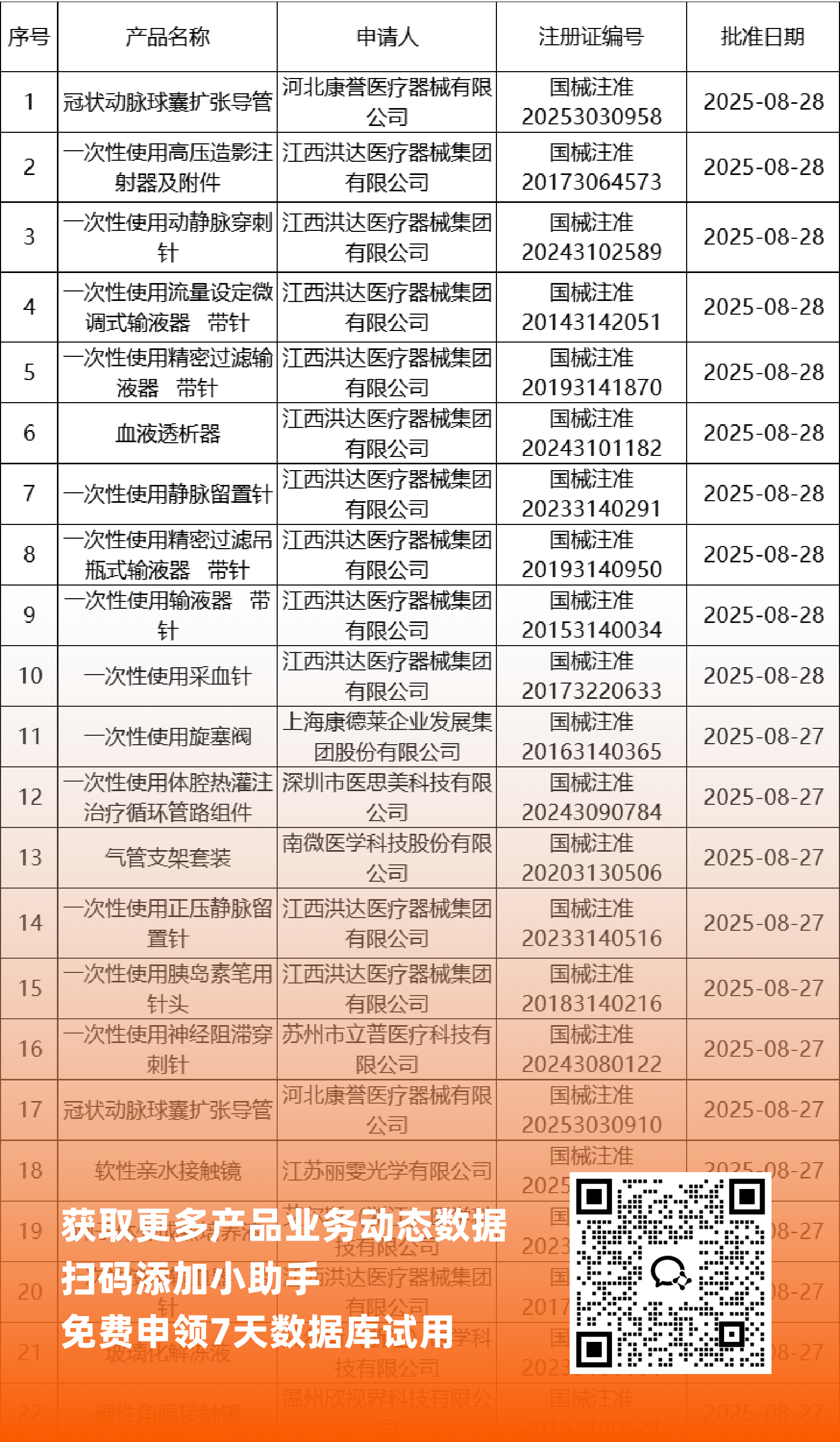
二、NMPA最新获批器械产品明细
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉智库仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。