
商务合作

动脉网APP
2025年8月29日至9月4日,动脉智库重点整理了医疗器械产品国内外获批资讯及数据,涉及8个器械获FDA批准,4个器械获欧盟及其它批准,1个器械获NMPA创新产品批准,另有348个器械获NMPA批准注册文件。
海外获批
一、FDA
1. 美国首个,非侵入性患者监护公司Sentec适用于早产儿和自主呼吸患者的EIT系统获得FDA批准
非侵入性患者监测领域的领导者Sentec宣布其LuMon™电阻抗断层成像(EIT)系统已获得美国食品药品监督管理局(FDA)的510(k)许可。这使得LuMon™成为美国首个获批用于早产儿和自主呼吸患者的EIT技术,覆盖早产儿、婴儿、青少年及成人。LuMon™ EIT系统可在床旁直接提供功能性肺部成像,且无辐射,使临床医生能够根据每位患者的具体需求个性化治疗方案。这一许可对新生儿重症监护室(NICU)的临床医生尤为重要,因为它支持为早产儿及其他NICU患者个性化通气护理,而通气具有极大的复杂性,需要精准操作以避免长期后果。LuMon™系统还获得了欧盟MDR的CE认证,并在澳大利亚注册于TGA。
2. 医疗技术公司4DMedical首创基于CT的VQ技术的CT:VQ™获得FDA 510(k)许可
先进呼吸成像领域的领导者4DMedical宣布其CT:VQ™系统获得美国FDA 510(k)批准,这是全球首个且唯一的无对比剂通气-灌注(VQ)成像解决方案。这项创新技术能够将标准的无对比剂胸部CT扫描转化为定量的肺叶通气(V)和灌注(Q)图,而无需额外的对比剂注射。美国医疗保险和医疗补助服务中心(CMS)已确认CT:VQ可通过第三类CPT代码获得报销,作为对基础胸部CT现有报销的补充。CT:VQ以软件即服务的形式交付,无缝集成到常规放射科工作流程中,并利用美国现有的约14,500台CT扫描仪。这一进步使得即使在缺乏核医学能力的地方也能实现功能性肺部成像。
3. 全球唯一集成高密度标测的PFA消融导管获FDA批准上市
Kardium宣布其消融、标测二合一导管Globe PFA获FDA批准上市,同时Globe导引鞘管和Globe脉冲场消融系统标测软件也获批上市。Globe PFA是FDA批准的第六款PFA消融产品,随着Globe PFA上市美国电生理三巨头(强生、波科、美敦力)要开始迎接电生理新势力挑战。Globe PFA是一款全球独一无二PFA消融产品,其是全球唯一集高密度心脏标测与消融功能于一体消融导管,仅需单根导管即可实现单次肺静脉隔离(PVI)及可定制的靶向消融。
4. 三友医疗Zeus脊柱内固定系统认证升级获FDA510(k)认证
三友医疗宣布,其Zeus脊柱内固定系统的国际品牌JSS成功获得美国FDA510(k)认证,标志着公司在北美市场准入资质取得突破,加速海外战略布局。
5. FDA批准首款大口径连续真空抽吸导管
Imperative Care公司的Symphony抽吸导管获得FDA批准,适应症从静脉血栓扩展到肺栓塞,为静脉血栓栓塞症患者提供全面治疗方案。该研究通过IDE临床研究证实了其安全性与有效性,医疗专家和公司高管对其高度评价,认为其将推动肺栓塞治疗的进步。
6. 美敦力MiniMed 780G获FDA批准兼容雅培Instinct传感器并扩展至2型糖尿病适应症
美敦力宣布MiniMed™ 780G系统获得两项FDA里程碑。SmartGuard™ 算法已被批准为可互操作的自动血糖控制器(iAGC),允许与雅培的Instinct传感器集成,用于1型糖尿病管理。此外,MiniMed™ 780G系统还获批用于18岁及以上需要胰岛素治疗的2型糖尿病成人患者。这些成就标志着MiniMed™ 780G系统的经过验证的优势将惠及更广泛的糖尿病患者群体,提供更多的选择、灵活性以及无缝体验。此次批准完成了美敦力公司针对1型糖尿病患者的MiniMed™ 780G系统与Instinct传感器集成的FDA上市前审批。
7. Qiagen的QiaStat-Dx Rise综合征测试系统获得FDA 510(k)许可
Qiagen的QiaStat-Dx Rise综合征检测系统已获得FDA 510(k)许可。该系统本周在美国推出,每天可处理160个样本,具备自动加载/卸载功能,并能优先处理紧急样本。它支持呼吸道检测板,即将增加胃肠道检测板。这是QiaStat-Dx系列产品在2025年获得FDA批准的第三款产品,在过去12个月中已有六种测试板获得批准。该系统已在100多个国家推出,2025年上半年全球部署了超过4,600台仪器。Qiagen传染病副总裁Nadia Aelbrecht表示,此次发布标志着美国及全球在扩大传染病诊断可及性方面取得了进展。
8. 中国创新肿瘤基因检测产品世和一号获美国FDA批准上市
世和基因宣布,其自主研发的世和一号®(GENESEEQPRIME®)泛实体瘤高通量测序基因检测试剂盒正式获得美国食品药品监督管理局(FDA)批准上市。这标志着中国本土企业自主研发的高通量测序大Panel体外诊断(IVD)试剂首次成功打入国际核心市场,也是中国民营企业创新成为全球行业标杆的又一旗帜。
二、欧盟及其它
1.全球首款0.024英寸可操控导丝获批上市
Rapid Medical宣布其可操纵导丝DRIVEWIRE 24获CE批准上市,且已在北美完成超1000台临床手术。专家评价其实现了精准性与支撑性的独特结合,能指数级提升手术效率。心血管及神经介入手术中,导丝是关键器械,脑部血管细且弯曲,对导丝要求极高,传统导丝常需多次移除重塑形态。DRIVEWIRE 24是首款可操控远端的神经血管导丝,直径仅0.024英寸,能按需改变路径和形态,精准探查,减少导丝更换次数,提高手术成功率。临床数据显示,其在94%的手术中成功抵达目标部位,且未出现器械相关并发症,已快速成为治疗缺血性中风等复杂神经血管疾病的首选技术。
2. Symplicity Spyral获日本PMDA批准,开启高血压微创介入新时代
Symplicity Spyral获日本PMDA批准,通过微创介入和射频消融技术,有望解决高血压治疗难题,该技术可精准调节交感神经活性,重塑血压调控。
3. 连战连捷,浩微医疗UniPearls®聚乙烯醇丙烯酸钠栓塞微球获批白俄罗斯注册证
LifeBay生物医药产业园聚焦创新药物等产业,打造全链条生态,加速AI医药产业发展,推动AI与生物制药融合,成为全国领先生物医药产业高地。浩微医疗产品获批白俄罗斯注册证。
4. 赛诺医疗TRADENTTM冠状动脉棘突球囊扩张导管获泰国医疗器械注册证
赛诺医疗自主研发的TRADENTTM冠状动脉棘突球囊扩张导管获得泰国医疗器械注册证,用于PTCA血管狭窄病变扩张治疗,系该产品首张海外注册证,将丰富公司海外销售产品。
国内获批
一、创新器械获批
1. 颅内动脉瘤辅助栓塞支架获批上市
2025年9月2日,国家药品监督管理局批准了苏州杰成医疗科技有限公司的“经导管主动脉瓣膜系统”创新产品注册申请。该产品为经股动脉入路,具有活动式定位件夹持原生主动脉瓣叶,可调弯输送系统适配横位心等复杂解剖结构。适用于经心脏团队结合评分系统评估后认为患有有症状的、重度主动脉瓣膜关闭不全(重度主动脉瓣返流),或同时合并主动脉瓣狭窄,不适合进行常规外科手术置换瓣膜、年龄大于等于70岁的患者。
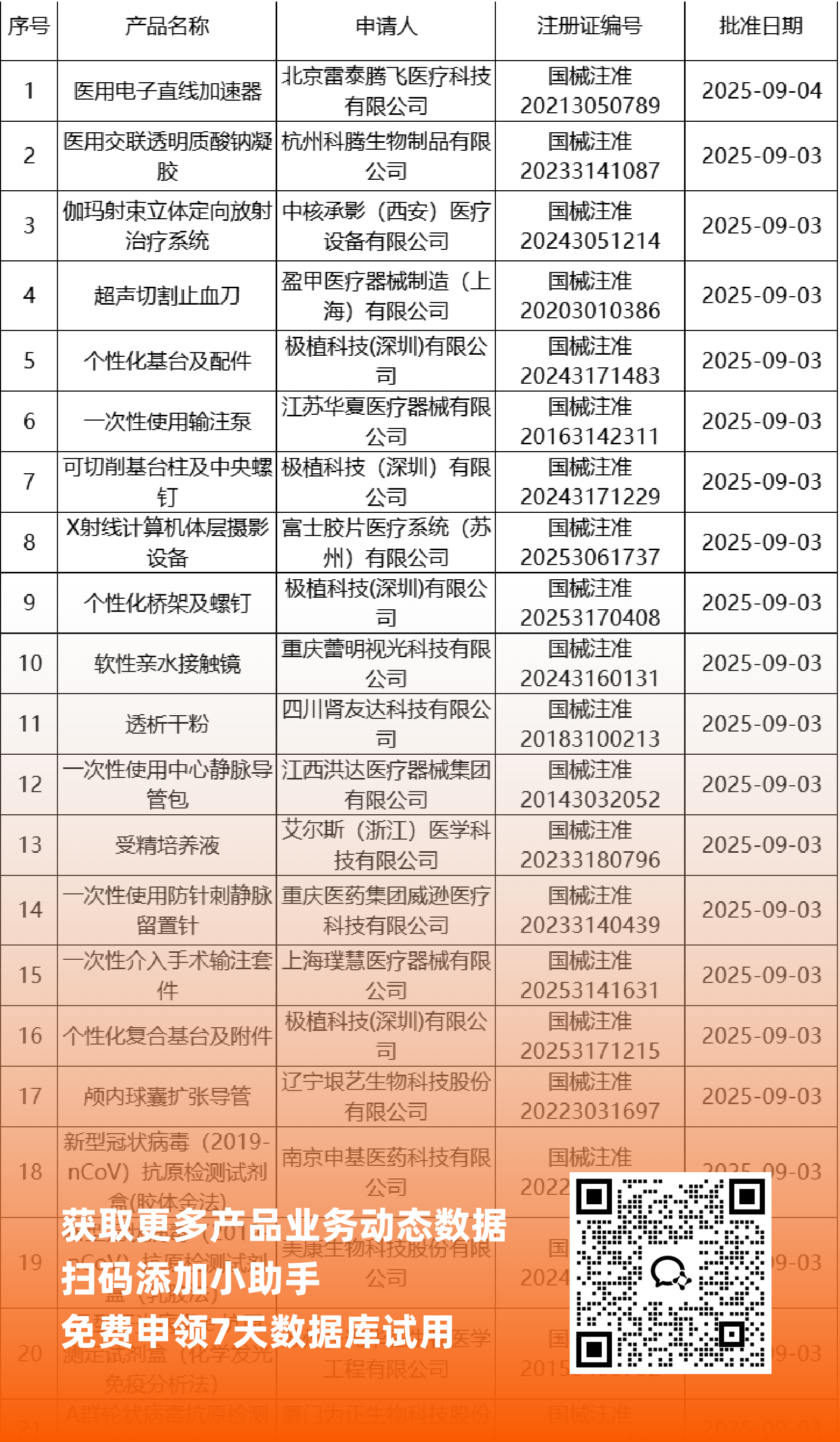
二、NMPA最新获批器械产品明细
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉智库仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。