
商务合作

动脉网APP
2026年1月16日至2026年1月22日,动脉智库重点整理了医疗器械产品国内外获批资讯及数据,涉及3个器械获FDA批准,4个器械获欧盟及其它批准,1个器械获NMPA创新产品批准,另有557个器械获NMPA批准注册文件。
海外获批
一、FDA
1. Guardant Health的Guardant360® CDx作为伴随诊断工具获FDA批准
Guardant Health, Inc.宣布,美国FDA已批准 Guardant360® CDx作为伴随诊断工具,用于识别携带 BRAF V600E 突变的转移性结直肠癌 (mCRC) 患者,这些患者可能受益于BRAFTOVI®(encorafenib,恩科拉非尼)联合西妥昔单抗和化疗的治疗方案,具体内容详见获批产品标签。此次批准基于辉瑞公司 III 期BREAKWATER 试验的数据,该试验表明,与标准治疗相比,基于恩科拉非尼的治疗显著提高了未经治疗的 BRAF 突变型 mCRC 患者的客观缓解率、无进展生存期和总生存期。研究结果强调了早期基因组检测在指导靶向治疗中的重要性。Guardant360 CDx 提供了一种非侵入性的基因组检测选择,通过简单的抽血即可检测 BRAF V600E 和其他具有临床意义的基因变异,帮助临床医生快速识别符合 FDA 批准治疗条件的患者,并促进及时制定治疗决策。
2. 全球首款兼容MRI诊断导管获批FDA
Imricor Medical Systems宣布其Vision-MR诊断导管获FDA 510(k)批准,该产品是9 Fr.电生理诊断导管,用于实时MRI引导下的心脏电生理介入治疗,是Imricor首个获FDA批准进入美国市场的产品,也标志着MRI引导电生理路径在监管层面迈出关键一步。Imricor由Steve Wedan于2006年创立,是全球首家且目前唯一能为导管消融市场提供商业化可行且安全的iCMR产品的企业,长期专注开发MRI兼容器械与系统,其技术方案核心价值在于实时高分辨率软组织成像、减少X光辐射暴露等。
3. 儿童脊柱动态植入系统获批FDA
荷兰脊柱医疗技术公司Cresco Spine宣布其Spring Distraction System(SDS™)获美国FDA 510(k)许可,用于治疗早发性脊柱侧弯(EOS)。此前,SDS™已获FDA突破性器械认定,自2015年该项目设立以来,通过510(k)路径获批且获此认定的产品占比不足0.1%。SDS™是动态、生长友好型脊柱植入系统,针对快速生长发育的EOS患者,能在控制脊柱畸形进展的同时兼顾脊柱及胸廓发育。其核心优势包括动态力学机制,契合人体生理需求;生长引导与活动保留,提升生活质量;降低治疗负担,减少对重复性延长操作的依赖。
二、欧盟及其它
1. 雅培首款磁电双能消融导管TactiFlex Duo获CE批准上市
雅培首款磁电双能消融导管TactiFlex Duo获CE批准上市,并完成首批商业手术。专家评价其独特双模态选项,允许医生根据患者需求和心脏结构无缝切换方案,降低房颤复发风险,提供持久症状缓解。雅培电生理业务首席医疗官称,该导管为治疗复杂病例提供先进工具,优化工作流程。全球多中心临床试验表明,TactiFlex Duo治疗房颤安全有效。它是雅培第二款PFA产品,作为PFA领域后起之秀,雅培正加速追赶,一年内三次获FDA或CE批准上市,且产品与前三强差异明显,首款PFA产品Volt PFA获好评。不过,因时间落后,雅培需付出更多努力,推出创新产品并提供有力临床证据。
2. 金属药物支架系统正式获得俄罗斯医疗器械注册证
威高介入集团旗下深圳市金瑞凯利生物科技有限公司自主研发的金属药物支架系统,近日成功通过俄罗斯相关监管部门审核,正式获得俄罗斯医疗器械注册证。这一里程碑标志着该产品品质与安全性获国际认可,为开拓俄罗斯及欧亚市场奠定坚实基础。威高介入坚持创新驱动,严格遵循国际质量标准,此次注册证的取得,不仅彰显了公司在体系与合规方面的实力,更体现了其服务全球医疗需求的决心。未来,威高介入将继续推动产品国际化应用,为更多医疗机构和患者提供优质服务。
3. 金属药物支架系统正式获得乌克兰医疗器械注册证
威高介入集团旗下深圳市金瑞凯利生物科技有限公司自主研发的金属药物支架系统,通过乌克兰监管部门审核,正式获得乌克兰医疗器械注册证,取得东欧市场准入资质。此次获证体现了威高介入在研发、生产与合规管理领域的综合能力,印证了其服务全球患者的承诺。威高介入秉持创新驱动发展理念,严格遵循国际质量标准,未来将继续深耕国际市场,加大研发投入,提升产品品质,以更优质安全的产品服务全球患者,为国产医疗器械走向世界、扎根全球市场筑牢根基。
4. Sirius Medical宣布磁性肿瘤标记Pintuition获CE批准上市
Sirius Medical宣布其磁性肿瘤标记Pintuition获CE批准上市,该标记此前已获FDA批准。此次CE批准不仅更新适应症,还对产品进行重大升级,包括长期植入状态、探针再消毒方案及7厘米短针头,赋予放射科团队极大灵活性,可优化临床流程,提升患者体验。Pintuition是唯一易于使用且直观、具有导航功能的无线定位技术,由导航系统、穿刺针及磁性标记物组成。导航系统内置Guided Pinpoint软件,提供实时方向指导,精度高;磁性标记物直径1.6mm、高5.2mm,可体内植入180天,提供毫米级精确引导。随着CE批准,Sirius Medical计划全球扩展业务,提供手术标记导航解决方案。
国内获批
一、创新器械获批
1. 尿路上皮癌染色体异常检测试剂盒(联合探针锚定聚合测序法)获批上市
2026年1月20日,国家药品监督管理局批准了苏州宏元生物科技有限公司的尿路上皮癌染色体异常检测试剂盒(联合探针锚定聚合测序法)注册申请。该产品采用联合探针锚定聚合测序法,对人尿液样本中的染色体臂1q、3q、7p、7q、8q、17q的重复及染色体臂9p、9q、17p的缺失进行定性检测,适用于临床可能需进一步检查的疑似尿路上皮癌初诊患者的辅助诊断。该产品由中国自主研发,属于国内首创,该产品的上市为患者提供了尿路上皮癌无创辅助诊断新选择。
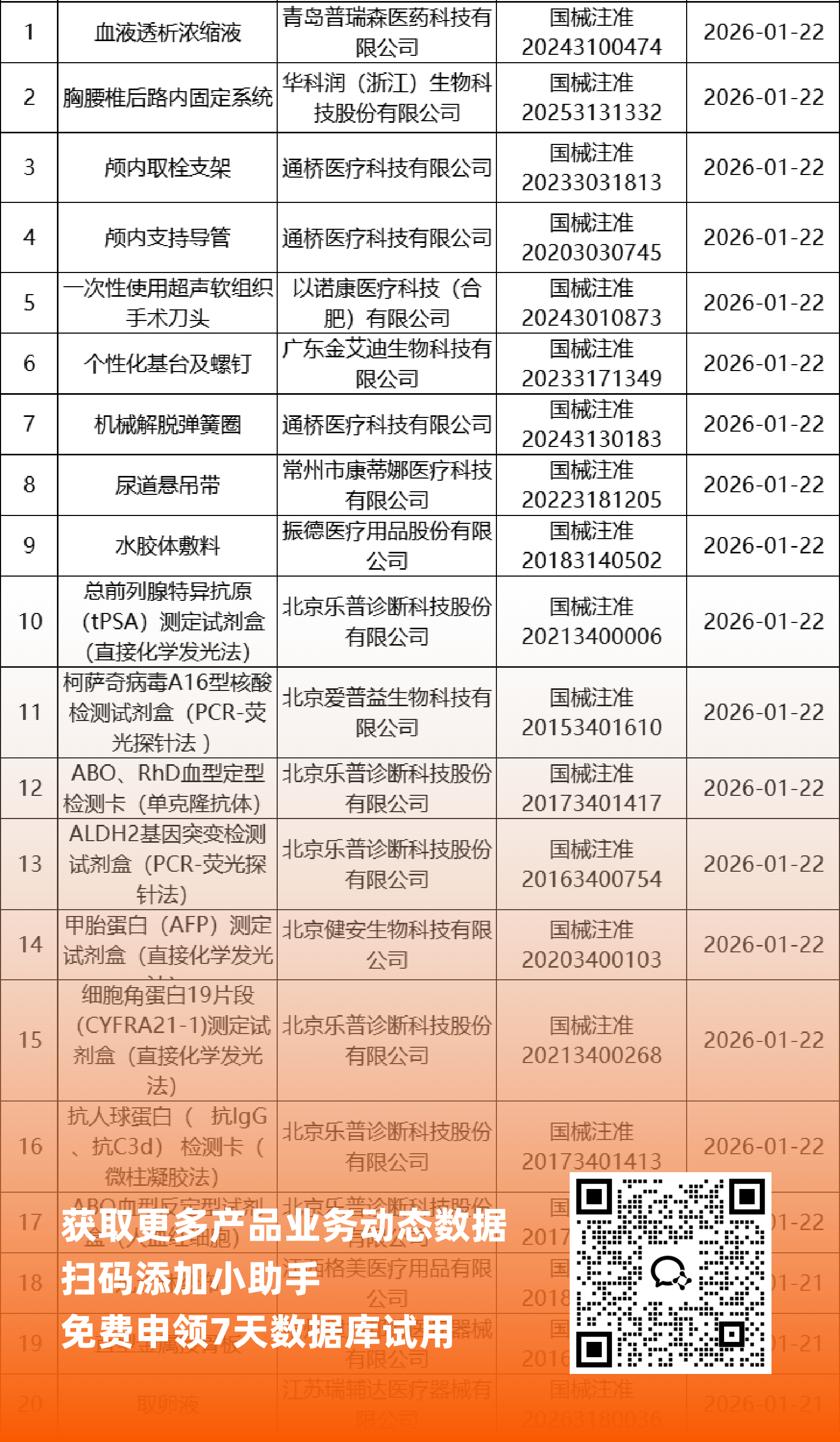
二、NMPA最新获批器械产品明细
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉智库仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。