
商务合作

动脉网APP
2026年1月30日至2月5日,动脉智库重点整理了医疗器械产品国内外获批资讯及数据,涉及3个器械获FDA批准,1个器械获欧盟及其它批准,另有411个器械获NMPA批准注册文件。
海外获批
一、FDA
1. LEADOPTIK宣布LIA™获得FDA批准用于肺活检手术
LEADOPTIK宣布其“Last Inch Assessment™”(简称LIA)系统已获得美国食品药品监督管理局(FDA)的510(k)许可。该系统是全球首个利用硅光子成像技术和软件的系统,旨在提高肺部活检的准确性。肺癌是全球癌症相关死亡的主要原因,早期诊断对生存至关重要,可显著提高五年生存率。精准且高质量的活检对于早期诊断不可或缺。LEADOPTIK的LIA系统通过将肺部活检流程数字化,并将专有的硅超材料集成到标准活检工具中,满足了这一需求。这种集成在护理点提供实时光学洞察,成像分辨率比现有技术高出50倍,从而将活检工作流程转变为基于组织智能的方法。
2. FDA批准Hologic公司的Aptima HPV检测用于宫颈癌初步筛查
Hologic已获得美国食品药品监督管理局(FDA)批准,其Aptima® HPV检测可用于宫颈癌的主要筛查工具,进一步丰富了公司在宫颈健康领域的解决方案。这一批准使医疗保健提供者能够单独使用Aptima HPV检测,而无需额外的巴氏涂片检查来识别高风险女性。该检测可发现14种与宫颈癌相关的高危型人乳头瘤病毒(HPV),并专门设计用于精准定位更有可能发展为宫颈疾病的感染。该测试运行于豪洛捷的Panther®系统,这是一款能够同时处理多种检测的自动化平台。这一进展为医疗专业人员提供了另一种资源,助力宫颈癌的早期检测与预防工作,标志着女性健康诊断领域迈出了重要一步。
3. Nanox获得FDA 510(k)许可,TAP2D新型图像增强功能适用于Nanox.ARC和Nanox.ARC X系统
NANO-X IMAGING已获得美国FDA的510(k)许可,批准了TAP2D,这是其Nanox.ARC和Nanox.ARC X数字断层合成系统的一项全新云端增强图像功能。这一批准是Nanox战略中的重要里程碑,旨在将其断层合成系统确立为主要诊断工具,提升创新医学影像解决方案的可及性。TAP2D为放射科医生提供了一个从数字断层扫描中生成的额外清晰的2D视图,旨在支持评估而不影响工作流程。该功能无缝集成到现有的临床环境中,避免为用户增加复杂性。Nanox.ARC系统已获得FDA批准,采用先进的3D成像技术,相比传统系统能够以更低的成本和更少的辐射提供更优的诊断效果。类似TAP2D的软件升级和新功能可以在监管机构批准后远程添加至这些系统。Nanox首席执行官兼代理董事长埃雷兹·梅尔策对FDA的批准表示满意,并强调了其在推动公司目标——将Nanox.ARC打造为美国独立的主要诊断解决方案——方面的重要性。
二、欧盟及其它
1. Senseonics获得欧洲批准的Eversense 365,是世界上最长持续时间的连续血糖监测仪
Senseonics Holdings, Inc.是一家专注于为糖尿病患者提供长期可植入连续血糖监测(CGM)系统的医疗技术公司,其Eversense® 365 CGM系统已获得CE标志批准。该系统是全球首个也是唯一一款为期一年的CGM,此前已于2024年9月获得美国FDA批准,并于次月在全国范围内推出。CE标志的申请符合欧盟医疗器械法规(MDR)标准,从而推动了其在欧盟市场的商业化进程。Senseonics计划在未来几个月内将Eversense 365引入德国、意大利、西班牙和瑞典。Senseonics总裁兼首席执行官Tim Goodnow强调,欧洲的批准标志着公司增长战略中的关键里程碑,将其市场扩展至超过3000万欧盟糖尿病患者。公司预计其欧洲扩张将推动收入增长,同时提供全年CGM解决方案。Goodnow还提到,预计2026年将在美国和欧洲实现商业进展,包括与Sequel的twiist™自动胰岛素输送(AID)系统在美国的整合,以及计划在下半年完成Gemini试验。
国内获批
一、NMPA最新获批器械产品明细
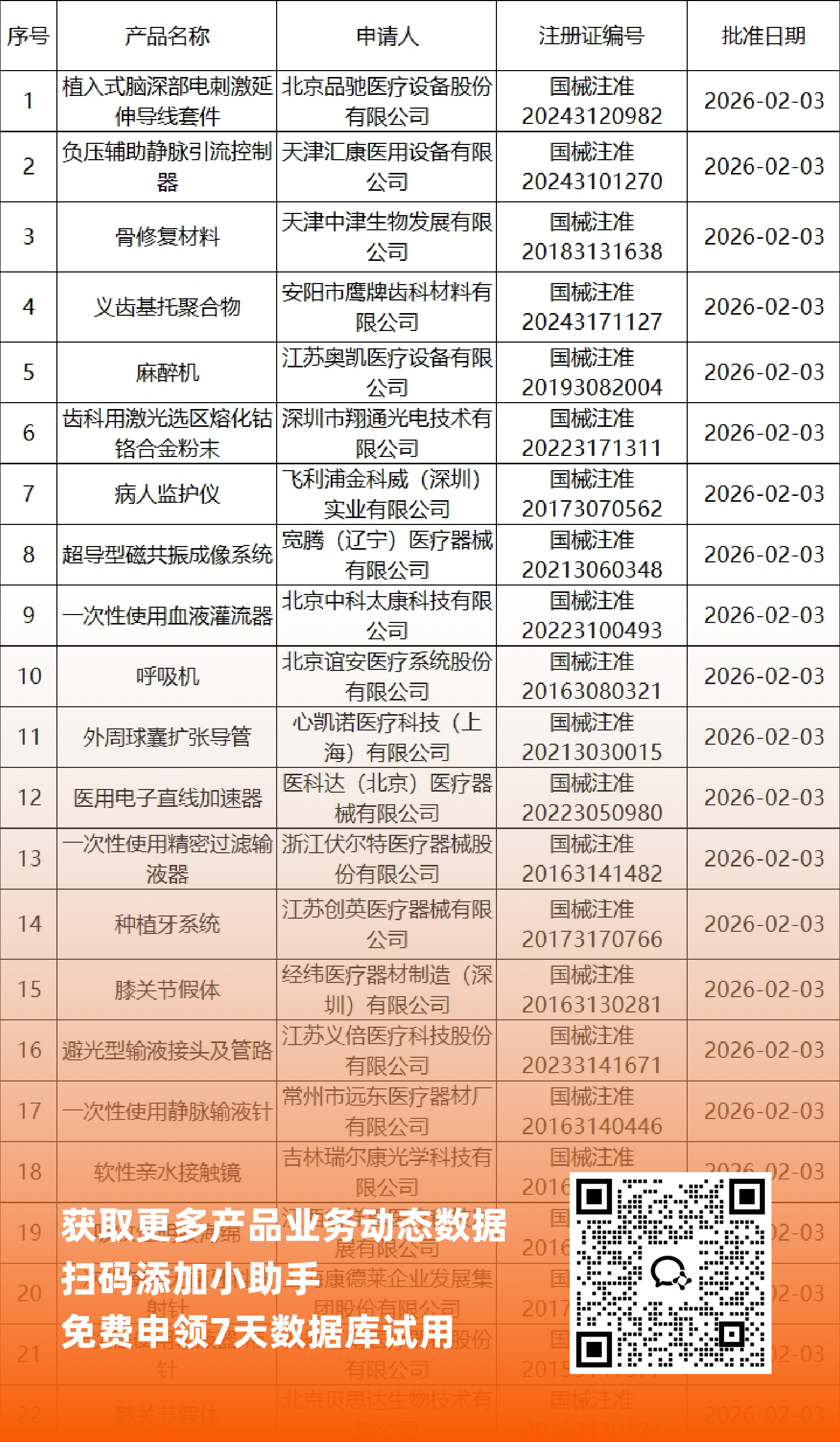
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉智库仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。