
商务合作

动脉网APP
2026年2月6日至2月12日,动脉智库重点整理了医疗器械产品国内外获批资讯及数据,涉及1个器械获FDA批准,1个器械获欧盟及其它批准,1个器械获NMPA创新产品批准,另有484个器械获NMPA批准注册文件。
海外获批
一、FDA
1. 100%开放,骨科巨头又一重磅产品获批FDA
骨科巨头捷迈邦美重磅产品G7髋臼系统获FDA 510(k)上市许可,用于髋关节置换手术。捷迈邦美通过创新与收购拓展市场,产品管线成熟。G7系统基于G7平台开发,融合骨小梁金属技术及符合解剖结构的螺钉孔分布设计,其特有的边缘固定螺钉与周缘孔洞结构,为稳定固定提供多种选择。G7髋臼杯采用元素钽制成,孔隙结构有助于促进生物固定与血管生成。公司通过解剖建模系统ZiBRA进行孔位规划,临床前测试显示系统能有效减少微动并提升稳定性,且兼容多种G7内衬。捷迈邦美计划第一季度末前全面推广,公司重建事业部总裁称其为髋关节产品线发展重要里程碑。
二、欧盟及其它
1. Insightec获得加拿大卫生部对Exablate® Prime系统的批准
Insightec是一家专注于聚焦超声技术的医疗公司,其Exablate® Prime系统已获得加拿大卫生部颁发的医疗器械许可证。该系统此前已获美国FDA批准,此次新批准将为加拿大的特发性震颤患者提供非侵入性、磁共振引导的聚焦超声治疗。Exablate Prime系统在前代基础上进行了改进,缩短了手术时间,优化了工作流程,并提升了硬件性能。系统配备了更直观的用户界面、引导式工作流程和自动规划步骤,简化了治疗过程。智能算法和改进的可视化功能为临床决策提供了更好的支持,而增强的网络安全和远程规划等功能则进一步优化了工作流程。此外,该系统现在除了兼容GE和西门子的设备外,还新增了对部分飞利浦磁共振系统的兼容性,覆盖加拿大各地的治疗中心。Insightec首席执行官兼董事长莫里斯·R·费雷(Maurice R. Ferré)强调,此次批准对于扩大加拿大帕金森病和特发性震颤患者获取先进聚焦超声治疗的重要性。
国内获批
一、创新器械获批
1. 经导管主动脉瓣膜系统获批上市
2026年2月9日,国家药品监督管理局批准了科凯(南通)生命科学有限公司经导管主动脉瓣膜系统创新产品注册申请。该产品由主动脉瓣膜、主动脉瓣膜输送系统、瓣膜装载装置组成。主动脉瓣膜由瓣膜和拉线环组成。瓣膜由牛心包瓣叶、镍钛合金瓣架、铂铱合金显影环、牛心包定位件覆膜、PET裙边,经过缝合线缝合而成。主动脉瓣膜输送系统由输送器和导管鞘组件组成。导管鞘组件由导管鞘和扩张器组 成。输送器部分导管和导管鞘表面涂覆亲水涂层。该产品适用于经心脏团队结合评分系统评估后认为患有有症状的、重度主动脉瓣膜关闭不全(重度主动脉瓣反流)、不适合接受常规外科手术置换瓣膜、年龄大于等于70岁的患者。
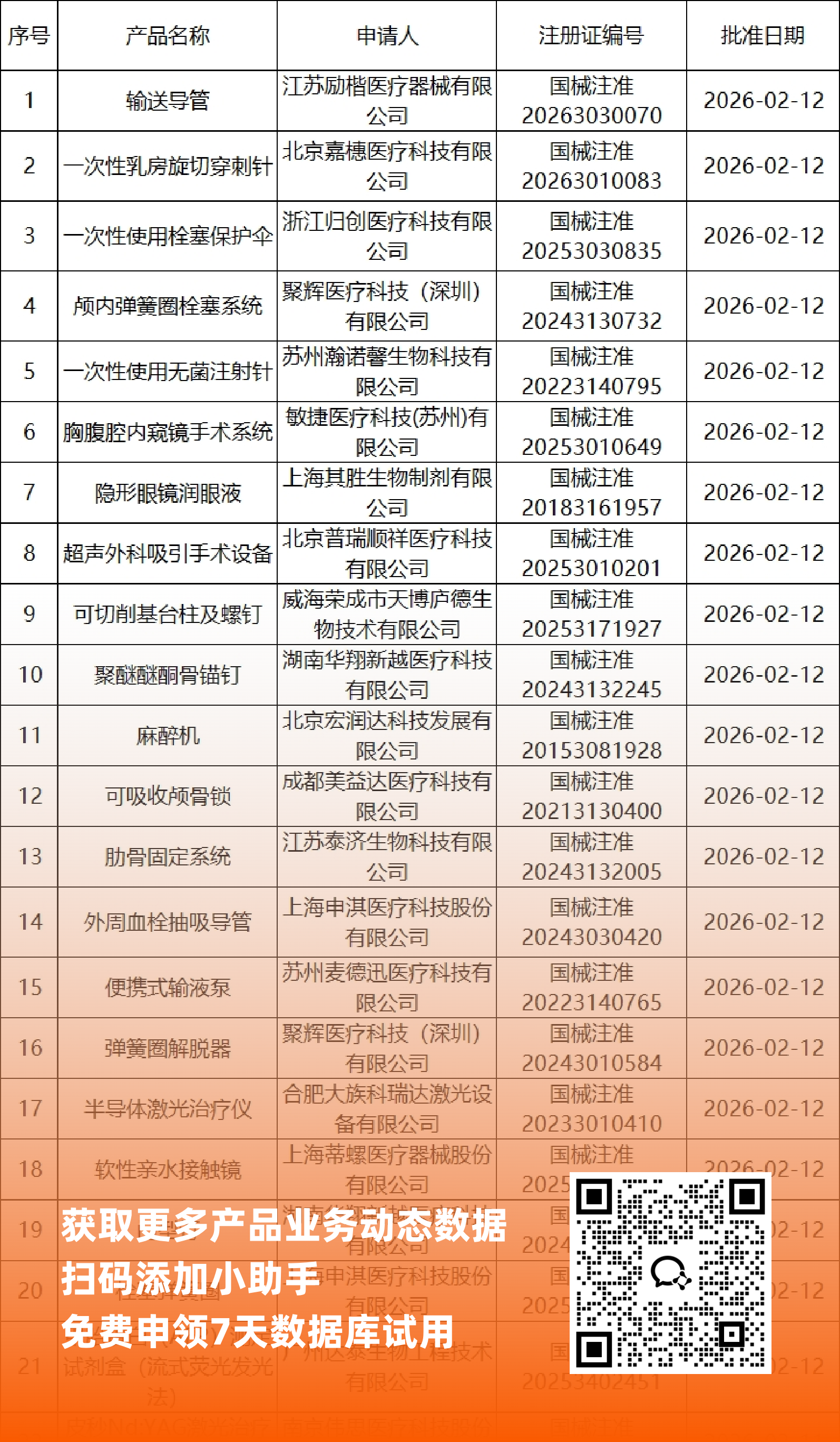
二、NMPA最新获批器械产品明细
*声明:
1.文中所有相关数据和事件信息均来自于公开渠道,包含媒体报道,企业官网,工商信息等,可能出现遗漏或错误;
2.动脉智库仅进行数据梳理和呈现,不提供任何形式的投资建议、见解或立场;
3.如需对数据纠错或进行其他相关反馈,欢迎扫描二维码联系小助手处理。