“目前很多常规化疗没有做到精准化,根据AI方法推算药物疗效来指导用药数年后可能成为临床实践的一部分。如果把研发药的大量财力、物力部分投入到对肿瘤靶向药物、化疗药物的临床用药指导领域,更多现有肿瘤患者将更快地受益。”匹兹堡大学生物医学信息系终身教授鲁兴华如此说道。
在新药研发领域,长久以来流传着一个说法,即“十年十亿美金”——研发一款新药平均需要花费超过十年时间、超十亿美金。成功研发的新药确实造福了部分患者,但是将治愈疾病的希望完全寄托在新药研发上,对于大多数患者来说无异于“望梅止渴”。
鲁兴华教授补充说道,“对化疗药物、靶向药物的精准临床应用,可以更好地发挥已经研发成功的现有肿瘤治疗药物的疗效,作为个体的癌症患者将从中受益,并提升整体癌症患者的受益率”。
而由匹兹堡大学医学院鲁兴华教授、孙旻教授以及Katherine Pogue-Geile教授领导的最新课题A Machine Learning (ML) Signature for Predicting Oxaliplatin and Bevacizumab in NRG Oncology/NSABP C-07 and C-08【验证一个人工智能(AI)临床决策系统推测奥沙利铂在指导结肠癌辅助疗效】,正是对如何精准应用肿瘤治疗药物的研究。
在今年6月召开的美国临床癌症协会(ASCO)上,该课题组公布了最新研究进展。研究显示,该系统能够准确推测在结直肠癌患者辅助治疗中奥沙利铂和贝伐单抗的疗效。这是目前唯一用大规模临床实验数据证明AI方法可以推算化疗药物疗效:即患者可以受益(或不受益于)某个化疗药物。在未来,如广泛应用于临床,该系统或类似AI方法将会显著提高结直肠癌辅助治疗的疗效并大幅度降低现行治疗方案导致的过度治疗及因其导致的不必要的毒副作用。
在行业从业者纷纷将目光投入到AI制药时,该研究结果的公布,无异于为AI的医疗应用指出了一个新的发展方向——它将让更多行业从业者清晰地意识到,AI不止于制药。将人工智能应用于临床用药辅助决策,能够为现存的肿瘤患者在内的多数患者带来更直观、可见的价值。
结直肠癌患者临床辅助化疗用药“千人一方”
AI辅助决策精准提升个体患者药物疗效
为何这项课题研究对象是结直肠癌患者?这与结直肠癌患者现状及临床用药有关。
一方面,结直肠癌恶性肿瘤造成的死亡率居高不下,且全球新增患者人数仍在持续增加。
从中国来看,《2021中国卫生健康统计年鉴》显示,在中国排位前十位的恶性肿瘤死亡率中,结直肠癌的排位从1973年的第6位上升至2004~2005年的第5位,因结直肠癌死亡的患者比例有一定幅度的增高。而根据2021年发表在《Chinese Journal of Cancer》期刊上的数据显示,结直肠癌恶性肿瘤死亡率(2009年)仅次于肺癌、胃癌,位居第三位。
从全球来看,世界卫生组织国际癌症研究机构(IARC)在2021年7月预测了未来50年相关癌症全球负担情况。预期结直肠癌患者将从2018年的新发180万例增加到2070年新发470万例。在所有癌症疾病中,结直肠癌患者新发病例预期增幅最大。
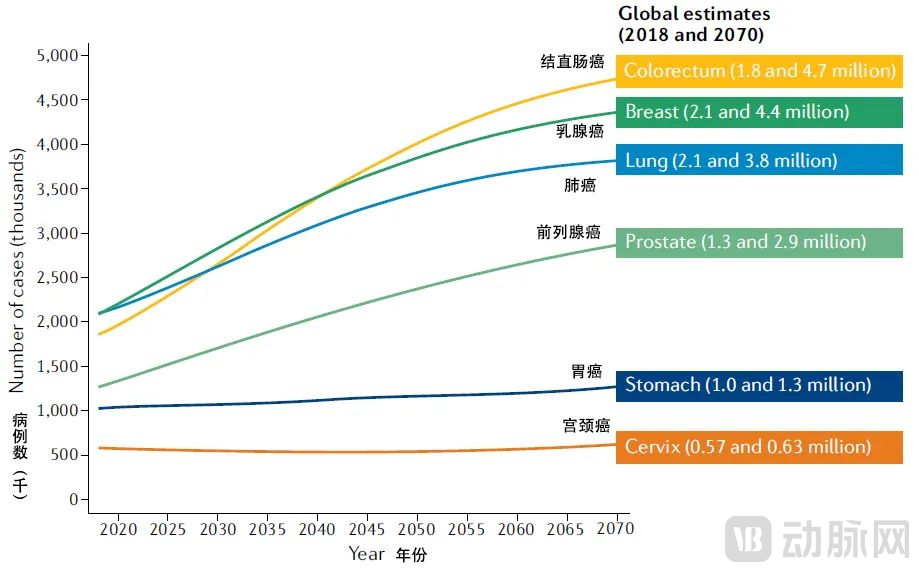
另一方面,当前日益庞大的结直肠癌患者,面临的是通用的辅助化疗方案使很多患者承担过度治疗及其带来的毒副作用的局面。
早期结直肠癌患者在接受手术治疗后通常会接受进一步的辅助化疗。当前全球通用的新辅助治疗方案是由氟尿嘧啶+亚叶酸(fluorouracil + leucovorin, FULV)再加奥沙利铂(oxaliplatin)组成的联合化疗,统称为FOLFOX方案。
与单纯手术相比,用FULV辅助化疗方案可以将5年复发率从~50% 降低到~32%。而联合奥沙利铂用药可以进一步将复发率降低到~28%(平均每100 人减少5个复发病例)。当前FOLFOX方案被纳入临床指南作为标准方案用于结直肠癌患者术后辅助化疗。问题在于,奥沙利铂本身对逾90%的患者带来了持久和严重的神经毒性副作用。对于患者来说,通过采用涵盖奥沙利铂的FOLFOX方案,避免复发的概率约5%,但是经受神经毒性的概率是90%,即意味着患者承受风险与受益本身极不平衡。
在临床中,肿瘤科医生虽然试图针对患者提供更好地用药方案,但是当前并未出现可用工具帮助医生判断个体患者是否会受益于相关化疗药物。虽然当前针对FOLFOX方案正在不断进行升级改善,以便更好地降低为患者带来的毒副作用,但是并未从根本上解决临床医生面临的难题——化疗药物没有对应的“生物指标”,无法实现精准用药。
匹兹堡大学课题组给出的解决方案——通过因果分析找到参与发病机制的基因,再用人工智能技术进行辅助分析构建反映个体肿瘤发病机制的特征值,再用AI方法推算个体肿瘤对化疗药物的响应,能够解决临床医生当前面临的针对化疗用药束手无策的局面。
课题题组采用大规模(N=1284)的三期临床实验数据(NSABP C-07 和 C-08)验证了AI系统的临床应用价值。约半数患者(N=526)被判别为奥沙利铂适应组,该组患者接受奥沙利铂治疗后,8年复发率从38.4% (FULV)降低到27.2% (FOLFOX);AI系统判别的非适应组(N=539)患者在仅用FULV治疗下已得到群体中最好的疗效(8年复发率为26.8%),添加奥沙利铂对该组患者疗效没有任何改进(8年复发率为28.3%)。“这个结果表明,对非适应组病人来说,接受奥沙利铂是过度治疗。所以,当治疗这组病人时,避免应用奥沙利铂会在保持良好预后的前提下避免过度治疗带来的毒副作用。”
针对晚期结直肠癌治疗,在FOLFOX方案基础上通常还会添加贝伐单抗,但在辅助治疗的情形下,大规模临床实验(NSABP C-08 )未能证明其在群体中的疗效。当该系统应用在C-08数据时,奥沙利铂适应组患者对贝伐单抗也有很好的响应。比较对照组(FOLFOX)和治疗组(FOLFOX + Bev),8年复发率由基础的28%降低到16%。也即针对该组患者应用FOLFOX + Bev可能进一步减少40%的复发病例。
这也意味着该系统可以准确推测奥沙利铂和贝伐单抗针对个体患者的疗效。对于全球每年新发病例高达数百万的结直肠癌患者来说,系统将帮助患者带来更好的临床预后(低复发率)并大幅度减少不必要的过度治疗及因过度治疗带来的毒副作用。
临床应用指导结直肠癌患者辅助治疗用药
引领人工智能精准临床用药决策“风口”
对孙旻教授、鲁兴华教授来说,该课题创新点有两个。一是针对结直肠癌患者治疗方案的革新;另一个则是将AI用于临床化疗用药辅助决策方面的创新。
首先,针对结直肠癌患者治疗方案的突破,与该课题研究本身息息相关。相对于业界同行的研究,研究的亮点主要呈现在以下几个方面:
一是入组患者人数数据上的优势。该研究共采纳了1200余名临床实验参与者入组数据,入组患者数据量的庞大是以往其他同类研究少见的。大数据增强了结果的可信性。而提高结直肠癌这个常见癌症的治疗效益会改善许多患者的生活状况。
二是该系统是目前在结肠癌领域中唯一的“疗效预测生物标志”(predictive biomarker), 而以往大多系统指标应用的是“预后生物标志”(prognostic biomarker)。 两者的不同在于“疗效预测标志”可以推测一个病人是否会对一个药物响应(是否受益)。这类标志是指导精准用药的最佳指证。而“预后标志”是用来推测在接受同样治疗时,根据标志分组的病人是否有不同的预后。但这一类生物指标不能确定这种预后的差异是否源于病人对治疗的不同响应。有时预后生物标志可能会探测到和治疗响应无关的信号,此时病人组之间的预后差异在接受不同治疗时依然会保持。
孙旻教授与鲁兴华教授在采访中指出,该课题将把因果方法学、贝叶斯因果网络、机器学习应用其中,通过因果论算法发现结直肠癌肿瘤基因的突变致病因素,进而找到了反映细胞功能状态的生物标记。通过该系统可以极大简化需要识别的基因数据,实现针对患者是否会对药物产生响应的预测——能够明确告知临床医生某药物对于患者来说是否真的能够获益。
更重要的是,以往谈及癌症精准医学,往往被局限在靶向药物内。但是靶向药物存在一定局限。从总体上来看,能够受益于基因驱动的癌症精准医疗的靶向药物治疗患者比例还是较低。大多数癌症患者仍需化疗。许多大规模基于细胞株或类器官的药理基因学(pharmacogenomics)研究实验证明绝大多数癌细胞可能被多种化疗药物抑制或杀死。临床精准的化疗药物用药指导将为患者带来更大收益。但是问题仍旧存在,如何实现为每一个肿瘤疾病配对有效药物。
匹兹堡大学的这次研究证实了将AI用于临床化疗辅助决策方面的可行性。这是该课题研究背后的价值与意义。“用大规模临床实验数据,我们证明了化疗药物可以采用人工智能的方式实现适应人群的筛选。这个先例成立的话,从业者可以相信,针对其他临床用药,也可以采用人工智能的方式进行指导。将来,整个化疗治疗领域,前景可能发生重大转变。”孙旻教授如此说道。
两位教授总结道,“在结肠癌辅助化疗中,判断现在指南内哪款药物有效、无效依然是一个相对特殊的医疗场景。未来,如何针对不同患者组合不同药物,为患者提供最好的疗效及最少的毒副作用,将成为医药领域研究的重点。只要在癌症治疗临床用药AI指导方面,有一个成功案例出现,它就意味着突破,意味着局面的打开,而最终受益的患者将不计其数。”
据悉,目前,该团队也正在和北京美中爱瑞肿瘤医院和其他肿瘤中心开展科研合作,推动AI在临床决策支持领域的发展。
关于两位教授的简介资料

鲁兴华教授,匹兹堡大学生物医学信息系终身教授。他曾任美国国立大数据到知识(Big Data to Knowledge)中心项目负责人。鲁兴华教授有广泛的生物医学科研经验,贯穿基础、临床、人工智能、信息学;他也有丰富的产学研转化经验。其科研成果发表在多领域的主流杂志。其课题组主要开发人工智能方法促进基础研究、转化医学和临床决策支持。课题组目前把因果方法学、贝叶斯因果网络、深度学习应用到癌症的基础和转化研究。其课题组曾得到过多项NIH课题资助;也曾获得UPMC(匹兹堡大学医学院附属的学术医学中心)的资助,开发指导肿瘤免疫学治疗的人工智能产品。

孙旻教授,医学博士(MD) 、生物学博士(PhD);匹兹堡大学医学院助理教授;UPMC肿瘤科、血液科医生。孙旻教授目前代表UPMC在北京美中爱瑞肿瘤医院项目担任首席医疗官。其从事肿瘤专业临床和研究二十余年,对乳腺癌、消化道肿瘤以及其他常见肿瘤均有丰富的经验和造诣。目前其已获得美国内科学委员会血液学、肿瘤内科学等专业认证。
补充介绍:关于北京美中爱瑞肿瘤医院(以下简称为“美中爱瑞”)
美中爱瑞致力于肿瘤诊疗领域技术前沿,与UPMC(匹兹堡大学医学院附属的学术医学中心)建立了深度合作,共建国际远程会诊中心,为患者联合制定诊疗方案。美中爱瑞药物临床试验机构于2021年1月成立,2021年8月首次完成国家药物临床试验机构(GCP)备案,并于2021年11月通过了现场核查,可承接I期、II期、III期、IV期抗肿瘤药物临床试验项目,研究的方向主要为实体瘤的治疗。目前,美中爱瑞已就AI系统指导临床决策的研究与发明单位达成初步合作计划。




























