神经退行性疾病是当前存在重大未满足需求的医疗领域之一。帕金森病、阿尔茨海默病、亨廷顿舞蹈症等神经退行性疾病发病复杂,目前无法治愈,甚至能够有效减缓疾病进展的手段都极少。随着老龄化进程的加快,神经退行性疾病已成为日趋沉重的医疗和社会负担。
近年来,众多科学家勇攀神经退行性疾病治疗“险峰”,已有大量研究发现,神经退行性疾病发生发展过程中,会有大量神经元丢失。科学家们因此提出猜想:“对神经元进行再生是否会成为治愈神经退行性疾病的曙光?”
一般来说,神经元损伤或丢失之后,无法进行修复或再生,但近年有越来越多科学家尝试将体外和体内星形胶质细胞直接转分化为神经元。自2010年起,世界各地不同实验室不断验证了体外和体内星形胶质细胞向神经元的直接转分化,通过病毒载体过表达神经转录因子是绝大多数研究者采用的方式。这也让细胞转分化成为热点研究领域,从山中伸弥2006年首次报道iPSC至今,细胞转分化领域已有10余年发展历史。
2013年,陈功团队首次报道用单个神经转录因子NeuroD1实现大脑内胶质细胞原位转分化为神经元。随着陈功团队在多个神经系统疾病模型上成功实现功能修复,NeuroD1所介导的原位转分化再生神经元的新技术也在神经科学领域和生物医药界被广泛关注。

陈功教授
近年来,张春立团队也提出了一些不同的观点,质疑NeuroD1、PTBP1等一些途径介导的转分化。但我们发现,Ling Wei、Alex Chubykin、Jenny Hsieh等多位国际学者都曾先后重复过NeuroD1的实验,证明NeuroD1可诱导星形胶质细胞原位重编程为神经细胞。2022年3月,美国基因治疗协会上任主席Beverley Davidson实验室用谱系示踪小鼠成功验证了NeuroD1介导一定程度的转分化。
随着越来越多研究者参与研究,NeuroD1所介导的原位转分化再生神经元技术的价值将得到有力验证,事实将愈辩愈明。
近日,NeuExcell Therapeutics创始人,暨南大学粤港澳中枢神经再生研究院陈功教授团队在bioRxiv上发表题为“Enhancing NeuroD1 Expression to Convert Lineage-Traced Astrocytes into Neurons”的文章,指出了其它团队未能实现转分化的原因,提供了双光子活体成像观察到体内星形胶质细胞直接转化为神经元等有力证据,扫清了转分化领域的疑云,为该技术的临床应用奠定了更加坚实的基础。

此项研究是首次对NeuroD1诱导的星形胶质细胞向神经元原位转分化的系统性分析,运用一系列不同启动子,在一系列不同滴度下,并在一系列不同基因背景的小鼠脑子里,从不同角度证明了星形胶质细胞可以原位转分化为神经元。
针对此前一篇Cell论文报道的神经元“泄露”现象,陈功团队构建了三种AAV载体,通过星形胶质细胞(Astrocyte)特异的GFAP启动子驱动绿色荧光蛋白(GFP)的表达,在小鼠大脑皮层测试了1011、1012、1013 GC/ml 三种不同滴度。实验发现无论使用哪种启动子,在1013 GC/ml的高滴度下均出现了严重的神经元泄露现象;但是在1011 GC/ml、1012 GC/ml滴度下都保持很高的星形胶质细胞特异性,很少有神经元泄露。因此,Cell论文中基于>1013 GC/ml高滴度产生的神经元泄露而全面挑战原位转分化技术的结论是不可靠的。
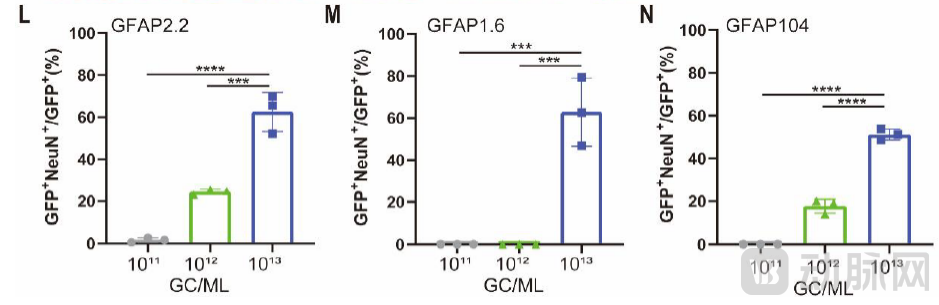
高滴度AAV引起剂量依赖性神经元渗漏
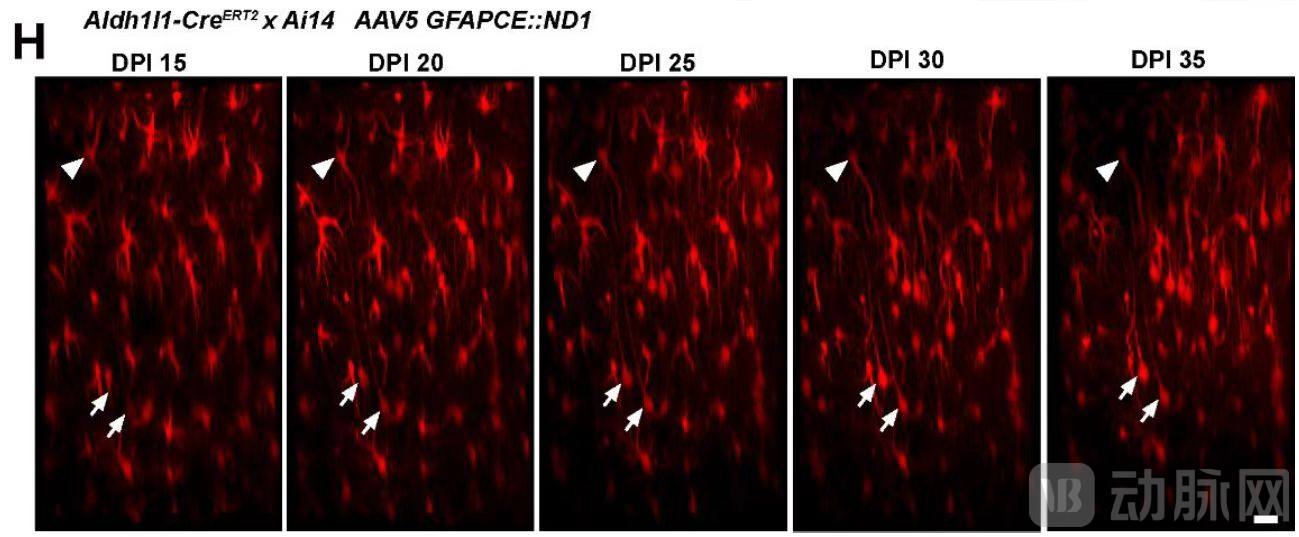
针对Cell论文中未能将谱系示踪的星形胶质细胞转分化为神经元的失败结果,陈功团队分享了一些研究诀窍,即“谱系示踪的星形胶质细胞比正常胶质细胞更难转分化,需要用增强子来加强NeuroD1的表达才能够克服转分化的阻力,实现原位神经再生”。陈功团队首先证明NeuroD1介导的转分化呈剂量依赖效应,也就是NeuroD1的表达水平越高,转化效率就越高。为了避免使用高滴度病毒,陈功团队设计了在GFAP::NeuroD1 的载体中引入CMV enhancer 来加强NeuroD1的表达,成功地将谱系示踪的星形胶质细胞(Aldh1l1-CreERT2xAi14)转化成为神经元。
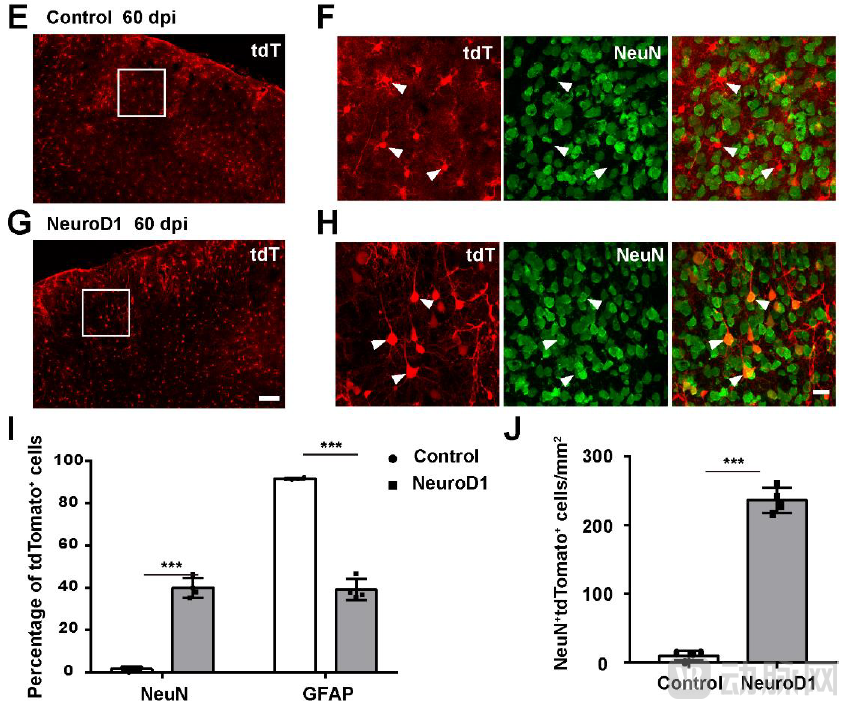
用CMV enhancer增强NeuroD1的表达可以提高谱系示踪的星形胶质细胞到神经元的转分化效率
更进一步的是,陈功团队又运用双光子活体成像技术直接捕捉到了小鼠大脑皮层里的星形胶质细胞一步一步地逐渐转化为神经元的动态过程,而且再次在谱系示踪的转基因小鼠上观察到事先标记的红色星形胶质细胞逐渐收缩起很多细小的分枝,转化成了红色的有顶树突的神经元。至此,陈功团队构建了多种AAV载体,在多种基因遗传背景的小鼠上都实现了星形胶质细胞向神经元的转分化,有力地证明了星形胶质细胞向神经元的转分化的事实,也为此前其他团队无法实现转分化提供了一些参考。
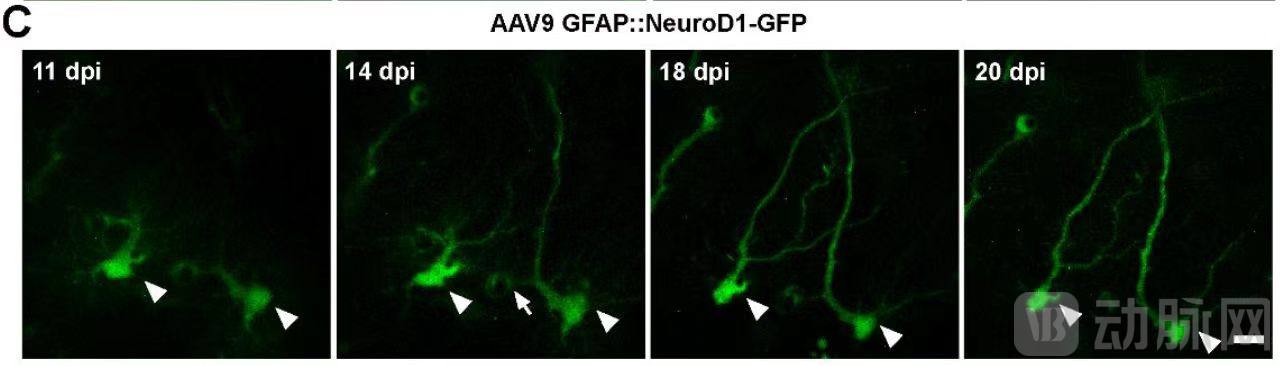
双光子活体影像图片
这段视频展现的是双光子活体脑影像观察,红色谱系示踪的星形胶质细胞在表达了 NeuroD1 后15天时大多还是胶质细胞形态,但到了第35天时则有许多转化成了红色神经元。
毫无疑问,陈功团队提出了清晰的转分化过程,为整个转分化领域指明了方向。他们指出,转分化的前提应该是首先在星形胶质细胞的细胞核里检测到神经转录因子的表达,然后观察到这些胶质细胞发生形态学变化,并且逐渐失去胶质细胞特异的标志物,同时逐渐获得神经元特异的标志物,先转化为未成熟神经元,再进一步分化成熟。通常在转化的神经元里也能够检测到转录因子的表达。如果没有转分化,神经转录因子是不可能从胶质细胞的核里跳到神经元的核里去的。
在文章的讨论部分,陈功团队分享了其在细胞转分化领域10余年的宝贵经验,总结了转分化领域对于神经元泄漏的误解,指出因为AAV会同时感染神经元和胶质细胞,因此,当注射大量AAV进行胶质细胞转分化时,神经元泄漏是不可避免的现象,大家能做的是尽量降低泄漏的比例,增加转分化的比例。
更重要的是,胶质细胞原位转分化的目的是要再生神经元,治疗因为神经损伤而导致的疾病。因此,陈功团队告诫大家不要向正常的大脑里注射大量的病毒去做转分化,那样势必把正常的胶质细胞变成多余的神经元,只会打破正常的神经-胶质平衡。真正有意义的转分化应该在神经损伤和退行性病变的组织里将应激性胶质细胞转化为功能性神经元,重构神经环路,修复大脑,造福人类。
此外值得注意的是,近期工业界也证实了NeuroD1转分化的可行性:与NeuExcell合作的Roche旗下成员、基因治疗领域先驱Spark Therapeutics在亨廷顿小鼠模型成功独立重复出原位转分化的结果。
作为具有划时代意义的技术,神经元原位转分化的前景值得期待,接下来,需要更多科学家、临床医生在临床进一步验证该技术。陈功教授参与创立的NeuExcell作为神经再生基因疗法企业,正在基于陈功教授团队研发的利用脑内丰富的星形胶质细胞直接转化为功能性神经元进行大脑修复的平台技术,开发治疗脑中风、阿尔茨海默症、帕金森病、创伤性脑损伤,以及脊髓损伤和渐冻症等众多重大脑疾病的创新疗法。
整体来看,神经原位转分化技术在全球还处于早期阶段,以该技术为核心的基因治疗公司还较少。未来,陈功教授团队和NeuExcell将永远秉持初心,持续深入探索神经元原位转分化技术,以造福广大患者为宗旨,砥砺前行。
陈功教授团队发表在bioRxiv上的原文链接:https://www.biorxiv.org/content/10.1101/2022.06.21.496971v1




























