近年来,许多生物科技公司凭借机器学习和药物发现的组合,在市场中赚取了大量资本。但有一家公司另辟蹊径,在寻找人类基因组暗物质方面脱颖而出。
Nucleome Therapeutics是一家成立于2019年的英国公司。它从牛津大学分离出来,旨在寻求通过解码人类“黑暗”基因组,来创造精准药物。
动脉网近日获悉,该公司现已完成了4240万美元的A轮融资。此次融资由新投资者M Ventures领投,Johnson and Johnson Innovation、Pfizer Ventures、British Patient Capital、Oxford Science Enterprises跟投。
Nucleome Therapeutics官网透露,早在2020年6月,Nucleome Therapeutics就从creative destruction lab 获得非股权援助,具体金额并未披露。
Nucleome Therapeutics由牛津大学基因调控专家创立,并得到了牛津科学创新公司的投资支持。
学术创始人Jim Hughes是牛津大学的基因调节教授。他利用实验、计算和机器学习等技术方法,从功能上解释非编码基因组在人类疾病中的作用。
学术创始人James Davies是牛津大学的副教授。他擅长利用基因的测定和计算,来理解基因组是如何运作的。此外,他还是一名重症监护医生。
与前两位学术创始人一样,Nucleome Therapeutics的首席执行官、学术创始人兼执行主任Danuta Jeziorska,在基因调控、3D基因组分析和生物信息学方面拥有深厚的专业知识。她获得了系统生物学博士学位和生物技术学士学位。目前,Danuta 是BIA基因组学咨询委员会的成员,并在牛津大学担任荣誉职位。
此外,她还是一位经验深厚的生物技术企业家。她在该领域拥有超过16年的工作经验。为了表彰她在Nucleome的成就,科学杂志《自然生物技术》授予Danuta 荣誉称号——生物技术领域的杰出领导者。
本轮融资前,在三人的领导下,该公司已经筹集了580万美元的种子轮资金,组建了一个约20人的团队。

人类基因组(DNA)包含30亿个碱基对,其中,2%为蛋白质编码基因,大约20000个碱基对。这些基因编码区域的潜力在制药领域中得到了开发。98%为非编码基因,我们称为“黑暗”基因组。
“黑暗”基因组具有调节、控制基因表达的作用。它就像指令处理器一样,在正确的时间和级别上打开、关闭基因。这使我们的遗传密码能够转化为数百种细胞类型。而这种处理机制的失调则可能导致进化改变或人类疾病。
事实上,大多数与疾病相关的基因变化都位于“黑暗”基因组中。包括多发性硬化症、狼疮、类风湿性关节炎等的基因变化。
然而,“黑暗”基因组在很大程度上仍未被探索。解码“黑暗”基因组的目的是,发掘出变异调节、基因、细胞类型对基因表达产生的积极或消极影响。这为药物的发现和开发提供了一个重要的机会。
Nucleome的业务逻辑是,利用3D基因组技术与机器学习,发现与疾病有关的基因,最终找到可药用的候选基因。
Nucleome先是使用机器学习和计算基因组工具研究了超过 350 万个遗传变异基因。其中涵盖 20 多种不同的免疫细胞类型。这个研究让Nucleome能够了解,哪些变异可以影响基因组中“黑暗”区域的表达。为了促进变异优先级排序以及对这些数据的探索,Nucleome从细胞类型、表型、变异和GWAS研究的角度,建立了专有的数据库“Lantern”。
2021年5月,Nucleome在《自然》杂志上发表了一种新型的3D基因组分析方法。该方法被称为Micro Capture-C(简称“MCC”)。这项技术允许团队从三维角度,观察DNA在细胞中的折叠情况,帮助解开“黑暗”区域的基因变体。
MCC从化学交联开始,先使用微球菌核酸酶(MNase),随机切割相互作用的DNA片段(DNA交联)。接下来使用另一种类型的酶,重新连接DNA。然后将DNA去交联并提取。由于相互作用的DNA连接在一起(反映3D而不是线性结构),因此可以大规模生成全基因组的3D相互作用图谱。Nucleome用这种方法破译“黑暗”基因组。
高分辨率
The chromosome conformation capture(染色体构象捕获方法,简称“3C”),用于检测DNA序列之间相互作用的频率。该方法在过去十年中彻底改变了基因检测的发展。
疾病相关的变异通常只是50-1,000碱基对大小的调节元素中,单个碱基对的变化。并且这些变异通常被其他功能元素和多个基因包围。因此“黑暗”基因组的检测需要在DNA水平上精确定位。然而,3C方法在碱基对精度上,还未达到能解开“黑暗”基因组秘密的分辨率水平。
与目前可用的 3C 方法相比,包括 Hi-C2、Micro-C3-5、 Hi-C6、4C7 、(NG) Capture-C8,MCC达到了更高的分辨率。
MCC能够以单个转录因子的分辨率,确定调控元件之间的物理接触。这是通过结合 NG Capture-C8 方法的五项进步来实现。该方法的分辨率平均提高了 256-1000 倍。
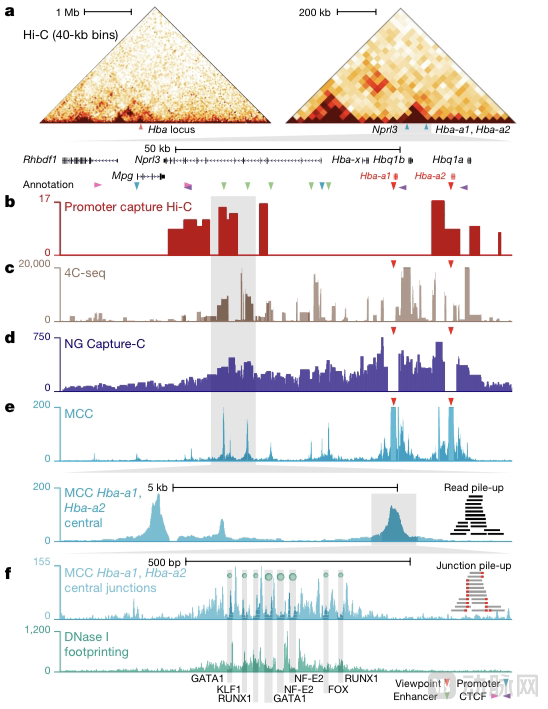
MCC与其他3C技术在红系细胞中的比较α-珠蛋白基因(Hba-a1和Hba-a2)的启动子表明MCC提供了显着提高的分辨率
Nucleome的平台能够非常精确地处理原生细胞和患者衍生细胞——以平均256 bp分辨率确定细胞内的大规模3D基因组结构,并以前所未有的1 bp精度确定其发明的MCC方法。这达到了目前单碱基对精度的最高点。
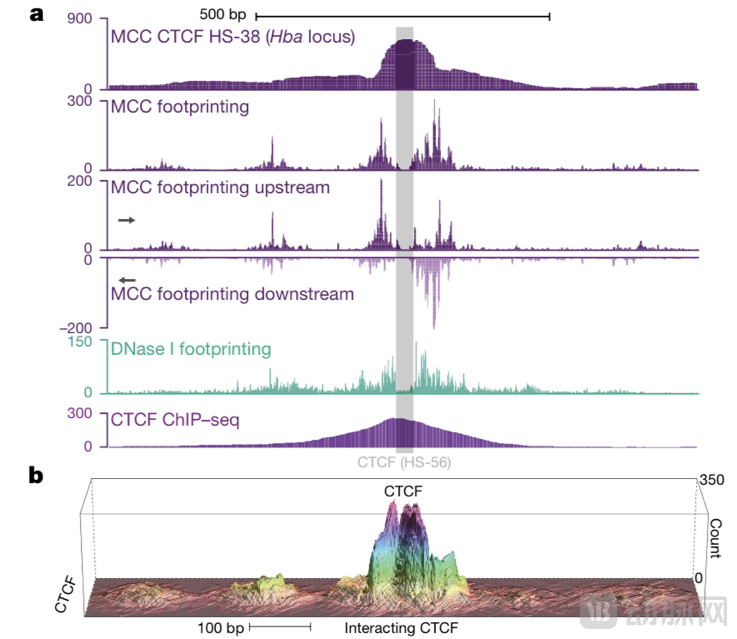
MCC连接的单碱基对分辨率分析
自新冠疫情爆发以来,世界各地的研究团队一直在人类基因组中,寻找有助于个人应对新冠肺炎的易感性和严重性的遗传信号。之前的工作已经确定了,3号染色体上的一段DNA使65岁以下成年人,死于新冠肺炎的风险翻了一番。然而,科学家们并不知道这种遗传信号如何增加风险,也不知道其导致的确切遗传变化。
60%的南亚血统人类、六分之一的欧洲血统人类携带这种高风险遗传信号。这解释了部分英国社区的死亡人数过高以及新冠肺炎在印度的影响。
2021年11月5日,Nucleome Therapeutics的学术创始人James Davies在《自然遗传学》上发表了一篇论文,确定了一种可能使新冠肺炎死亡风险翻倍的基因。
研究人员使用Nucleome的平台来识别致病基因变异、所涉及的细胞类型和效应基因。他们将识别出的可能负责的基因,称为LZTFL1。Nucleome阐明了在当前疫情中最重要的COVID-19的生物学机制。
James Davies教授说:“带来更大风险的遗传信号位于我们所谓的基因组暗物质中。这种‘黑暗’基因组,调节细胞类型特异性基因表达,并且在很大程度上仍然未知。通过使用Nucleome的Micro-Capture-C技术,我们能够精确定位该基因。更高水平的LZTFL1可能会阻止气道和肺部的细胞正确对抗病毒,但重要的是,它不会影响免疫系统,因此携带此基因的人可能会从疫苗接种中受益。”
Nucleome Therapeutics不是唯一一家希望开创黑暗基因组空间的公司。总部位于马萨诸塞州剑桥的CAMPB4 Therapeutics于2021年7月在B系列融资中筹集了1亿美元,用于其针对监管RNA的平台,该平台同样致力于解码“黑暗”基因组。
与此同时,另一家总部位于剑桥的Omega Therapeutics正在利用类似的方法,开发一类新的可编程mRNA的表观遗传药物。该公司的目标是,在无需基因编辑或基因治疗的情况下,扭转基因表达。
新晋的Nucleome Therapeutics以其最新的MCC技术斩获解码“黑暗”基因组市场的一席之地。但面对旗鼓相当的竞争对手们,Nucleome Therapeutics未曾松懈。
Nucleome Therapeutics将利用A轮的融资推进公司的自身免疫性疾病项目,促进其“黑暗”基因组图谱的扩展。此外,它还将进一步发展其开创性的平台,寻求与大型制药公司建立合作关系。
此次领投的M Ventures负责人Bauke Anninga博士评论说:"Nucleome的差异化平台技术有可能从根本上改变我们发现和开发精准药物的方式。释放基因组中大部分未开发领域的价值,可导致识别高价值的药物目标。Nucleome的平台将三维基因组信息添加到大量可用的基因组数据中,它们发现了一个新的信息维度,即疾病以及特定细胞类型。"
我们期待Nucleome能够继续推进它们的药物发现计划,在未来为患者带来变革性的治疗。





























