近年,NGS当属顶流,随着NGS技术的逐渐成熟、进入临床专家的视野到被接受,当前,诸多NGS下的MRD检测产品进入临床应用研究阶段。从血液瘤到实体瘤,从单癌种到泛癌种,MRD检测在近年变热,行业指南共识、产业合作动态的频次加快,诸多前瞻性研究轮番推进。
然而,放眼国内外,NGS下的MRD检测技术路径并不统一,不同于前两年各家在推新的方法学,现在多是用很稳定的方法学做临床场景的价值输出、临床有效性的验证,临床之战即将打响。同时,院内LDT试点正式实施,这一模式将给企业带来哪些机遇和挑战,未来走向如何?
本文重点探讨NGS下MRD检测行业的技术发展,通过调研12家企业,近18位专家,对MRD检测技术发展与商业化展开分析,并得出以下结论:
MRD检测相关的干预性研究正在进行,或将改变临床指南和治疗格局。目前,作为围术期治疗效果和复发监测的重要手段、MRD检测辅助治疗的临床意义不断被证实。但是,从“证明有效”到“如何干预”才是解决临床问题的关键。比如,基于MRD检测结果如何调整治疗方案,是否加药、换药、用药时间如何安排等,临床医生开始探索MRD作为生物标志物进行临床干预性的研究。
当前,有多个MRD检测相关的干预性研究正在进行,如CIRCULATE-US、COBRA、CIRCULATE-Japan、DYNAMIC-III等,这些研究或将改变现有的临床指南和治疗格局。
突变+甲基化等的联合检测是未来发展方向,联合判读仍是挑战。毋庸置疑,突变是目前主流的检测方式,然而,单一的检测可能不够全面,甲基化的信号比较集中,为检测提供了比较强的信号簇,在低频的ctDNA中灵敏性和特异性更高,是2022年发表的《肿瘤特征》专刊里重点提出的一个新的特征。
突变+甲基化的联合检测或可提高检测性能,也是目前国内外在技术创新上主要探索的方向,而联合检测的结果判读还需要更多的底层生物学研究才能突破。
能进入试点医院开展的LDT项目将具有先发优势,但LDT试点不是终点。虹吸效应下,这一阶段的LDT试点医院及合作企业或将集中在头部,能和试点医院合作的LDT项目将具有先发优势,不论是在数据上还是品牌影响力上都将给企业带来益处。
长期来看,一旦LDT政策运转成熟,新项目进入LDT目录或是项目开展的必要条件。但LDT试点并不是终点,临床需求和IVD导向下的退出机制将鞭策企业注重研发、提升产品能力,新的模式下,LDT的规范性将进一步加强。
概况:产业合作动态密集,近年复合增长率为66.6%
MRD这一概念已有十几年,最初用于血液系统恶性肿瘤,即白血病和其他血液以及淋巴系统疾病,定义为微小残留病灶(Minimal Residue Disease)。随着实体瘤基于ctDNA—MRD的临床数据越来越多,分子残留病灶(Molecular Residue Disease)的概念被更多人认可。
MRD动态监测贯穿于肿瘤精准诊疗的全过程,其主要应用场景分为辅助治疗决策、预后评估、术后复发监测、免疫治疗疗效监测、临床试验替代终点、基于新辅助治疗反应的手术决策以及临床试验受试者入组筛选。其中,预后评估、辅助治疗决策以及术后复发监测是MRD动态监测的主要应用场景,具体如下图:
MRD动态监测在肿瘤精准诊疗的作用
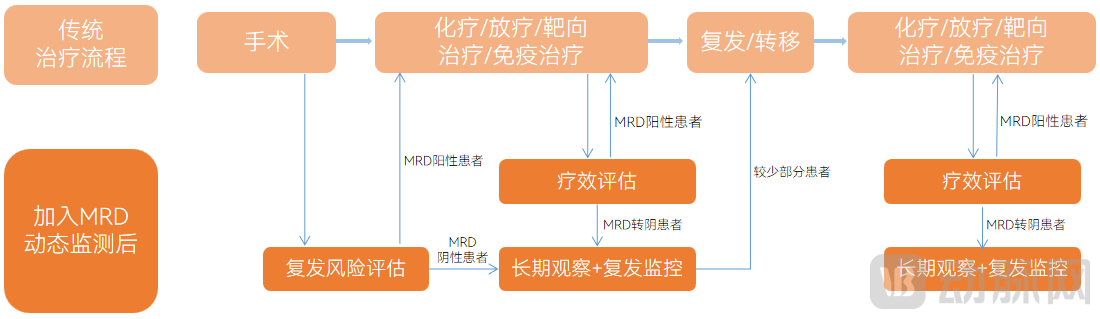
图片来源:头豹研究院
国外研究表明,MRD动态监测技术能够比传统的CT影像学更早鉴定出疾病复发风险,在不同的癌种中,具体的提前时间约为:乳腺癌10.7个月,胰腺癌6.5个月,肺癌5.2个月,结肠癌11.5个月。
基于伴随诊断行业的不断成熟,精准诊疗的应用有所延伸。从早筛到MRD检测、伴随诊断,肿瘤精准诊断覆盖了全周期。不同于伴随诊断,MRD检测和早筛对检测的要求
更高,同时,他们针对的人群、治疗阶段、目的、技术要求等方面有差异。具体如下:
伴随诊断、MRD检测、早筛的区别

图片来源:蛋壳研究院
MRD检测在血液瘤上的应用相对成熟,在实体瘤上方兴未艾。血液瘤方面,国外,2018年9月,Adaptive Biotechnologies的clonoSEQ获FDA批准,用于进行急性淋巴细胞白血病(ALL)或多发性骨髓瘤(MM)患者的MRD检测,并于2019年1月纳入Medicare的医保。
国内,2021年4月,CDE开始就血液瘤的相关应用拟定《多发性骨髓瘤药物临床试验中检测微小残留病的技术指导原则》,同年11月发布正式稿,血液瘤MRD检测产品的临床标准愈趋完善。
实体瘤上,MRD检测开始探索应用的时间主要为近5年,整体处于临床研究阶段,方兴未艾。MRD检测在实体瘤上的发展以NGS的发展为源动力。其中,重大事件上,国外以Natera和Guardant Health公司的获批为代表,国内以指南共识为代表,具体如下:
MRD检测行业在国内外实体瘤领域发生的重大事件
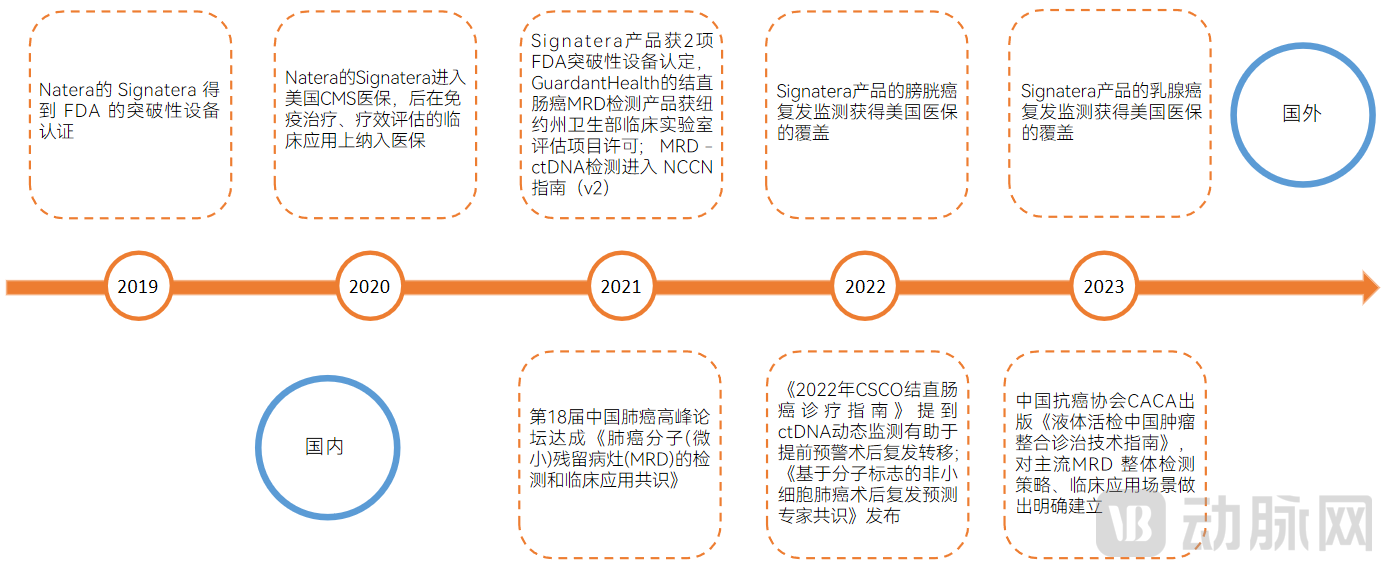
图片来源:蛋壳研究院
整体来看,从2020年开始,MRD检测行业在国内外逐渐热起来。随着临床成果发表、产品发布、企业合作,多个不同维度的产业动态陆续登场。
国外,2020年5月,阿斯利康与Invitae(ArcherDX)合作开发个体化肺癌检测方法;2021年1月,Grail宣布与安进、阿斯利康、百时美施贵宝达成合作,评估癌症早期检测技术;同年2月,Analytics分子诊断公司ExactSciences宣布收购测序实验室Ashion。
国内,2020年10月,泛生子与艾沐蒽在加速血液瘤MRD的产品化上达成合作,11月,臻和科技宣布其MRD检测产品朗微博上市,这是国内首个用于肺癌的商业化MRD检测服务;
2021年5月,世和基因在《Journal of Hematology & Oncolology》上发布了国内首个多中心前瞻性肠癌MRD研究结果,6月,Natera与华大基因独家合作将Signatera引入中国。
MRD检测行业在国内火热始于2020年下半年,不同于伴随诊断,MRD检测的技术要求更高、进入壁垒更大,头部效应明显。目前,已有3家IPO,多集中在C轮及以后,A轮及之前的企业很少,且多是头部玩家为扩展产品线、打造竞争优势的战略布局。
MRD检测产品的前瞻性研究上对患者筛选和管理上要求更高。不同于早筛,MRD检测的入组人选必须为确诊的患者用于预后的监测,在目标人群的数量上远远小于早筛;
另一方面,不同于早筛和伴随诊断,MRD检测产品的使用周期长(一般为两年半),意味着大规模前瞻性研究的时间也需更长,如此,患者的长期管理、样本的长期管理成为挑战。
同时,国内的头部玩家均在实体瘤上有布局,且大多涉猎泛癌种,虽然赛道不甚拥挤,但主流的技术路线为Tumor-agnostic 和Tumor-informed两种,国外亦然,且创新方向并没有很广泛。各家竞争实力雄厚,临床之战一触即发。
另一方面,我们看到仍然有获得融资的创新企业,比如艾沐蒽、泛因医学,他们在技术上是佼佼者,同时布局上针对血液瘤打造差异化。
整体来看,壁垒之下,近年MRD检测领域的融资不算密集,对创新企业的要求甚高,且头部玩家实力雄厚,技术进展上基本与国外同步。虽市场规模上不比早筛大,但入局者相较更少、应用上更刚需,指南共识的发布速度更快、临床的呼吁声更迫切,在国内外的发展同样有一片不错的天地。具体来看,近年融资情况如下:
MRD检测行业融资盘点
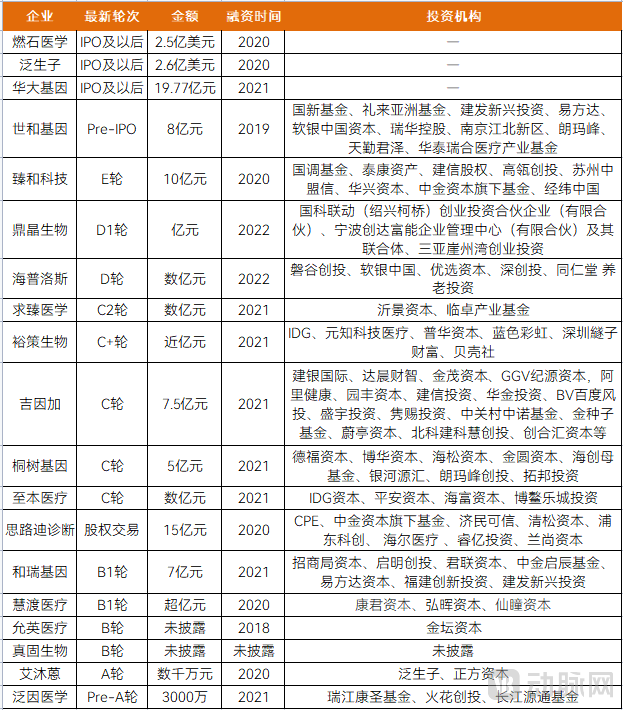
图片来源:蛋壳研究院
中国的癌症预后及监测市场有望加速增长。据沙利文数据,中国的癌症预后及监测市场由2016年的1430万增至2021年的人民币4亿元,年复合增长率为97.1%,且预计将于2026年增至人民币54亿元,2021年至2026年的年复合增长率为66.6%,并将于2030年进一步增至185亿元,2026年至2030年的年复合增长率为35.7%。具体市场规模如下:
基于PCR和NGS的MRD检测行业市场规模
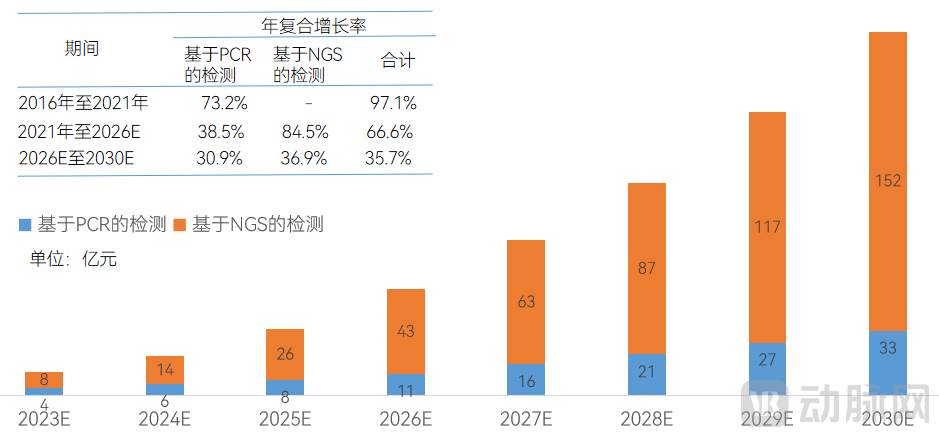
数据来源:沙利文,蛋壳研究院制
技术:路径不统一,进入临床验证阶段
放眼国内外,NGS下的技术路径并不统一,不同于前两年各企业在推新的方法学,现在多是用之前很稳定的方法学做临床场景的价值输出、临床有效性的验证,临床之战即将打响。
目前,MRD检测的技术主要是流式细胞术、PCR和NGS,其中,流式细胞术主要用于血液瘤,PCR和NGS主要用于实体瘤和血液瘤。血液瘤的发展较成熟,在过去的20多年中,流式细胞术是临床上检测MRD的主要技术手段。
近年,随着实体瘤MRD检测的应用,PCR和NGS,特别是NGS在MRD检测上的应用越来越广泛。下表为流式细胞术、PCR和NGS在检测原理、灵敏度、样本等方面的区别。
流式细胞术、PCR、NGS的区别
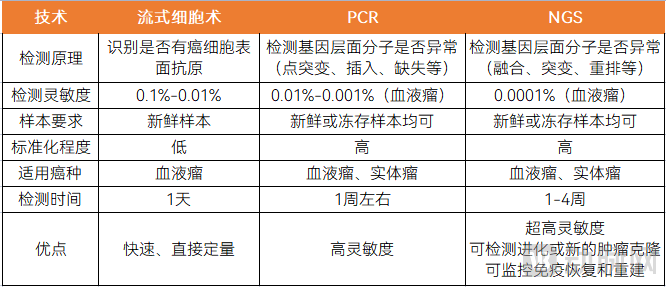
图片来源:蛋壳研究院
实体瘤中各癌种的MRD检测技术上难度不一,主要是其释放到血液中的ctDNA含量有差异。实体瘤的检测难度高于血液瘤,主要是实体瘤和血液瘤细胞在血液中释放的可检测ctDNA的含量不同所致,血液瘤在血液中释放的ctDNA远远高于实体瘤。
同样,各个癌种突变位点有差异,病灶大小不一,释放在血液中的对应ctDNA含量也有差异,意味着各癌种的MRD检测技术难度不同。
MRD检测的技术难点主要体现在突变的个性化、测序深度和背景噪音上。
MRD检测技术难点
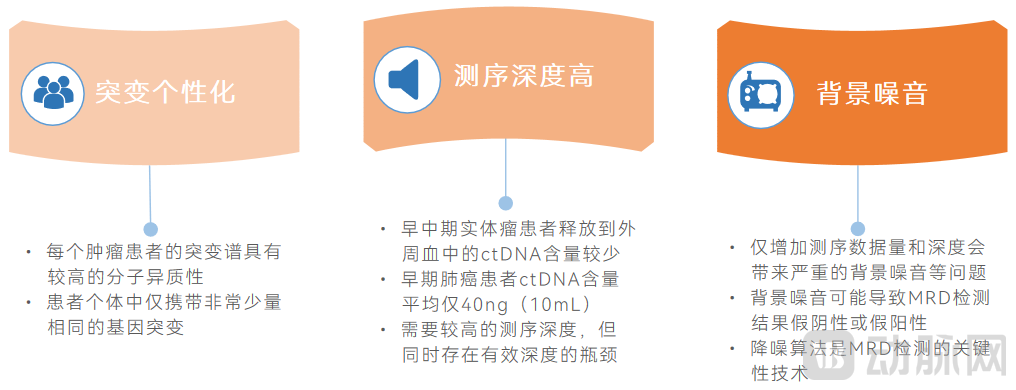
图片来源:蛋壳研究院
另外,各癌种的术后复发率也有差异,相比之下,肺癌的术后复发率较高,具体如下表:
常见五大癌种的术后复发率
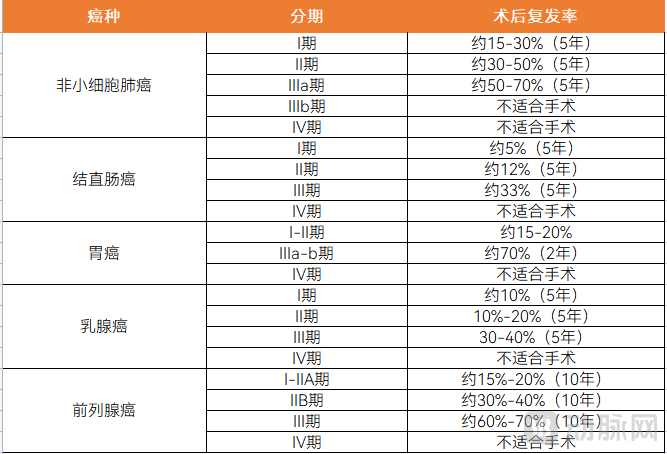
图片来源:蛋壳研究院
和单癌种MRD检测相比,泛癌种普适性更强。在实体瘤MRD检测领域,泛癌种检测的普适性更强,一方面,即使是在同一个部位,因为细胞学形态的不同,相关突变的位点也不完全相同,比如肺腺癌跟肺磷癌;
另一方面,肿瘤本身会发生一定的远端转移,或者是在耐药后发生一定的转化,可能带来新的病灶、引起新的部位发生突变。
国外企业对于技术路线的选择也有差异。国外市场中,Natera、Neogenomics、Invitae和Exact Sciences公司的产品基于Tumor-informed路线,Guardant Health和Grail公司选择了Tumor-agnostic路线,技术路线有差异。
国内企业主要聚焦在实体瘤,技术路线同样有差异。我们对国内部分企业已发布的实体瘤MRD产品进行统计。据不完全统计,截至2023年4月,国内共发布了19款实体瘤MRD检测产品,我们按照两种主流技术路径Tumor-informed和Tumor-agnostic策略统计,具体见下表:
国内企业已发布的部分实体瘤MRD检测产品盘点
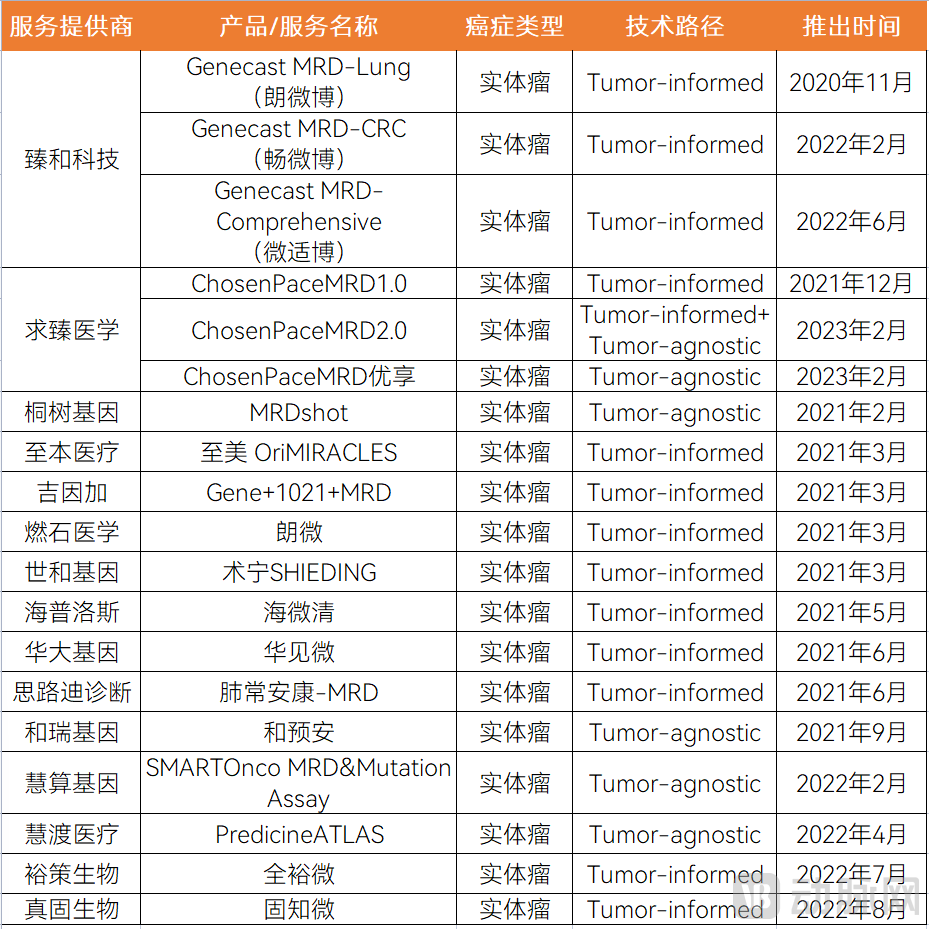
图片来源:蛋壳研究院
主流:Tumor-informed和Tumor-agnostic各有特色
肿瘤组织先验分析(Tumor-informed assays)需要对肿瘤组织进行WES+个性化panel的检测。肿瘤组织先验(Tumor-informed)策略首先需要对患者的肿瘤组织进行高通量测序(以WES为主),确定每位患者的肿瘤特异突变,并且选择一定数量的高丰度的躯干突变定制个性化panel(通常只包括16~50个肿瘤特异突变),最后在患者血浆ctDNA中检测这些突变,相当于WES+个性化panel的检测。
肿瘤组织先验分析策略因检测突变靶点少,大幅降低了由于技术和生物背景(比如克隆性造血)导致的假阳性风险,也因此可以进行极高深度的测序,提高检测的灵敏度,代表产品包括Signatera。
肿瘤组织未知分析(Tumor-agnostic assays)不需要获取肿瘤组织,进行固定化panel检测。肿瘤组织未知(Tumor-agnostic )策略主要是用一个普适性、一般有三四百个基因甚至更多基因的大panel进行检测,相当于固定化panel的检测。
采用固定的突变panel,无须预先获取患者肿瘤组织进行测序,可以大幅简化流程、降低成本及缩短患者MRD状态评估周期。
在制定患者辅助治疗的决策过程中,辅助治疗的延迟可能会降低治疗疗效,因此快速评估患者 MRD状态,从而尽早进行临床决策也十分重要。代表性的产品如Guardant Reveal MRD检测产品,Guardant Reveal采用固定化的panel检测ctDNA甲基化和基因组突变。下表为Tumor-agnostic和Tumor-informed策略的区别,包括检测策略、深度、性能等。
Tumor-informed和Tumor-agnostic的区别
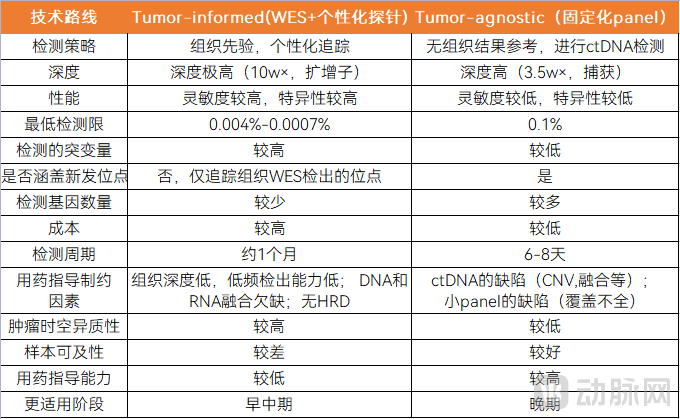
图片来源:蛋壳研究院
在审批与监管方面,肿瘤组织未知分析(Tumor-agnostic assays)可能相对容易些。相比个性化panel的千人千面,固定化panel标准化程度会更高,比如,结肠癌NCCN指南引用的文献主要基于Tumor-informed。另外,个性化panel在监管上会有一定的挑战,或许,最终批准的不是固定的产品,而是一个标准化流程,这还需要和监管部门达成共识
除了Tumor-agnostic和Tumor-informed两种主流的技术路径外,MRD检测技术还有其他的多创新方案,这些创新解决方案主要是通过检测更多生物标志物,提高单次检测的灵敏度,主要包括增加生物标志物的数量与种类等。
我们看到探索的方向有增加检测突变数量的多突变检测、增加检测种类的突变+甲基化多组学联合检测以及突变+染色体的联合检测等。同时,在算法平台和AI应用上,有开发特定的算法平台及AI赋能挖掘突变位点的方案等。
增加检测突变数量的多突变位点检测可提高灵敏度。针对肿瘤组织先验分析(Tumor-informed assays)这个技术路线,国内外企业都在开发自己的方案。比如最经典的signatera只用 16个位点,但现在有企业在位点的选择上进行扩充,通过增加检测的突变数量提高灵敏度。除了WES检测还有用WGS的方式去做组织突变检测,进一步提高灵敏度。
增加检测种类的突变+甲基化检测可提升产品性能。与其他生物分子标志物临床应用相比,DNA甲基化修饰通常在肿瘤早期就开始出现,且肿瘤组织DNA甲基化在大量基因区域通常保持较好的一致性,并具有组织和癌种间的特异性,可用于不明位置原发性癌症的组织溯源。肿瘤特异性ctDNA甲基化检测在手术或其他根治性治疗后肿瘤MRD检测中有潜在的应用价值。
通过对染色体不稳定性的检测可有效识别肿瘤转移。染色体不稳定性是细胞癌变的基础,中低水平的CIN赋予了肿瘤细胞生长优势,高水平CIN与肿瘤转移相关。超过25000例样本、50个癌种的MSK-MET研究证实了染色体不稳定性与肿瘤转移负荷的关系。因此,引入染色体不稳定性,对于评估肿瘤复发转移是很好的补充,能更好地为临床治疗提供决策参考。
肿瘤组织和ctDNA同检策略。该策略同时对肿瘤组织样本进行全外显子测序及对患者血浆ctDNA进行固定panel深度靶向测序,整合两种样本的数据,通过生信算法判断MRD状态。这类技术的固定panel一般采用热点突变,在一定程度上简化了流程。但是由于肿瘤患者个体差异,在一部分患者中可能不存在固定panel中的任何突变。
除了提高检测的种类和数量外,算法平台的降噪也很关键。在患者异质性比较强或没有热点突变的癌种上,以及在更早期地对灵敏度和特异性要求非常高这样场景中,需要用更高灵敏度的个性化定制检测方法,实现对临床不同应用场景的适应。
这就需要算法在不同样本、不同测序平台、不同的panel等,都能够实现非常高准确度突变追踪。
比如,臻和科技的MinerVa®平台采用769基因panel(产品:百适博®),可覆盖驱动突变、克隆性突变和搭车突变等多种突变类型,并采用差异权重的panel设计,覆盖肿瘤热点区域检测深度高(≥30000X),为MRD检测灵敏度提供保障。
AI技术可帮助优化检测方法,提高检测性价比。在设计固定化panel时可通过AI技术从几十万或更多的样本数据中挑选重要位点,结合发生频率、肿瘤类型、样本类型、检测深度和检测下限等参数形成一个比较经济实用、高效panel的检测方案,筛选出的位点可针对单癌种或泛癌种。
比如,慧算基因结合自有样本数据库,通过AI技术快速形成了基于NGS的特色MRD解决方案,可适用于泛癌种MRD检测。另外,经大数据挖掘出新的甲基化标志物,该marker 在 17 种实体瘤中表现出高度甲基化,可用于泛癌种MRD检测并有效降低成本。
AI技术通过模型训练,对发现新位点、新的生物标志物有重要意义,可满足MRD检测的大panel检测需求,未来,随着样本量的积累AI技术将发挥更重要的作用,进一步为MRD检测提供优选解决方案。具体来看,MRD检测的技术创新方案主要如下图:
MRD检测技术创新方案
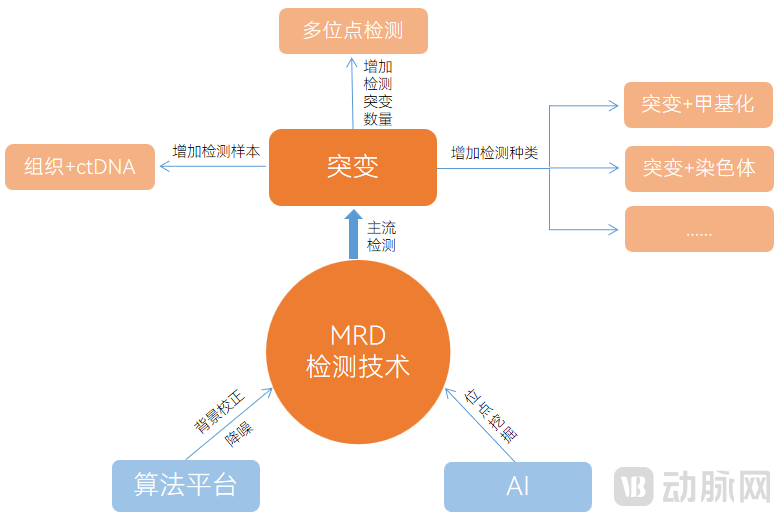
图片来源:蛋壳研究院
商业化:LDT为主,药企合作为辅
目前,国内还没有实体瘤MRD检测产品获NMPA批准,现有的商业模式以LDT为主、药企合作为辅,支付层面上,国内的MRD检测产品鲜有和保险合作。整体来看,MRD检测行业还处于商业化初期阶段,还有很长的路要走。
总体来看,国内LDT政策不断规范,目前,LDT院内试点进入实施阶段。
近年国内LDT相关政策和通知

图片来源:公开资料整理,蛋壳研究院制
下图为2023年发布的两份重磅院内LDT试点文件要点,政策旨在强监管、控风险,要求重资质、明权责,具体如下:
两份院内LDT试点文件要点
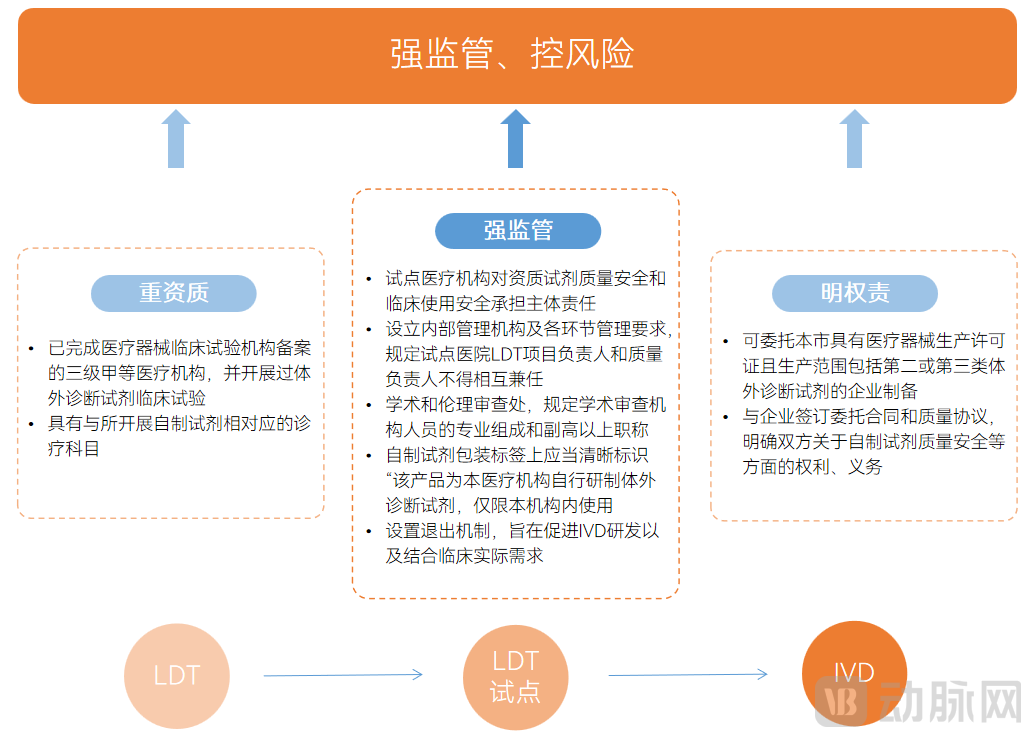
图片来源:公开资料整理,蛋壳研究院制
药企研发肿瘤药物呈现从晚期患者向早期患者拓展的趋势。站在药企角度看,大量药企已经将目光从晚期肿瘤患者扩大到早期患者的辅助及新辅助治疗,不论是靶向治疗还是免疫治疗,都呈现出了从晚期患者向早期患者拓展的趋势。
相比晚期,早期肿瘤患者接受治疗后,需要更长的随访时间,更大规模的研究,更多的随访管理投入,才能达到预设的临床终点。针对早期肿瘤患者的MRD检测天然匹配药企研发早期肿瘤药物的需求。
MRD检测企业和药企在药物上市前后都可合作,加速新药研发。对药企而言,MRD检测产品可用于实体瘤临床治疗,用于患者筛选、监测,加速新药研发。
一方面,在药物上市前, MRD的检测是药企临床实验很重要的部分,药企需要在临床实验中做入组筛选,对患者进行分层,以及探索标志物的研究和伴随诊断的标志物;同时,临床试验的结果有一部分以MRD 作为病人入组的依据和基础,作为治疗分层的基础,药企可根据MRD检测结果结合整个治疗方案做回顾性研究。另一方面,在药物上市后,MRD检测同样可以作为是否用药的辅助治疗。
药企可为MRD检测企业提供大量样本,加速产品开发。实体瘤MRD检测技术的研发存在两大关键点:一是技术能力,二是样本能力。优异的技术能力和样本能力相结合,是保证产品性能、加快研发速度的核心。
对MRD检测企业来说,药企拥有大量使用金标准检测的临床样本,可以在长期跟踪之后,明确知道每一个样本患者是否复发。这样,MRD产品就能基于大量的样本数据来进行验证,样本量越大,能够寻找到确定出的阈值就越准确。最终,这些样本一方面可加速产品研发,一方面可实现产品性能优化。
同时,对于检测企业来说,可以在临床试验中植入MRD检测、开发伴随诊断产品,与药企实现合作共赢。
FDA发布产业指导草案,鼓励MRD检测用于早期实体瘤治疗药物的开发。2022年6月,FDA发布了关于ctDNA在早期实体瘤药物开发中应用的产业指南草案,鼓励通过ctDNA进行MRD的检测用于早期实体肿瘤治疗药物的开发。
草案指出,ctDNA检测不但能够筛选含有靶向突变的患者,纳入临床研究,基于ctDNA的MRD更可能用于富集高复发风险的患者,衡量治疗反应,甚至作为早期研究终点。MRD检测正在成为药物开发不可或缺的一部分,可显著提高药物开发效率。
NGS自动化解决临床落地的最后一公里。NGS自动化可以将NGS检测系统从样本前处理、核酸提取、文库构建、杂交捕获、高通量测序等湿实验环节,生信数据分析、医学注释解读、报告出具等干试验环节及全流程质控进行系统集成。实现NGS检测从样本到报告一键式、智能化、全自动完成,大幅提高临床NGS检测的效率和临床可及性。
“整合式”平台技术得到政策鼓励。2022年4月8日,由广州市人民政府办公厅印发的《广州市战略性新兴产业发展“十四五”规划》强调,在医学检验领域,提出积极支持实验室自建检测方法(LDT)试点,鼓励开发“整合式”平台技术,研发高端检验检测一体化设备,攻克仪器的稳定性、可靠性、微型化和智能化等关键技术。
同时,精准诊断企业通过嵌入医院的信息化系统,为医院提供汇总患者信息、临床信息、样本信息、实验数据、质控系统等NGS全流程的完整数据流,实现NGS全流程数据的自动搜集、存储、动态分析及可视化展示以及院内基因检测大数据的深化集成,为院内NGS实验室搭建起一套以真实数据为基础的数据平台,全面深化院内肿瘤基因检测数据的积累与高效利用。
另外,企业可以为医院提供样本等方面的数字化管理服务。MRD检测的周期长,每次检测后需要对样本进行管理,同时,由于肿瘤的异质性,样本间的差别可能很大,这给样本的管理带来巨大挑战,这里,数字化管理是必要的。
趋势:MRD检测应用拓展,LDT将不断规范
应用:场景拓展,干预治疗是重点方向
MRD检测作为伴随诊断后的风口,实体瘤MRD检测的应用有所拓展。一方面,从围术期拓展到整个肿瘤诊疗周期;另一方面,MRD检测将扩展应用到更多癌种。同时,诸多干预性研究或将改变临床指南和治疗格局,药物假期即是MRD检测干预治疗的应用之一。
突变+甲基化等联合检测是接下来技术上主要创新的方向。毋庸置疑,突变是目前主流的检测方式,然而,单一的检测可能不够全面,而甲基化的信号比较集中,为检测提供了比较强的信号簇,在低频的ctDNA中灵敏性和特异性更高,突变+甲基化的多组学联合检测可提高检测性能,也是目前国内外在技术创新上主要探索的方向。
比如,Guardant Health的 MRD检测产品联合体细胞突变+甲基化突变两个维度做ctNDA评估,队列显示可有效预测肠癌的临床复发。
LDT进院即为门槛,不同合作的认可度或有差异。目前,医院作为风险的主要承担方,对与之合作的LDT项目、企业资质要求必然不低,因此,能进试点医院参与合作本身就是壁垒。壁垒之下,产品的认可度必然不同,关于NGS的LDT产品,美国有获批的途径而国内没有。在今年LDT在医院试点不断落实的背景下,国内或将以LDT进院而非设置获批途径的形式建立门槛、获得“合法”身份。
随着LDT试点的展开,企业间的竞争或将围绕LDT产品合作的医院展开。LDT在哪里做将是一个新的衡量标准,对大三甲试点医院的渠道之争也会开启,能走下去的依然是研发能力、市场能力兼具的企业。已入院本地开展的LDT项目,或有机会优先进入LDT目录,并获得“合法”身份。其他未入选项目,在试点阶段或保持默许状态,但从长期来看,一旦LDT政策运转成熟,新项目进入LDT目录或是项目开展的必要条件。
第一章 概况:产业合作动态密集,近年复合增长率为66.6%
1.1进展:实体瘤方兴未艾,MRD检测近年热起来
1.2融资:头部效应明显,进入壁垒较高
1.3规模:近六年CAGR为66.6%,将于2030年增至185亿
第二章 技术:路径不统一,进入临床验证阶段
2.1应用:NGS灵敏度最高,实体瘤检测难度更大
2.2布局:国内多布局实体瘤,泛癌种普适性更强
2.3主流:Tumor-informed和Tumor-agnostic各有特色
2.4创新:多突变、多组学、AI赋能
第三章 商业化:LDT为主,和药企合作为辅
3.1 LDT模式:LDT试点进入实施阶段,将不断规范
3.2药企合作:互利共赢,逐步向早期拓展
3.3赋能:NGS自动化解决“最后一公里”问题
第四章 趋势:MRD检测应用拓展,LDT将不断规范
4.1应用:场景拓展,干预治疗是重点方向
4.2创新:多检测联合是未来创新方向,突变+甲基化是主流
4.3模式:进入LDT试点具有先发优势,但不是终点
请扫描以下二维码,免费获得报告全文。

特别鸣谢(按调研访谈顺序):
求臻医学高级产品经理刘晟先生
慧算基因CEO夏林女士
慧算基因CTO王慧勇先生
臻和科技创始人兼CEO杜波先生
臻和科技首席科学官陈维之博士
吉因加产品总监龚玉华女士等




























