距离Crispr技术作为一种可能的治疗方法引起轰动已经过去了十年,第一个使用Crispr/cas9基因编辑的产品即将获得批准。Vertex和Crispr Therapeutics公司已经向监管机构提交了申请,监管机构的初步裁决可能在今年晚些时候出台。
伴随着飞速发展而来的是对基因编辑能否成为主流的怀疑。早期的基因编辑包括一些繁琐且令人不快的体外项目——首先提取患者的细胞,然后在编辑好的细胞被植入之前,采用化疗预处理方案消耗患者剩余的干细胞,这种方法也非常昂贵。
为了至少解决这些问题中的一部分,一些公司正在致力于更容易管理的项目,即在体内编辑细胞。然而,这引起了人们对于让基因编辑器械在病人体内运作以及可能造成的意外后果的担忧。
去年11月,Verve Therapeutics基于腺嘌呤碱基编辑器的Verve-101疗法被FDA暂停,尽管Verve-101距离正式投入使用还有很长的一段路要走,但这依旧使人们对体内项目的担忧达到顶峰。
今年,Intellia 体内编辑技术 NTLA-2002在美国本土进行的临床试验快速获得了批准,这平息了一些人们的紧张情绪。但是很多人仍然对基因编辑持怀疑态度,特别是那些虽然并不完善却已经获得批准的治疗方法。
最近,Evaluate Vantage发布了一篇基因编辑领域的最新报告,采访了基因编辑领域的各家公司,包括那些致力于 Crispr/cas9和下一个重大突破的公司,比如碱基编辑和先导编辑(prime editing)。还有一些团队正在开发新的递送方法,这个领域正在得到越来越多的关注。
尽管监管部门表现出明显的谨慎态度,但这一群体的乐观情绪是可以预见的。
Elevatebio首席执行官David Halla表示: “这不是会不会发生的问题,而是这种模式何时会成为改变世界的主导模式。” Elevatebio 旗下的 Life Edit 子公司今年2月刚与 Moderna 签署了一项协议。
他指出,最初人们对单克隆抗体也有所怀疑,“现在它们是生物技术甚至大型制药公司的主导模式。” Hallal 认为失败是可以克服的,同时也是必要的,这是为了“从过程中的错误中吸取教训”。
Prime的首席执行官Keith Gottesdiener表示: “我认为,我们现在面对的有些问题只是发展过程中的困难。” 2022年是近年来潜在上市公司融资表现最差的一年,但Prime依旧完成了1.75亿美元的 IPO,“我们持续观察到很多人对基因编辑感到兴奋。”
Aera首席Akin Akinc则有些谨慎: “我非常有信心我们将会持续向前发展,但这条路可能不会一帆风顺,这就是困难科学的现实。”该团队于今年2月份成立,获得了1.93亿美元的风险投资和一项基于 Crispr 先驱张锋研究的新型递送技术。
接受采访的公司倾向于认为考虑到相关技术的性质,FDA 的谨慎是有道理的。
Intellia 的一位发言人将FDA的标准描述为“恰当的高”。然而,Intellia 公司并不认同 FDA 比其他监管机构(如 EMA)更严格: “根据我们的经验,FDA的要求和其他的监管机构并没有明显的差别。”
Prime 的 Gottesdiener 说: “我认为基因编辑是监管机构需要仔细考虑的一个领域,因为这是对你的基因组的永久性编辑。”他同时强调,永久性治愈具有“令人难以置信的优势”。
Metagenomi 的首席投资官Simon Harnest对此表示赞同: “我们希望谨慎行事,因为我们不想仓促行事,让后续困难重重。”
总的来说,这些公司并不认为监管机构审评体内编辑会比体外编辑更严格。
专注于碱基编辑的 Beam Therapeutics 的首席执行官John Evans表示:“这是全新的技术。”他强调了先前对基因疗法的控制,比如 Vertex 和 Crispr 体外编辑的 exa-cel 项目。”问题是,当有新技术出现时,FDA并不确切知道该向你要什么,因为他们不懂其中的科学。”
虽然有些人预测体内编辑技术将使体外编辑黯然失色,但大多数接受采访的公司认为两者都有发展空间。Ensoma 是一个例外,这是一个专注于编辑体内造血干细胞的私人公司。
“我认为基因编辑这个领域正在从体外转移到体内,”首席执行官Emile Nuwaysir表示。“体外试验已经向前迈出了非凡的一步,它教会了我们很多东西——但同时也教会了我们它是不实际的。”
如果体内编辑真的成为主流,它对医疗健康行业造成的的影响可能类似手机对电信行业产生的影响一样巨大,Editas 首席执行官Gilmore o’neill表示。
为了实现这一转变,新的递送技术将是至关重要的。目前的体内治疗主要使用脂质纳米颗粒(LNPs) ,这往往是针对肝脏,因此治疗也就限制在肝脏介导性疾病的范围内。
腺病毒相关病毒载体已经用于基因治疗,给肝脏之外的治疗提供了另一种选择。然而这些都有免疫原性和长期影响之类的缺点。
新的递送方式肯定在投资者的雷达上。Prime 的 Gottesdiener 说: “在我们成立的第一年,每个人都迫切希望我们给出新的编辑技术。”在那一年里,我们让人们相信我们获得了精确的编辑技术,随即,他们就开始在递送技术的开发上折磨我们。”
新的编辑技术和递送方法似乎一直在涌现,但接下来的几年里随着这一领域逐渐明朗,我们可能会看到一个领域逐渐缩小的趋势,而如果出现这一趋势的话,说明这一领域将会取得成功。
随着一些尖端疗法进入市场,有关定价和知识产权的问题可能会变得更加突出。不过就目前而言,只要把这些项目中的一部分投入到临床就是一个很大的进步。
动脉新医药翻译了报告全文,以下:
基因编辑的世界充满了艰巨的任务,但是 Verve Therapeutics 有一个最艰巨的任务: 让监管机构和医生相信这个世界需要一个碱基编辑疗法来和PCSK9竞争。
Verve首席执行官Sekar Kathiresan习惯了人们总是怀疑 Verve 的使命。他告诉 Evaluate Vantage,“我认为人们还没有意识到这个领域里有多少未满足的需求。”他指出,在世界上所有的杂合子家族性高胆固醇血症患者中,只有大约2% 的人达到了目标低密度脂蛋白胆固醇水平。
“慢性病护理模式要求人们终生服用药片或注射,这根本行不通。”当被问及人们对基因编辑持久性的担忧时,他把它比作同样不可逆转的外科手术。
他坚持认为,如果 Verve 能够证明其 Verve-101项目的收益大于风险,“将有许多人愿意接受基因编辑”。
Verve-101目前正在进行临床1期的Heart-1研究,该研究正在新西兰和英国招募患者。然而,由于FDA在11月份对该公司 IND 申请了临床控制,使得美国的临床试验进展停滞不前。
Kathiresan 不愿猜测何时可能取消这一规定,并指出该公司仍在与监管机构进行谈判。但他并不认为 FDA 的谨慎是出于碱基编辑本身的考虑。他说: “我不认为这是技术问题,我认为这和递送有关。”
Verve-101使用 Beam Therapeutics 授权的碱基编辑技术,通过 LNPs 递送。来自Intellia 的 NTLA-2002最近被批准在美国进行试验,虽然该项目是基于 Crispr/cas9编辑但也使用 LNPs作递送载体。
Intellia 已经从美国以外的试验中获得了NTLA-2002的人体数据,这些数据可能有助于为美国的临床试验铺平道路。然而,Beam 的首席执行官John Evans淡化了这些结果的重要性。“FDA 感兴趣的可能不是第一阶段临床试验数据展现出的结果。”
“我们没有看到 FDA 对碱基编辑和核酸酶编辑的审评有什么不同。”例如 Crispr/Cas9。他说,“如果一定要说有什么区别的话,那就是在某些情况下我们可能会有一个更容易的方法,因为我们不需要制造双链断裂。”
有人担心,双链断裂(Crispr 编辑的一个特征)可能导致染色体异常,包括易位,从而导致癌症。同时,碱基编辑只是切割 DNA 并进行单个碱基改变。与 Crispr 的“剪刀”相比,它被称为“铅笔”。
人们希望这种精确度可以使碱基编辑更加安全,尽管 FDA 仍然采取谨慎的立场,并要求更多关于使用 verve-101等进行基因编辑治疗时造成的脱靶风险的数据。
除了给FDA提供临床前数据外,Verve 还希望能够同时提交 Heart-1临床试验的可用结果。与此同时,一旦所有四个剂量组完成,投资者将在今年下半年看到这项研究的数据。
安全性是关键终点,因此Verve 还测量了 PCSK9和 LDL-C 的水平,希望最终能够观测到他们分别减少60% 和40% ,达到符合诺华长效产品 Leqvio的标准。他说: “我们希望在临床3期结束时能够实现这一目标。至于能否在临床1期,在新的编辑技术第一次应用的第一次研究中实现这一目标,我们将拭目以待。”
在临床1期,“我们只是想展示我们能够编辑和递送”。
当 Verve 完全专注于体内编辑时,Beam 仍然保持开放的态度。首席执行官Evans表示: “我确实认为体外编辑会有一个归宿。”“你可以对体外细胞做一些你可能永远不能(在体内)做的事情。”例如,通过其同种异体 Car-T 项目,Beam 的目标是进行“四、五、六次编辑。我不认为这会在体内发生。”
Beam 的领导项目是一个针对镰刀型红血球疾病和 β 地中海贫血的体外编辑治疗方法。同时,Vertex 和 Crispr 的 exa-cel 也瞄准这个适应症。这个赛道看起来很拥挤,直到2月份 Intellia/Novartis、 Graphite 和 Sangamo 放弃了三个项目都,竞争性太强似乎是他们放弃这三个项目的可能因素。
虽然这个市场已经拥有了 exa-cel 和Bluebird的镰状细胞基因疗法 lovo-cel,但Evans并不担心Beam的体外编辑疗法上市较迟的前景。
“被剥夺优先权的资产运作的并不是很好,这个赛道绝对有更好的产品的空间。我们认为通过碱基编辑,我们将提供更高水平的编辑。”他说。
这反过来又可能导致胎儿血红蛋白水平升高; exa-cel 和 BEAM-101以及其他各种镰状细胞项目的目的是激活这种形式的血红蛋白以补偿镰状血红蛋白的影响。Exa-cel 通过降低转录因子 BCL11A 的表达来做到这一点。BEAM-101模仿遗传性持续性胎儿血红蛋白症个体中的单核苷酸多态性,来提高γ血红蛋白水平,这些人似乎可以免受镰刀型红血球疾病的侵害。
试验表明,exa-cel 使胎儿血红蛋白水平增加到总血红蛋白的45% 左右。Beam 最近的公司报告基于动物研究,提出了胎儿血红蛋白水平达到65% 的可能性。这个Evans称之为“现实”的目标将在明年的Beacon 的1期或2期临床试验进行测试。
与其他体外实验项目一样,BEAM-101涉及化疗调理,但 Beam 正在寻找一种毒性较小的方案来消耗干细胞。
Beam 的下一波称为 Escape 的体外镰状细胞项目,将把基于抗体的调节与修饰细胞结合起来,进行两个编辑: 一个是治疗性的,另一个是帮助细胞逃避抗体。Evans解释说: “抗体将清除旧细胞,就像其他细胞一样,但它不会影响我们的移植物。”
Beam 还有一系列体内编辑项目的管线布局,主要通过 LNP 递送,最初以肝脏为靶点因为LNP 往往在肝脏积累。最终,Beam希望开发镰状细胞的体内项目,这时它不得不将靶向骨髓。
Beam有被称作“条形码”的针对不同器官的LNPs,同时它对递送和做新的病毒和病毒样颗粒的早期工作也保持开放的心态(更多来自其他公司的努力稍后展示)。
Beam 还有其他的编辑工具。虽然它被称为碱基编辑公司,但它也与 Prime Medicine 达成协议,Prime 授予其独家开发镰状细胞碱基编辑的权利。
这两家公司有着密切的联系: 刘如谦是这两家公司的共同创始人,同时作为交易的一部分,Beam 为 Prime 提供了临时领导权。Evans说,这两种技术有一种“相似的感觉”,因为它们都是围绕 Crispr/cas9构建的,靶向宿主 DNA。在这两个项目中,Crispr 蛋白被修饰成缺口而不是进行DNA切割。
这两种技术使用的编辑器是不同的,Evans解释说: “在碱基编辑的情况下,它是一种脱氨酶。在先导编辑的情况下,它是一种逆转录酶。”(稍后将详细介绍先导编辑的工作原理)。
这场交易看起来像是一种确保 Beam 不会被当成治疗领域焦点的先导编辑超越的方式。Evans 说: “它将 Prime Medicine 推向了其他我们目前还没有进行研究的方向。如果我们想要使用它,我们也会随着时间的推移进行先导编辑。”这给 Beam更多达成目标的机会。
Beam 不希望 Prime 在它的领域发展这件事情是可以理解的。Prime 首席执行官Keith Gottesdiener表示,先导编辑可以做到其它编辑技术无法达成的,而且脱靶的风险有限。
不过要在人类身上证明这一点,该公司还有很长的路要走。尽管去年已经上市,但Prime 公司依旧不会在2024年之前提交第一份 IND 申请——第一份IND申请很可能是针对慢性肉芽肿病的体外项目。
Gottesdiener 认为,公司的进度已经很快了,因为 Prime 是在2020年才成立的。虽然投资人助力 Prime 公司成为2022年第四大上市公司,但因为Prime仍然处于早期阶段,因此投资者显然还没有打消疑虑。
这位首席执行官表示,落后于其他基因编辑公司可能也不全是坏事。“如果我们是现在就能进行临床试验,我会很高兴。但进程落后的好处是我们可以看到其他公司做了什么。这不仅仅是从监管的角度,我们还可以看到他们的一些科学方法。”
不过,Prime 公司还是希望自己最终从竞争中脱颖而出。该公司声称,先导编辑是唯一能够进行编辑、纠正、插入和删除的modality。
至关重要的是,它避免了 Crispr/cas9编辑造成的双链断裂。“双链断裂是染色体的一个紧急信号,可以说双链断裂是对染色体的破坏,而细胞恢复机制只是尽其所能地填充它。”Gottesdiener 说。
“如果你想让一个基因失活,这很好——这是 Crispr 最擅长的。但这是一个不受控制的过程。”
碱基编辑也可以避免双链断裂,但是先导编辑可以做“很多很多的事情”,Gottesdiener 说。“把它放在序列中,碱基编辑可以修复12个可能的核苷酸错配中的4个,我们不仅可以和做到碱基编辑一样的事情,同时还能修复其他8个可能错配的核苷酸。”Prime 编辑也可以插入和删除 DNA 序列。
他指出,早期的工作是将大量的 DNA“循环”出来,这可能有助于治疗像亨廷顿舞蹈症这样的重复扩张性疾病。而插入大量的 DNA是目前基因编辑领域的一大目标。
根据 Gottesdiener 的说法,当涉及到插入时,先导编辑的精确性将是关键。“现在人们可以把大量的 DNA 放入基因组中,这就是慢病毒的作用。不同的是,你能否把它放到一个非常特定的位置。
这种特殊性来自于先导编辑的三个阶段。“这就像一扇有三把钥匙的门: 如果你不打开所有的三把钥匙,你就不能进入房子。直到所有三个匹配都发生,我们才会开始编辑,因此这三个匹配结果出现在错误位点的可能性变得非常低。”
一个先导编辑器包含一个修改过的 Crispr/Cas 域(通常是 Cas9)和一个逆转录酶结构域。前者瞄准并切割宿主的 DNA,而后者利用第三组分 pegRNA 的模板将新的 DNA 序列写入宿主的基因组。
这个 pegRNA 包含一个“搜索”和“替换”序列; 搜索序列是第一个“关键”。一旦与 DNA 目标匹配,Crispr/cas9就会切割宿主 DNA,形成单链 RNA 片段。
这个翻转结合到替换序列的一个区域——第二个“关键”——触发逆转录酶将新的、修正过的代码写入宿主的基因。
Gottesdiener 说: “当我们完成后,需要能够匹配第三个位点才能把所有的东西重新组合在一起。”
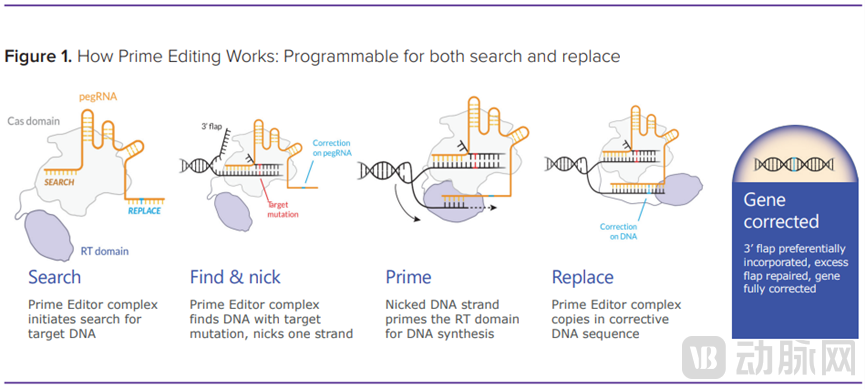
Prime 正在研究体外和体内项目,以及通过 LNPs 和 AAVs 递送。Gottesdiener 说,后者只能在“没有其他选择”的情况下使用。例如,“你可以使用 AAV 进入特定的大脑结构。我们不会坐等一个完美的解决方案出现,我们将与 AAVs 合作,直到出现更好的递送方式。”
Prime 目前已有18个项目在开发中,尽管还处于非常早期的阶段。“考虑到先导编辑的潜力,还有很多其他可能的应用。我们可能还有近100个认真考虑过的适应症。”
该公司自身无法承受100种适应症,Gottesdiener 表示,该公司“几乎每天都在与合作伙伴交谈”。
他承认 Prime 有很多需要证明的地方,但是他显然很兴奋: “我开玩笑说,我在这个问题上非常振奋。我真的,真的认为这会成功。但是当我们能够向人们展示支持它的数据时,我会感觉更好。”
Prime 并不是唯一一个试图突破基因编辑界限的公司。Elevatebio 通过其子公司 Life Edit Therapeutics,大胆宣称可以进行“任何地方的任何编辑”。
然而,这个团队的进度看起来落后了挺多,Elevatebio 的首席执行官 David Hallal说,现在说什么时候该团队可能会把一个编辑项目投入到临床,甚至说哪个适应症,还为时过早。
Hallal 表示,尽管 Intellia、 Beam 和 Prime 等公司主要关注的是一种编辑技术,但 Life Edit 正在研究各种modalities ,目的是提供“全方位的基因编辑系统”。
Life Edit 负责企业发展和运营的高级副总裁Clare Murray表示,支持这种方法的是“一套真正多样化”的RNA先导核酸酶。她补充说,该公司拥有的近100种核酸酶,来源于 Agbiome开发的“微生物专有核酸酶”。 Agbiome 是Life Edit 于2020年分拆出来致力于研究农作物保护的公司。
她还强调了一系列 Pam 基序(Pam motifs),这些短序列对于基因编辑机制的定位非常重要。总的来说,这“允许我们在 DNA 中去任何我们想去的地方去做我们想做的编辑”。她说。
除了核酸酶,Life Edit也在寻找脱氨酶进行碱基编辑和逆转录酶编辑,类似于先导编辑。
今年2月,Life Edit通过与 Moderna 的交易获得了认可,尽管交易费用未披露。Moderna称碱基编辑是一个他们特别感兴趣的领域。“虽然我们没有披露他们强调的治疗领域或疾病靶点,正如你可以想象的 mRNA 和 LNPs,他们喜欢用我们的联合技术来靶向肝脏。”Hallal 说。
Life Edit 正在开发体内和体外治疗方法,并计划利用其母公司的细胞治疗技术。Murray 相信还有更多的合作空间。“我们相信,我们可以在 Life Edit 和 Elevatebio 之间建立一个强大的内部管线,并且仍然有很多合作机会。”
至于递送,Life Edit正在研究病毒和非病毒的方法。Murray 说: “和编辑方法一样,我们想要尽可能多的递送选择。”
该公司还在开发小型核酸酶,这对于通过 AAV 载体递送可能特别重要,因为这些载体对它们所能携带的货物的大小有限制。
Life Edit 并不是唯一一个采取广泛研究方法的公司。另一个是 Metagenomi,它也与 Moderna 有合作关系,可以追溯到2021年末,还有去年与 Ionis 签订的协议。
Metagenomi与 Life Edit 还有其他相似之处: 它还拥有一个大型基因编辑系统库和一组多样化的 Pam 序列。然而,Metagenomi 是领先的,它有一个基于核酸酶编辑治疗未知肝脏疾病的和Moderna合作的体内项目,这个项目的临床试验将在2024年进行。
Metagenomi 和 Moderna 的合作不受 Moderna与 Life Edit 达成的协议的影响。他说: “我认为我们与 Moderna 的合作是明智的,因为我们不想将我们的目标限制在一定的范围内,因此,Moderna 与其他公司合作是很自然的事情。”
“但 Moderna 也在发展它的 Moderna Genomics 平台,我认为他们之所以发展这个平台,是因为他们对从我们这里看到的东西感到兴奋。”他说。
尽管如此,神秘的 Metagenomi-Moderna 临床试验项目的设计实际上只是为了概念验证,Harnest 说: “这其实是个例外,我们正在研究的其他技术不会造成双链断裂。”
除了核酸酶之外,Metagenomi 还在开发用于碱基编辑、先导编辑和 Crispr 相关转座酶(Casts)的临床资产。最后两个可以实现大的基因校正。虽然先导编辑依赖 RNA 作为模板,但 Casts 可以插入大块 DNA,Harnest 称之为“圣杯”。
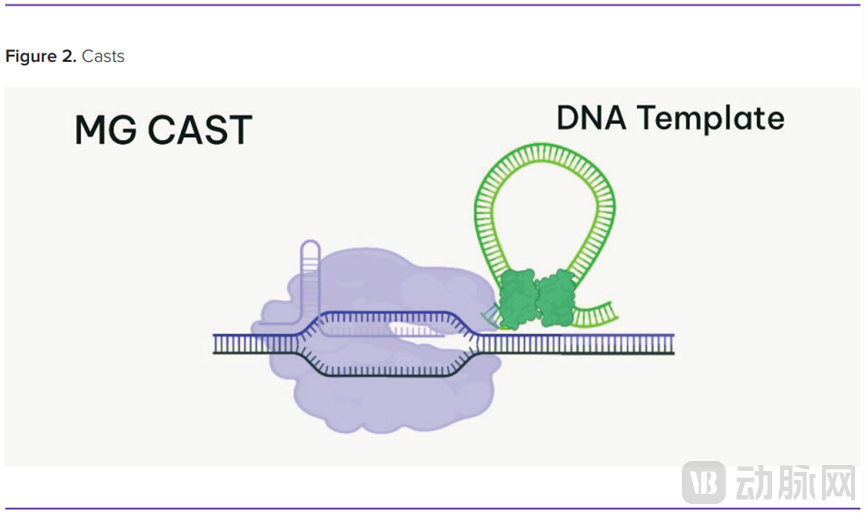
Harnest 说,就像 Crispr 核酸酶一样,Casts 自然存在于细菌中,这一技术的诀窍在于让它们在人类细胞中工作。在知识产权方面,Metagenomi 去年开始正在积极进行知识产权的归档。
这位高管对公司正在进行的 Casts 项目保密,但表示这种方法可能在涉及大基因的疾病中具有潜力,例如A型血友病和囊性纤维化。
Metagenomi 通过使用人工智能分析土壤样本找到了它的基因编辑工具—— Harnest 拒绝进一步评论公司的资源。通过这项工作,他们已经确定了大约20,000个潜在的编辑系统,“我们已经整理了大约100个,”他说,并强调该小组不使用任何其他人发明的技术。
Metagenomi计划只推进等于或优于 cas9的核酸酶。但是这在实践中意味着什么呢?Harnest 说,广泛寻找目标的核酸酶是公司努力的关键。“Crispr/cas9有一个 Pam 序列,我们相信这个 Pam 序列作为靶向机制并不是所有基因靶标的最佳选择。”
Pam 对于帮助基因编辑器回到基因组内的目标区域很重要。Harnest 说: “如果你只有一个 Pam 序列,那么你离 Pam 序列越远去找到目标,你就会得到越多潜在的脱靶可能。”
相反,“如果你有一系列具有不同 Pam 序列的核酸酶,你可以使用一个 Pam 序列更接近目标位点的核酸酶。我们相信这样可以达到更高的编辑效率和更少的脱靶效果。”
他表示: “我认为,人们开始接受这样一个事实: 基因编辑不是一把螺丝刀或一把锤子,而是需要一个完整的工具箱。”
即使他是对的,Metagenomi 也远远落后于基因编辑的领导者。就像 Prime 的 Gottesdiener 一样,Harnest 并不认为这是一件坏事。“有时候不做第一个是好事,特别是当涉及到一项全新技术的监管问题时。到2024年我们进入临床的时候,我们将有更多的知识,我们可以使用这些蓝图,并迅速跟进。”
除了它的编辑技术,Metagenomi 还致力于 LNPs 之外的非病毒递送技术,但 Harnest 拒绝详细说明。一个问题是,有这么多正在进行的研究,Metagenomi 是否将自己的研究方向排布的过于分散——他承认这一点。他说: “我们试图通过一种方式将我们的项目堆叠在一起,使我们不必亲自做所有的事。”
投资者在这方面似乎并不太担心。今年1月,Metagenomi 完成了了1亿美元的 B轮融资扩展,总融资额达到2.75亿美元。
在载体递送的问题上有更多发言权的公司是 Aera Therapeutics,该公司于2月份成立,获得了1.93亿美元的风险投资。这笔巨额资金并不是 Aera 引起轰动的唯一原因——该公司将 Crispr 先驱张锋列为创始人,并基于他的研究使用了相关技术。
Aera 首席执行官Akin Akinc表示,投资者被改善先进疗法的递送系统的前景所吸引,这个话题最近才浮出水面。“也许10年前,人们过于关注有效载体,而递送是一件没有得到充分重视的事情,人们以为你能够解决这件事。”
这位前 Alnylam 高管指出,从 RNAi 到基因治疗,再到现在的基因编辑,人们已经开发出了“令人惊讶的modalities”。但现实是,递送技术已经落后了。如果你看看今天的管线布局,许多体外和体内技术仍然集中在肝脏。人们正在认识到我们真的需要新的递送方式,这样我们才能发掘这些modalities 所能达到的全部潜力。”
Aera 的技术是基于所谓的蛋白质纳米颗粒(PNPs) : 内源性人类蛋白质。“这种蛋白质有来自像逆转录病毒等逆转录元件的古老进化起源。虽然我们的身体已经选择它们执行不同的功能,但这意味着它们仍然有能力形成类似衣壳的结构,包裹和转移核酸,”Akinc 说。
他说,使用人类蛋白质可能比基于病毒的递送系统有优势,包括减少免疫原性风险。这可以提高安全性和重新注射的能力。
根据Akin Akinc的说法,人体中大约有85种这样的蛋白质,它们形成的结构大小可能不同。他说: “其中一些蛋白质会有不同的包装限制。我们的载体可以携带大量货物,如基因编辑货物,但我们可能有其他更好的小分子物质,如 sirna 或反义寡核苷酸。所以我认为在这方面是相当灵活的。”
因此,Aera 的技术可以应用于更大范围的先进治疗方法,而不仅仅是基因编辑,这引发了人们对于该公司将如何优先安排其工作的疑问。他说: “我们不可能独立完成所有的事情。我认为合作关系是我们的未来,”Akinc 表示,尽管 Aera 筹集的资金意味着它并不急于达成交易。
该公司还在开发自己的基因编辑技术,该技术是基于一种名为 IscB 蛋白的新的编辑酶家族。“它们似乎是 Cas9的祖先——它们拥有 Cas9的所有功能属性,但它们的大小只有Cas9的三分之一左右。”他说,这意味着它们可能更容易打包和递送,就像其他小型编辑系统一样,比如由 Mammoth Biosciences 等公司开发的编辑系统。
虽然 IscBs 本身也有双链断裂,但它们也可以被用作碱基或先导编辑系统的平台,就像 Cas9被用作构件一样。
“最终,我们希望成为一家基因药物公司,在推动自己的药物和管线发展之外,还能推进其他公司的发展。”Akinc 说。
至于 Aera 的重点,现在给出确切的细节还为时过早: “我们真的对肝脏以外的东西感兴趣。或者我们是否可以将目前在体外的应用转移到体内,”他说。换句话说: “我们在哪里解决问题?”
他承认,该公司在基因编辑和递送方面的工作还处于早期阶段,但他表示,投资者认识到了这一点。“(人们)认识到这个问题有多么困难。仅靠有限的资源是无法很快解决这个问题的。”
另一家公司 Ensoma 正在采取一种不同的方法。该公司声称自己是第一家将体内编辑技术应用于造血干细胞的公司,并且使用了病毒样颗粒。
目前的体内治疗仅限于肝脏介导性疾病,而血液疾病,如镰刀型红血球疾病,目前只能通过体外方法治疗。Ensoma 的首席执行官 Emile Nuwaysir 说,体外疗法由于太过昂贵而“不切实际”。
他说,在体内靶向造血干细胞是答案。他说,“这是你整个血液和免疫系统的来源。而且,血液系统在你生命的每一刻都与你身体里的每一个器官和细胞接触。所以,如果你想提供治疗性的东西,还有什么比血液系统更好的方式呢?”
除了遗传性疾病,该公司还瞄准了癌症,例如通过改造患者自身的 T细胞来攻击肿瘤。该集团还在2021年初与 Takeda 签署了一项协议,涵盖了多达5种不知名的罕见疾病。然而,这项工作的未来看起来是不确定的,因为日本研究小组在四月份表示,它将停止对基于 AAV 载体的基因治疗和罕见血液学的早期研究。Nuwaysir 表示 Ensoma 仍在评估这一新闻将如何影响其项目。
Ensoma 的递送技术是基于病毒样颗粒,完全去除病毒基因组,以帮助最小化病人对病毒载体的免疫反应。
该公司表示,该系统还具有35kb 的有效载体容量,是 AAVs 极限的7倍多。Nuwaysir 说,这对于插入大的有效载体特别有用,比如用于肿瘤学的 Car 构造。
至于该载体如何靶向造血干细胞,他解释说,这来自于“用不同血清型腺病毒改造衣壳,然后引入点突变,使其对造血干细胞更具特异性”。
与 Aera 一样,Ensoma 的意图是提供一系列的有效载体。其中之一来自该集团一月份收购的 Twelve Bio,该公司已经开发了一种基于 Crispr/Cas12a 的核酸酶。
Cas12a 比 Cas9更小更具体, Twelve Bio的技术旨在同时进行多次编辑。 “我们使用的 Cas12a 是独一无二的。”Nuwaysir 说:“而 Cas9则更难做到这一点。”这种多元化的编辑可以在 Ensoma 的 Car-T 项目中独占鳌头,Cas12a编辑旨在提升功能性,增强扩展、干性、持久性和抗衰竭性”。
据Ensoma所说它的技术有独一无二的方面,即它通过使用转座酶机制编码 VLP能够使编辑的影响是暂时性或永久性的,也可以是任何介于两者之间的状态。他说: “通过改变转座酶识别位点在构建体中的位置——它告诉转座酶抓取和插入哪些 DNA ——我们可以控制构建体的哪些片段被插入DNA,因此是永久性的,哪些片段是瞬时表达的。”
大多数其他载体“要么是暂时性的,要么是永久性的”,他说: AAVs 都是“基本上是暂时性的”,这意味着它们作为宿主基因组的一个独立实体存在,因此是短暂的,而慢病毒是整合后的整体,因此是永久的。
当然,Ensoma 还有很多东西需要证明,而 Nuwaysir 没有说明这项技术何时可能进入临床,因此证明这项技术还有很长的路要走。
Editas 是一个经历了一段艰难时期的基因编辑公司,但该公司仍然相信它能够提供一些东西。今年年初,该公司放弃了在一种罕见眼病上令人失望的体内编辑项目,并将其诱导多能干细胞衍生的自然杀伤细胞项目卖给了Shoreline Biosciences。
Editas近年来已经换了几位首席执行官,目前由Gilmore o’neill领导,目前的重点是针对镰刀型红血球疾病和地中海贫血症的体外编辑项目 EDIT-301。
早期阶段的体内试验也在进行中,Edita 也希望以造血干细胞为目标。O’neill 说,该团队正在研究“一些”潜在的递送工具,包括脂质纳米颗粒。
他拒绝透露更多关于这些药物如何起作用的细节。他说: “从目标角度来看,我们需要继续研究这些技术中的一些元素。”
Editas的首要体内研究项目也将用于镰刀型红血球疾病和地中海贫血,但是 O’neill 不会提及该项目何时可能进入临床。除此之外,Editas 还对其他项目感兴趣,包括肝脏和非肝脏,但这些仍然是最高机密。
除了针对造血干细胞,Editas 还有其他与 Ensoma 相同的东西: 都使用 Crispr/cas12。O’neill 说,这两家公司的酶的设计是不同的,但是他表示很高兴 Ensoma 看到了这种方法的潜力。
O’neill 指出,Cas12a 提高了准确性和效力,他认为EDIT-301和Cas12a应该具有相关性——尽管它在开发方面远远落后于 Crispr 和 Vertex 的 exa-cel。
他还认为 Editas 有一个更好的方法来锁定 γ- 珠蛋白基因的启动子区域,以模拟胎儿血红蛋白遗传持久性的影响。
Exa-cel 通过降低转录因子 BCL11A 的表达来增强胎儿血红蛋白。O’neill 认为,编辑伽玛球蛋白比编辑 BCL11A 更有利于红细胞健康。“我们希望这种方法能够促进患者获得更好的治疗效果,但是这需要在临床上得到证明。”
到目前为止,Editas 已经公布了一名患者的胎儿血红蛋白数据,这些数据与 exa-cel 的结果一致。来自 EDIT-301的 Ruby 试验的更多数据将会在年中取得,但是目前还不清楚这次更新将涉及多少患者。
有了Bluebird’s 的基因疗法 lovo-cel在前,但O’neill 并不担心进入这个市场的时间太晚,他指出了差异化的潜力。他还认为,因为调整商业模式,以及支付者的犹豫不决,“绝大多数患者在我们获得批准之后仍然会选择继续等待新的疗法”。
他指出了最近的 Car-T 的例子,它开始的时候发展的也很慢。
他也不担心来自 Beam 的竞争前景,如前所述,Beam 也用 Beam-101瞄准伽马珠蛋白。他说: “当他们展示数据时,我会很高兴看到他们的数据。”
最后,O’neill 说,更多的选择对病人有好处。然而,镰刀型红血球疾病的体内治疗可能会改变这一状况,使得体外治疗的吸引力大大降低。Editas希望它不会再次被行业抛在后面。
*原文链接:GENE EDITING:Overhyped or Unstoppable Tide?
https://www.evaluate.com/vantage/articles/analysis/spotlight/gene-editing-overhyped-or-unstoppable-tide





























