2023年5月,Eledon Pharmaceuticals宣布通过私募方式获取最高达1.85亿美元的资金,包括3500万美元的初始预付融资,以换取1520万股普通股(或预付认股权证),以及最多1.05亿元的里程碑额外强制性分期融资。此外,Eledon公司将有可能在完全行使与该协议有关的认股权证后获得4500万美元。
本轮融资由BVF Partners LP和Armistice Capital领投,包括赛诺菲在内的新老投资者参与。此次私募收益将用于其主要产品tegoprubart的临床开发、营运资金和一般企业用途。
Eledon Pharmaceuticals是一家处于临床阶段的美国生物制药公司。公司主要研发为预防移植排斥反应,治疗肌萎缩侧索硬化(ALS)和免疫球蛋白A肾病(IgAN)的免疫抗体药物。该公司已于2014年9月在纳斯达克上市。截至6月26日,Eledon市值3015.9万美元。
自2004年创办以来,它走过了19年的创业之路,两度失败两度更名,涉足三条医药研发赛道。一家Pharmaceuticals如何在研发之路中沉浮?又是如何东山再起,获得赛诺菲青睐?我们可以看看Eledon的故事。
Eledon诞生于美国西海岸的洛杉矶。那时它的名字是Tokai Pharmaceuticals,专注于治疗前列腺癌的生物药品研发。
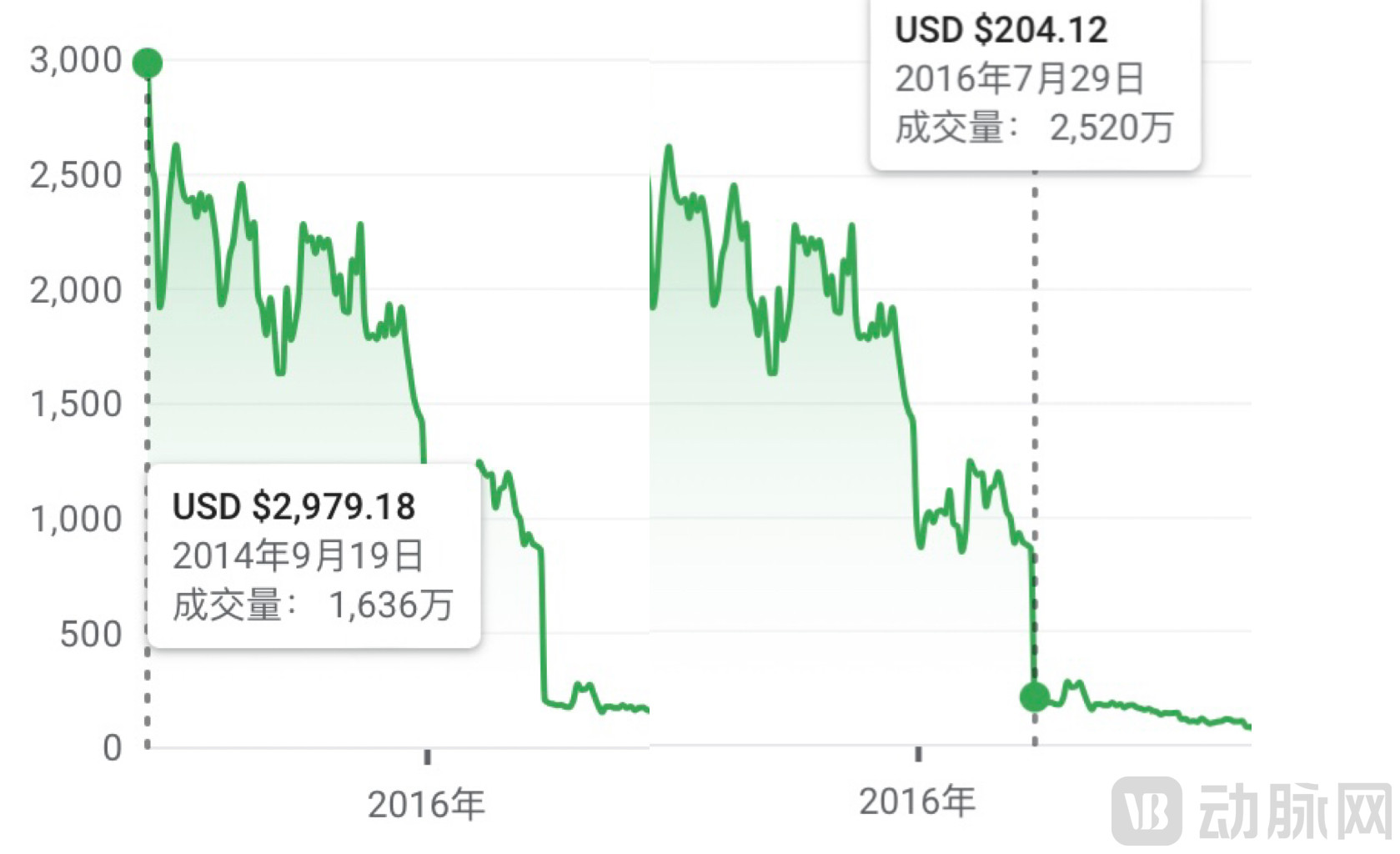
可查询到的公开信息,IPO上市前,Tokai获得了超1.24亿美元的投资。2014年9月,Tokai Pharmaceuticals(TKAI)首次公开募股9700万美元。
这些资金都被Tokai投入支持galeterone,一种治疗前列腺癌的口服小分子药物。彼时,galeterone已进入2期临床试验,并通过FDA快速通道审批。galeterone具有高度选择性、多目标的特点,利用三种机制切断前列腺肿瘤生长所需要的激素睾酮、双氧睾酮和雄激素受体,进而阻断肿瘤生长。
2015年6月,galeterone启动全球3期临床试验。但试验进行一年后即宣布停止。基于安全性和有效性审查,试验独立数据检测委员会(DMC)认为其无法成功达到主要终点。
图源:Google Finance
消息一出,Tokai股票跳水。2015年7月底Tokai宣布裁员。8月,Khang&Khang律所联合亏损投资者,对Tokai提起了集体诉讼。11月,Levi & Korsinsky律所宣布调查Tokai,称其某些高管可能存在证券欺诈行为。
主线产品研发终止后,首次失败的Tokai陷入前所未有的低谷。Otic Pharma向它们伸出了橄榄枝,提出了战略替代方案。
2016年12月,两家公司签订股票购买协议。协议完成后,Otic Pharma股东将拥有合并后公司约60%的股份,成为Tokai的主要所有者。Tokai以增发新股的方式支付Otic Pharma,同时承担Otic的已发行期权和可转换证券。2017年5月Tokai宣布收购Otic Pharma,后改名为Novus Therapeutics。
合并后的Novus Therapeutics成为一家专注于耳鼻喉产品收购、开发和商业化的制药公司。其主要产品是一种鼻腔注射联合药物OP-02,适用于治疗中耳炎和咽鼓管功能障碍。
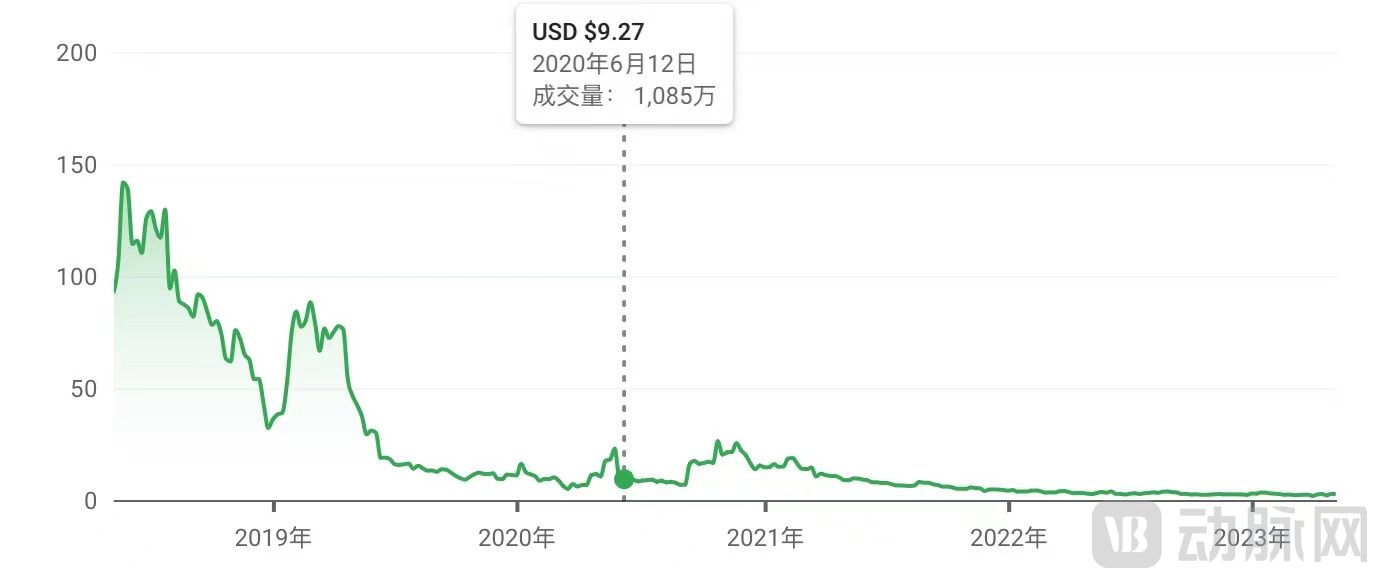
而戏剧化的失败再一次上演。OP-02于2019年2月开始1期临床试验,2020年6月的中期实验遭遇失败。Novus的股价跌至低价股区域。
图源:Google Finance
但这一次,Novus选择了收购管线来拯救公司。仅三个月后,Novus宣布收购Anelixis Therapeutics,将其研发转向了免疫学药物。这一收购使其股价上涨了282%,最高达到每股26.18美元。同时,Novus完成了总收益超1.08亿美元的私募融资,并在10月启动了AT1501(Tegoprubart)的2a期临床试验。
2021年7月,Novus正式更名为ELedon Pharmaceuticals(纳斯达克:ELDN),在免疫学药物研发赛道开启了新的征程。
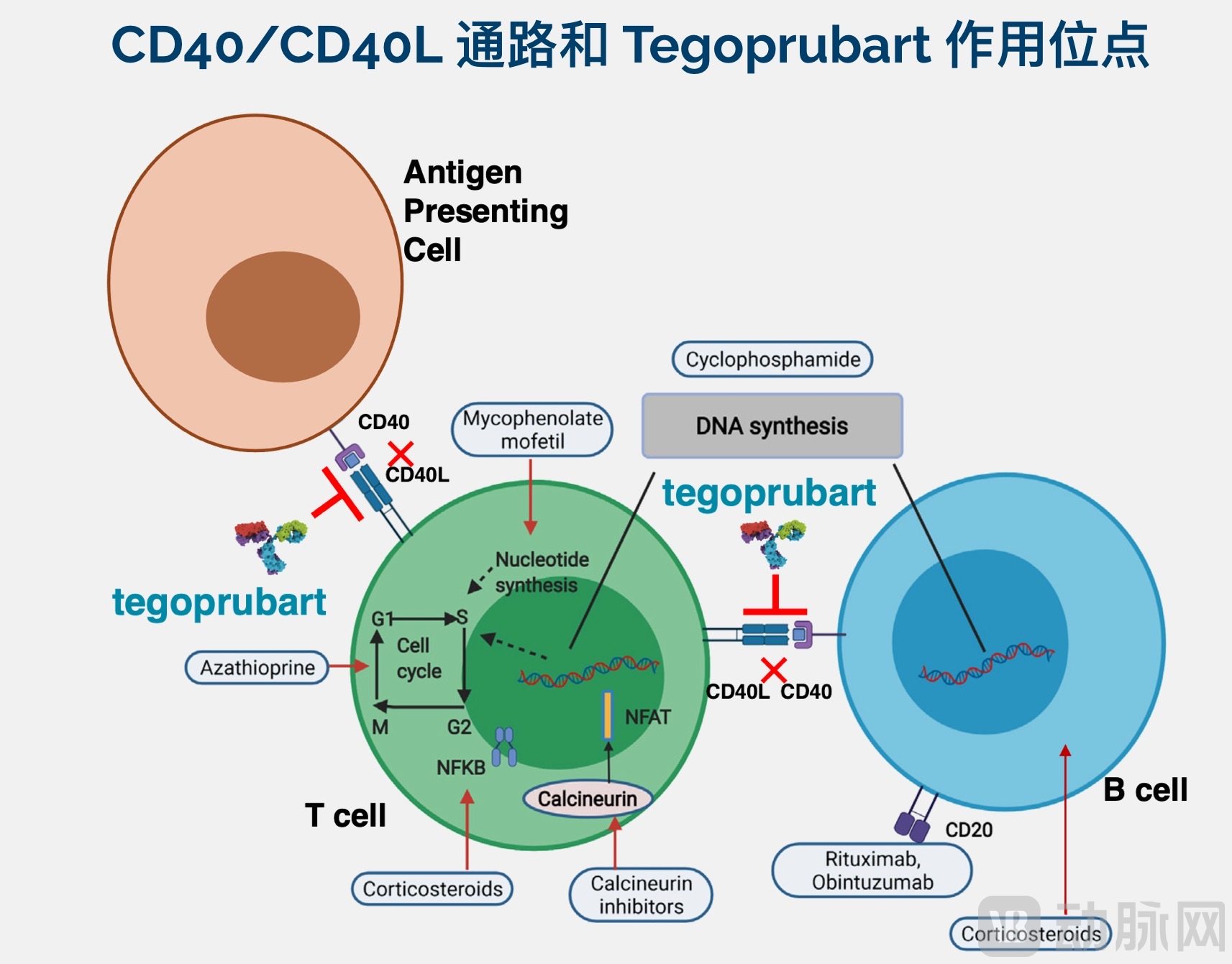
CD40/CD40L信号在产生促炎反应中的核心作用使其成为干预自身免疫性疾病、诱导移植耐受、治疗神经炎症的明星生物靶点。
正常状态下,CD40与CD40L的相互作用激活共刺激免疫通路,控制适应性和先天性免疫系统之间的“串联”,从而在免疫系统激活中发挥关键作用。具体而言,CD40L和CD40的相互作用将导致克隆扩增、抗体产生和促炎细胞因子的分泌,从而增强免疫反应。
CD40/CD40与Tegoprubart作用原理
图源:ELedon Pharmaceuticals
Tegoprubart是一款靶向CD40Ligard(CD40L)的人源化lgG1抗体药物,对于CD40L具有高亲和力。Tegoprubart通过阻断免疫T细胞中CD40L与免疫B细胞中CD40的通路,切断抗体和细胞产生免疫反应的可能,阻止免疫激活,达到预防急性或长期同种异体移植排斥反应的效果。
Tegoprubart模型
图源:ELedon Pharmaceuticals
在靶点选择上,Tegoprubart靶向CD40L而非CD40。阻断CD40L可以抑制CD40和CD11等共刺激受体的共刺激信号通路,有可能获取更好的疗效。同时,阻断CD40L不会导致淋巴细胞减少症。许多免疫抑制药物会出现这一副作用。
其次,阻断CD40L还会增加淋巴细胞向Tregs(调节T细胞)的极化,以创造更耐受的环境,提供更好疗效。Treg是辅助性T细胞的一个亚类,最主要的功能是抑制自身反应性细胞的病理性免疫应答,建立并维持组织内的免疫稳态。
此外,CD40L比CD40受体更具有选择性表达,因此在安全性提高上更具潜力,在药代动力学、药效学和剂量上都更具优势。
在1期临床试验中,ELedon通过向双组健康受试者注射外来血蓝蛋白(KLH),观察Tegoprubart阻断健康受试者的免疫球蛋白类别转换能力。未接受治疗的受试者产生了强烈的抗体反应,并在第15天达到峰值。而治疗组的三名受试者有两位完全消除了对KLH的免疫反应,一位免疫反应降低。
2022年,针对其预防胰岛细胞异体移植中排斥的作用,Tegoprubart获得FDA的孤儿药物称号。
Tegoprubart开发了五条适应症管线,其中lgAN和肾移植已进入2期临床,ALS管线已完成2a期临床试验。
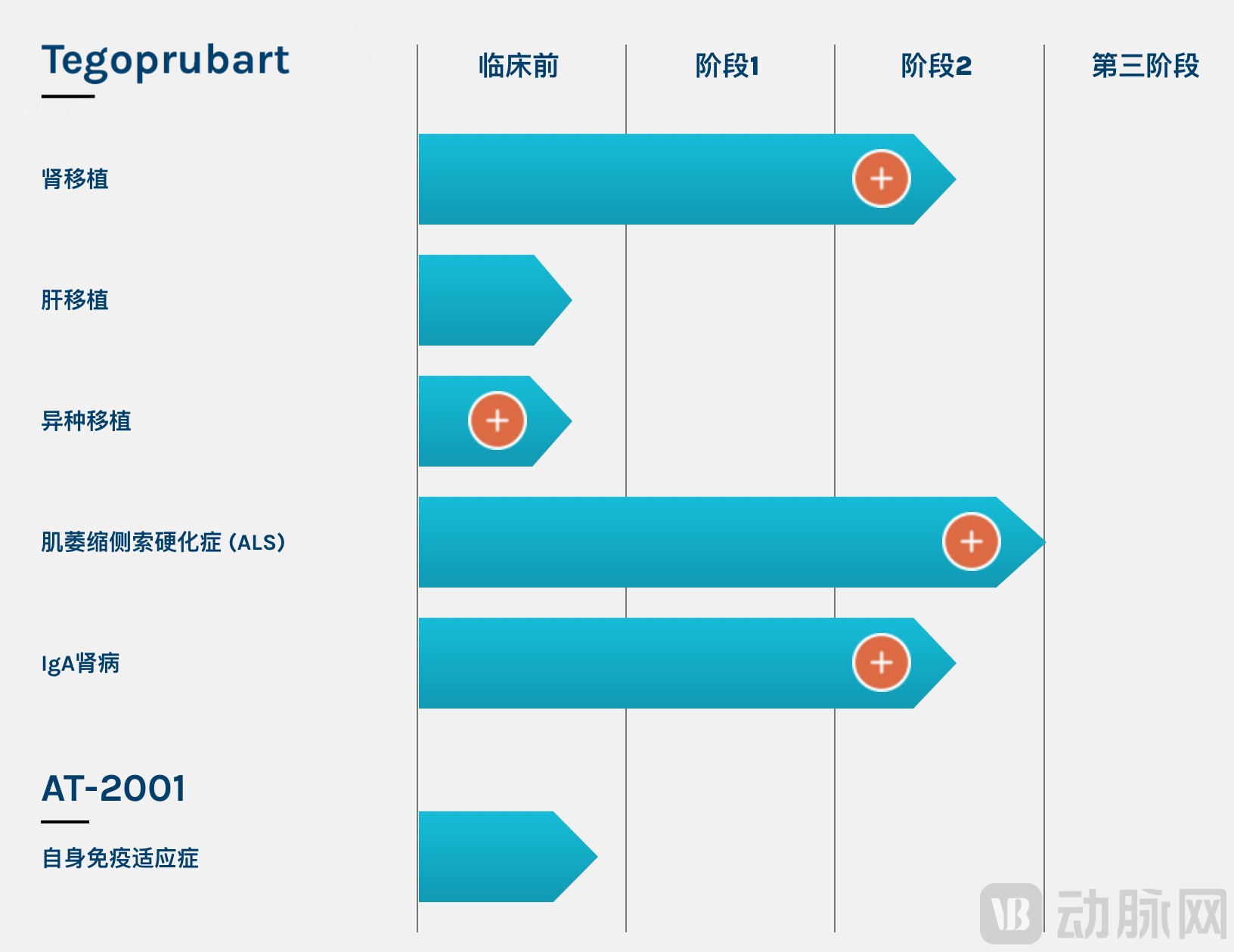
Tegoprubart适应症管线
图源:ELedon Pharmaceuticals
肌萎缩侧索硬化(ALS)管线
ALS在美国影响大约30000人,每年增长约5000例新病例。它的特点是渐行性肌肉无力,最终导致患者失去独立行走、吞咽和呼吸的能力,死于呼吸衰竭或恶病质(即体重减轻和肌肉萎缩)。尽管 FDA 已批准了三种ALS治疗方法,但五年发病率和死亡率仍然很高,50%和80%的ALS患者在诊断后3年和5年内死亡。
ALS是Tegoprubart研发的初衷。其前身AT-1501最初是在Augie's Quest to Cure ALS的资助下发明的。这一基金来自于健身偶像Augie Nieto。他在2005年被诊断出患有ALS,后与他的妻子Lynne筹集超1.6亿美元用于资助ALS研究。
在ALS中,Tegoprubart通过阻断CD40L激活,减少巨噬细胞浸润,降低炎症反应。临床前研究表明,Tegoprubart治疗可延缓疾病发作,改善动物的体重维持,以延长动物存活期。
目前,Tegoprubart已在ALS受试者中完成为期12周,开放标签、多递增剂量的2a期研究。试验成功达到安全性和耐受性主要终点,没有严重或严重的不良事件,且参与者没有血小板活化或血栓形成的迹象。
免疫球蛋白A肾病(IgAN)管线
IgAN是最常见的原发性肾小球肾炎,在美国影响超过10万人,诊断时的平均年龄在20至40岁。IgAN的主要特征为渐行性肾功能恶化,可能导致终末期肾病 (ESRD)、透析、肾移植和死亡,这代表着巨大的经济负担和对生活质量的重大影响。
在临床前模型中,阻断CD40L信号可改善蛋白尿、减少自身抗体、减少免疫细胞浸润至肾脏、提高存活率。IgAN管线正在进行一项有42名受试者的2a阶段临床研究,评估Tegoprubart对患者的安全性和有效性。研究指标包括是否能在第24周降低尿蛋白、在第96周减缓估算肾小球滤过率(eGFR)的下降。
肾移植管线
肾移植可改善终末期肾病患者的生存率和生活质量。改善全球肾脏病预后组织(KDIGO)指南中建议,除受者和供者是同卵双生姐妹或兄弟之外,所有的肾移植受者都需要接受诱导治疗以预防排斥反应。
目前的免疫抑制治疗药物主要是他克莫司(一种钙调磷酸酶抑制剂CNI)。使用后患者和移植物的1年存活率超90%,10年生存期约为50%。但他克莫司治疗会增加移植后糖尿病风险,且具有肾毒性,长远而言会降低移植功能和活力。
Tegoprubart可能减轻与CNIs相关的肾毒性和副作用,以改变移植临床管理,延长移植器官的功能寿命。作为一种无CNI免疫抑制方案,Tegoprubart有望下调细胞介导和抗体介导的免疫反应,同时为移植体创造一个更具耐受性的环境。
Tegoprubart在移植动物模型中已被证明是有效的,目前正在评估作为他克莫司潜在替代品的可能。
根据历年财报,上市至今公司一直处于高亏损状态。这与其长期困于研发试验,无法实现药物商业化有关。纵观9年的研发支出变化,除战略合并和战略收购的2017年和2020年,其余的年份研发支出始终超过50%。
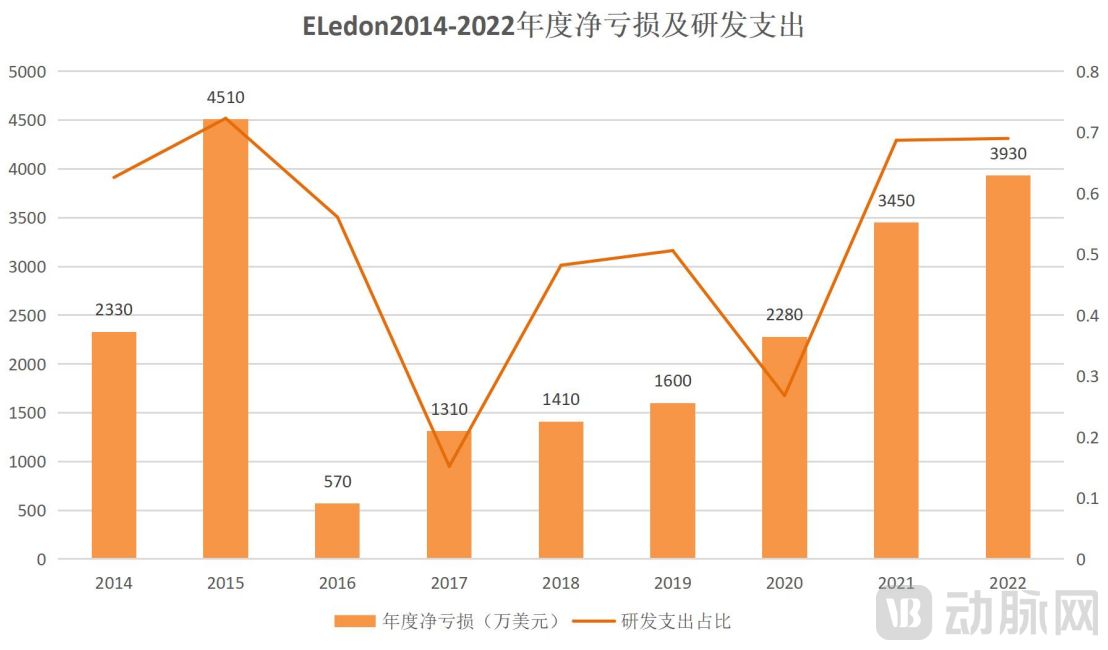
资料来源:Eledon年度财报
制图:动脉网
在长达19年的药物研发之中,Tokai时期聚焦单一高值药物管线,其失败也带来了公司的全面危机。Novus时期则是多条管线并行、突出主要产品,试图做到风险分散,但主要管线药物研发的失败还是带来了不小的重创。加之该阶段选择的赛道并非孤儿药物或前沿疗法,整体估值较为低迷。
进入ELedon时期,新赛道的免疫干扰药物适用方向广,可同时推进多适应症的研究。ELedon抓住了这个机遇,一举将三个适应症管线推至2期临床试验。
但多管线并行的资金压力还是阻碍了这家连年亏损的研发型企业。
在3月30日公布的2023战略决定中,ELedon宣布Tegoprubart将聚焦推进肾移植管线,取消lgAN的临床开发优先级,并停止胰岛细胞移植的1/2期试验。ALS管线则会继续寻求资金,等待研发。
截至2022年底,ELedon拥有约5640万美元的现金储备,预计足以维持运营至2024年第一季度。
失败会不会重演?Pharmaceuticals的机遇和风险总是伴随而来,有时还需要一点“东风”。





























