5月19日,FDA批准了VYJUVEK™的上市。VYJUVEK™将用于治疗六个月及以上的营养不良型大疱性表皮松解症(DEB)患者。值得注意的是,这是FDA批准的首款可重复用药的基因疗法和首款外用基因疗法药物,同时也是首个FDA批准同时用于显性和隐性DEB治疗的基因疗法药物。
VYJUVEK™的研发公司Krystal Biotech是一家专注于开发罕见病基因疗法的生物技术公司。5月22日,Krystal完成1.6亿美元的私募股权融资。该笔资金将用于VYJUVEK™的启动、商业化运营及其他管线药物开发,预计可支持至2026年底。此轮融资由Avoro Capital Advisors和Redmile Group领投,Braidwell LP和Frazier Life Sciences参与其中。
自2017年IPO以来,Krystal基本上保持着增长态势,如今增幅已经超过了1100%。
VYJUVEK™获批后,Krystal迎来了快速膨胀期,年度单股上涨达70.69美元,增幅达115.7%。截止7月6日,Krystal股票价格为每股121.3美元,市值达33.4亿美元。
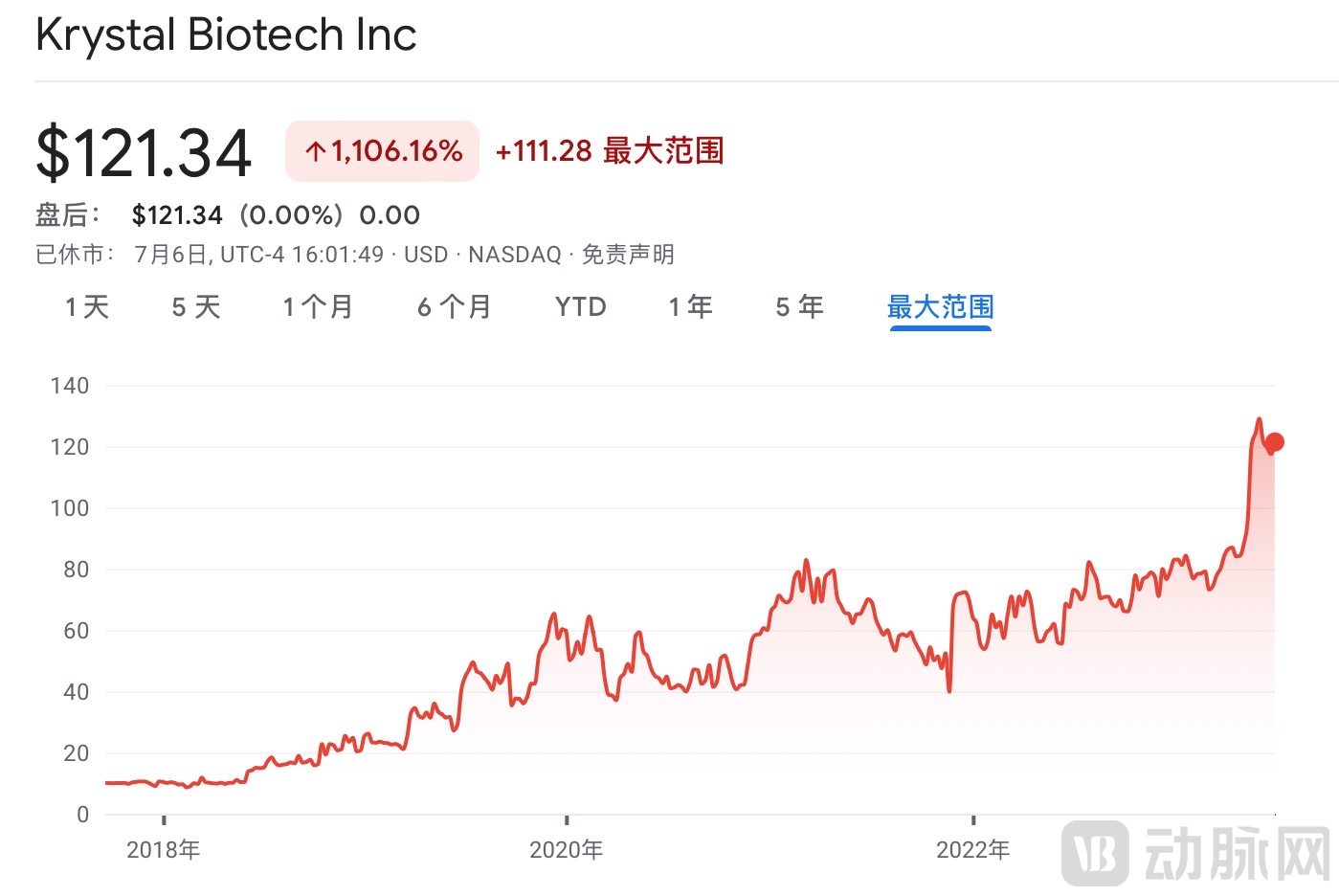
Krystal股票
图源:Google Finance
一家基因疗法公司,如何能够保持这样的增长?要从其产品管线看起。
营养不良型大疱性表皮松解症(DEB)是一种罕见的结缔组织遗传疾病,与COL7A1基因中的一个或多个突变相关。COL7A1基因在人体内负责生产功能性COL7蛋白(VII 型胶原蛋白)形成锚定纤维,连接人体真皮层与表皮层。VII 型胶原蛋白是一种细胞外基质蛋白,对皮肤稳定性很重要,其缺失将导致患者皮肤中缺乏结构性粘附,极度脆弱。
DEB患者有个好听的名字——“蝴蝶宝贝”。如蝴蝶翅膀一般脆弱的皮肤让他们承受着巨大的痛苦。即使是轻微的摩擦或刺激下,患者皮肤也可能出现水疱、糜烂、溃疡不愈合及瘢痕。DEB可能通过显性或隐性遗传,最为严重是隐性DEB(RDEB)——由COL7A1基因中的纯合子突变引起。
随着疾病进展,DEB患者承担着许多并发症和继发性疾病的风险,包括手指脚趾融合、视力影响、关节无法伸直、牙齿脱落、贫血、骨折、皮肤癌等。皮肤癌也是DEB患者最常见的死亡原因。
根据美国营养不良性表皮溶解研究协会数据,在美国,每两万名新生儿中就有一名表皮溶解症(EB)患者,每年约有200名儿童出生时患有EB。DEB是其中营养不良亚型,约占EB患者的25%。在VYJUVEK™获批之前,EB及DEB没有治疗方法或治愈方法,只有支持性护理,包括日常伤口护理、疼痛管理等,帮助患者减少感染、加速伤口愈合。
VYJUVEKTM产品
图源:Krystal
VYJUVEK™的治疗原理是将COL7A1基因的正常拷贝输送至DEB患者的分裂和非分裂皮肤细胞,纠正遗传缺陷,使其皮肤细胞能够产生COL7蛋白,稳定患者脆弱的皮肤。
在此前进行的随机、双盲、安慰剂Ⅲ期试验中,31名DEB患者受试,疗效将通过受试者的伤口愈合改善情况来确定。6个月时67%接受VYJUVEK™治疗的受试者伤口完全愈合,安慰剂治疗组则为22%。在多项试验中,VYJUVEK™均表现出良好的安全性和耐受性,没有严重不良事件或停药。
VYJUVEK™被混合到辅料凝胶中,局部作用于患者皮肤,治愈伤口的同时防止皮肤再次起泡。凝胶将被直接涂抹在DEB患者伤口上,且需要每周用药。作为首款FDA获批的可重复给药基因疗法,VYJUVEK™的基因递送依赖于专有皮肤靶向递送平台(STAR-D)。
随着基因疗法落地应用不断扩大,其疗效周期开始受到人们关注。在一些接受基因疗法并有良好疗效的患者身上,疗效随着给药后时长递减。以往推崇的“一次性治愈”基因疗法迎来困境。非侵入、可重复给药的基因疗法则迎来了机会。
疗效持久性的决定性因素不仅在于递送载体的有效周期,还在于目标组织的更新周期。目标组织更新周期越长,有效的基因拷贝在体内生效时间也越长。相比成年人,婴儿和青少年生长速度更快,细胞分裂越快、也将更快稀释基因疗法。
对于DEB患者,皮肤细胞的更新周期较短,因此重复给药更符合其疗效需求。重复给药的挑战在于递送载体。目前,基于腺相关病毒(AAV)载体的基因疗法基本上只能进行一次给药。AAV进入人体后,免疫系统将识别标记此类病毒。当利用相同病毒载体进行二次治疗,免疫系统将发起攻击,基因拷贝递送也将失败。
作为首个FDA批准的可重复用药的基因疗法,VYJUVEK™采用1型单纯疱疹病毒(HSV-1)作为其重复递送的载体。HSV-1是人类疱疹病毒家族中最具特征的一种——在人群中高度流行。美国12岁以上人群中有三分之二曾暴露于该病毒。作为一种线性双链DNA病毒,HSV-1在应用于基因递送方面有如下优势:
1-具有高有效载荷能力,可容纳大基因或多个基因
2-其基因组呈游离体(episomal)形态,无法整合或破坏宿主基因组
3-可实现体外递送和局部施用
4-可转导分裂和非分裂细胞,提高治疗基因转移的效率
5-受体包括多种人类细胞类型,具有广泛的组织亲和性和多组织器官递送可能性
6-HSV-1具有部分可抑制先天和适应性抗病毒免疫的基因,同时其膜蛋白具有先天免疫逃避特性,能够有效抵抗免疫清除。
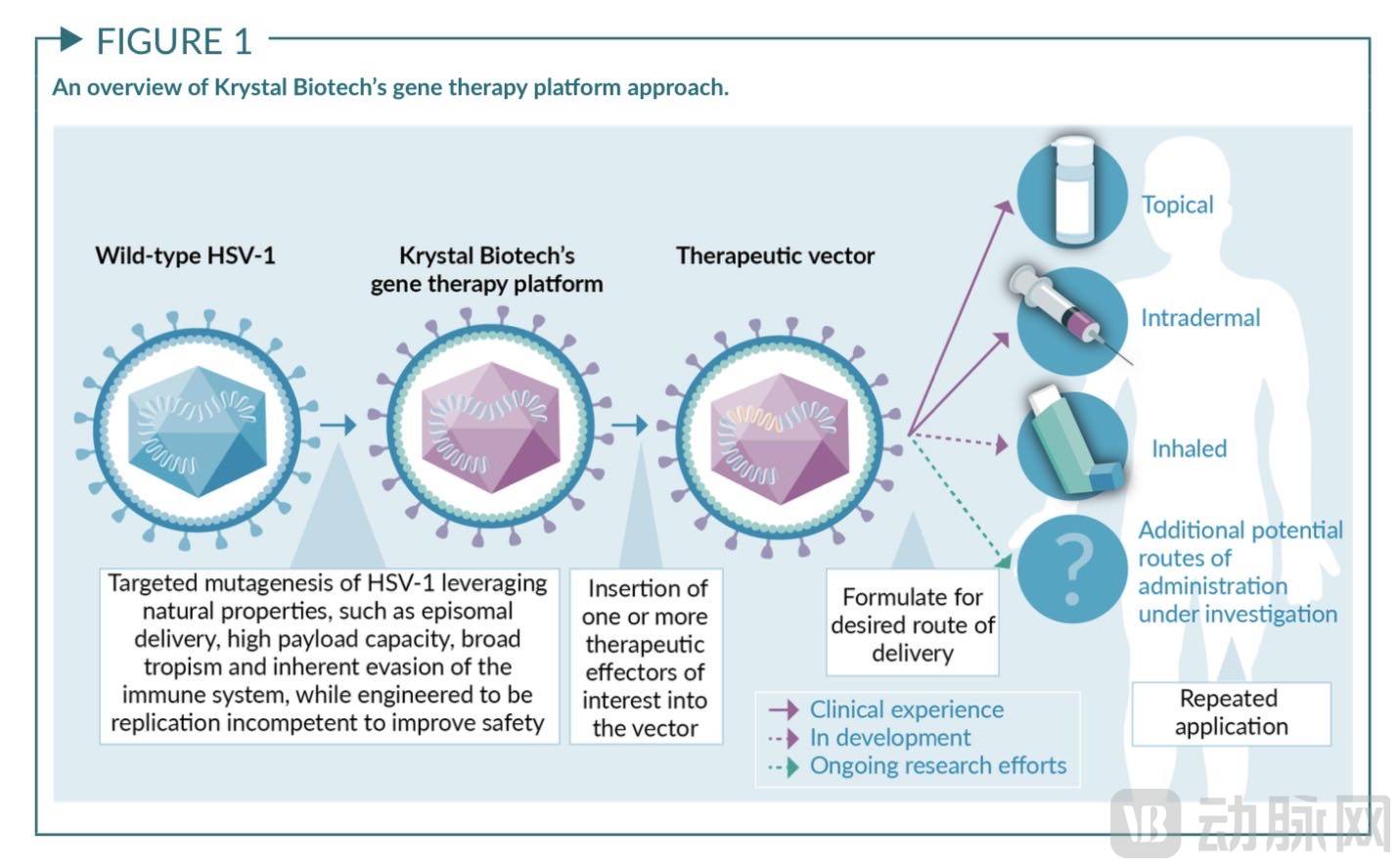
缺陷HSV-1工程载体设计方案
图源:Krystal
通过对HSV-1的ICP4和ICP22基因的靶向修饰,Krystal设计出低复制能力和低细胞毒性的工程载体。这一载体可以有效穿透广泛的皮肤细胞,实现局部基因传递、非侵入性和可重复使用。
此外,由于ICP4中靶向IE基因缺失,HSV-1载体不能在缺乏外源ICP4的非补体细胞中生长。同时,改造后的载体保留了其对常用抗病毒药物(疱疹病毒)的敏感性,以解决患者可能出现的疱疹病变或相关不良事件。
Krystal将工程化的HSV-1载体和皮肤优化的基因转移技术结合,开发了一个专有的皮肤靶向治疗平台STAR-D,适用于将一个或多个与皮肤疾病相关的治疗基因引入患者。
VYJUVEK™获批同时,Krystal获得了罕见儿科疾病优先审查凭证(PRV),可用于为另一产品申请优先审查。这为Krystal加速其他管线获批创造了新的机会。
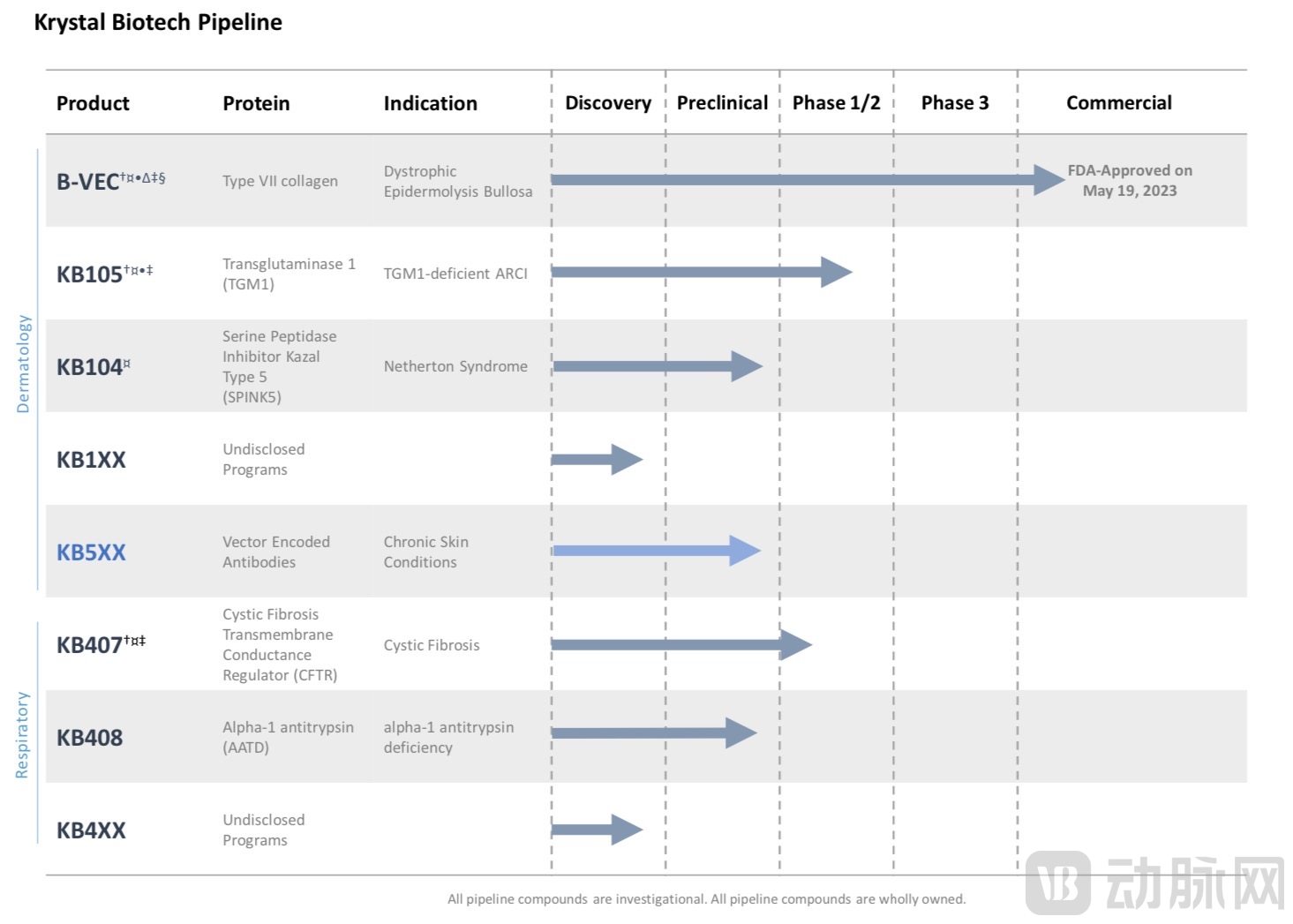
Krystal药物管线布局
图源:Krystal
常染色体隐形遗传先天性鱼鳞病(ARCI)
ARCI是一种严重的终身性遗传皮肤病,临床表现为皮肤干燥、鱼鳞状脱屑,可覆盖全身,同时经表皮失水(TEWL)增加。ARCI患者常常会发生眼睑外翻、嘴唇外翻、关节和鼻软骨急性、瘢痕性脱发等,可能伴随者脓毒症、液体和电解质失衡及发育停滞。
Krystal认为,ARCI最常见原因是转谷氨酰胺酶1(TGM1)基因编码中的失活突变。TGM1基因突变及伴随的表皮屏障破坏,会导致明显的皮肤脱水,对生活质量产生重大影响。经表皮将直接接触表面微生物和毒素,大大增加感染风险。
目前ARCI缺乏有效治疗药物,以缓解症状的治疗为主。Krystal用于治疗TGM1缺陷型ARCI的KB105预计于今年上半年启动二期临床试验。
内瑟顿Netherton综合征(NS)
NS是一种常染色体隐性皮肤疾病,会导致严重的角化缺陷和反复感染。临床表现为先天性鱼鳞病样红皮病(CIE)、套叠性脆发症(TI)和特应性体质。因而NS不仅会导致患者经历慢性皮肤炎症、严重脱水和发育迟缓,还会具有过敏、哮喘和湿疹的易感性。
NS由丝氨酸蛋白酶抑制因子SPINK5的基因突变引起。SPINK5一种蛋白酶抑制剂,在丝氨酸蛋白酶的调节中起关键作用。由于SPINK5基因的潜在基因突变,SPINK5的蛋白酶抑制作用消除,导致丝氨酸蛋白酶过度活化,引起角质细胞聚集、脱皮和皮肤屏障受损。
NS仍没有被批准的治疗方法。Krystal的KB104将针对NS进行治疗,目前已进入临床前研究,计划于今年内提交研究性新药申请(IND)。
囊性纤维化(CF)
囊性纤维化(CF)是美国最常见的遗传性疾病,是由囊性纤维化跨膜调节因子(CFTR)的基因突变引起的。根据美国囊性纤维化基金会(CFF)的数据,美国约有近4万名CF患者,全世界有超过10万名患者生活在CF中,平均死亡年龄为30.8岁。
CF患者在气道上皮细胞中缺乏功能性CFTR,导致气道表面液体的脱水和酸化,进而肺部感染反复发作,气道分泌物增加,最终导致呼吸衰竭。CF患者临床表现为多器官病理,但主要发病和死亡原因仍为肺病。
目前批准的 CFTR 调节疗法已改善了部分特定基因突变的CF患者。但仍有高达10%的严重CF患者预计不会对目前的治疗有反应,包括导致CFTR表达严重减少或消失的I类突变。目前没有治疗批准用于该类患者群体。
Krystal的基因治疗药物KB407正是针对此类患者群体。KB407的IND申请已于2022年被FDA接受,正在进行一期临床试验前筛选。另外,欧盟委员会授予KB407用于治疗CF的孤儿药物指定。
此外,用于治疗α-1抗胰蛋白酶缺乏症(AATD)的KB408处于临床前阶段,预计于2023年系半年启动一期临床试验。其余新管线将从罕见皮肤病、呼吸系统疾病扩展至慢性皮肤病,包括慢性非愈合伤口(如压疮、神经性溃疡)和异位性皮肤炎。
VYJUVEK™预计于今年第三季度在美国上市。
在美国之外,欧洲药品管理局已授予VYJUVEK™治疗DEB的孤儿药物指定和优先药物审批资格(PRIME)。VYJUVEK™的欧盟正式上市许可申请程序预计于下半年启动,可能于2024年获批。与此同时,Krystal正与日本药品和医疗器械局(PMDA)沟通,寻求2025年获批上市。
Krystal早已为VYJUVEK™的商业化做足准备。
位于匹兹堡公司总部附近的Ancoris工厂已建设完成、投入使用。Ancoris工厂占地4500平方英尺(约418平方米),满足生物治疗商业生产的现行最高GMP标准,将用于VYJUVEK™的商业化生产。
此外,第二家商业化生产基地ASTRA拥有最为先进的cGMP制造设施,预计于2023年投入运营。除作为生产补充平台外,ASTRA基地将实现公司内部供应链的充分整合,包括从初始原材料制备、包装、分销到患者服务体验的全过程集成。
Krystal认为,涵盖制造生产全过程的产线为其提供了独特的机遇,包括:
1-确保强有力的病毒生产和高质量的纯化产品;
2-降低病毒批次间差异;
3-紧密联系PD、CMC团队,迅速改进生产、监管等流程;
4-专利保护;
5-确保产品交付时间效率。

Jeune Aesthetics管线布局
图源:Krystal
积极推动管线研发与商业化的同时,Krystal将基因疗法延伸至解决皮肤老化问题,全资创办子公司Jeune Aesthetics。Jeune Aesthetics将利用Krystal的STAR-D递送平台从根本上逆转和解决皮肤老化,创新皮肤再生美容药物。
这一皮肤美化技术并非空口无凭。今年,Jeune Aesthetics开始了其主要候选产品KB301的一期临床研究。KB301将COL3A1基因传递给靶向皮肤细胞,进而生产天然的3型胶原蛋白。
截止2022年底,Krystal的现金储备为3.838亿美元。丰富的管线布局、子公司和商业化工厂建设也给Krystal带来了巨额支出。2022年度,Krystal净亏损为1.4亿美元,其中研发支出仅为4250万美元。
与高额的建设性支出同步,VYJUVEK™的商业化获批带来了Krystal市值上涨和1.6亿私募融资。这一资金补充预计将支持Krystal至2026年。同时,VYJUVEK™的商业化也将为其带来可观受益。每瓶VYJUVEK™价格为2.425万美元,预计每位患者每年使用26瓶,年费用约63.1万美元,在美政府强制性折扣后为48.5万美元。
看似Krysta只是走过传统Biotech的扩张路径,但不可忽视的是Krystal正好踩在了基因疗法高速变现的风口,拿下罕见皮肤病的First-in-Class。
回归当下,资本寒冬中,一家Biotech似乎无法复制Krystal的增长轨迹。但我们仍然可以回到自身,从深耕研发与坚持创新出发,打造差异化竞争优势。正如Krystal从HSV-1病毒载体的递送改造开始。





























