近年来,寡核酸药物凭借成药靶点数量多、研发成功率高、治疗领域广、药效长、耐药率低等优势,已从罕见病治疗拓展至常见病治疗领域。
尤其是自2023年以来,随着技术的不断进步和突破,小核酸药物上市脚步加快,推动其成为继ADC、GLP-1之后备受青睐的又一领域。目前全球共有20款小核酸药物获批上市(早期3款药物已退市),包括12款ASO药物、6款siRNA药物和2款核酸适配体。
ASO是核酸药物领域的重要支柱
ASO作为小核酸药物领域发现最早、获批最多的药物类别,是该领域研发的重要方向之一。近两年来,ASO药物在神经、代谢、心血管领域取得了非常大的临床进展,HBV和眼科的差异化治疗优势继续保持。
从国际方面来看,2023年全球有2款ASO药物获得FDA批准上市,2024年已有2款ASO产品成功完成Ⅲ期临床并首次申报上市,全球ASO药物研发取得多项突破性临床进展,MNC间大额交易不断。
2024年3月,诺和诺德以11亿美元的价格收购Cardior,其主要产品CDR132L是一种ASO候选药物,正处于治疗心力衰竭的Ⅱ期临床开发阶段,旨在通过选择性阻断microRNA分子miR-132的异常水平来停止和部分逆转细胞病理,可能导致心脏功能的长期改善。
这一消息瞬间引爆行业热情。对此,思合基因创始人、CEO王海盛博士表示,该交易信息展现出ASO药物的重要作用机制,即可以通过调控microRNA,并应用于多种适应症,是ASO药物分子的独特优势之一。
从国内市场来看,一批新兴生物技术公司也纷纷投入ASO药物研发领域,但大多处于fast follow阶段,行业需要差异化的创新。
思合基因作为国内第一批布局ASO药物研发领域的创新企业,核心团队汇聚了百济神州、Ionis等ASO赛道头部企业的资深药物开发专家和高管。凭借团队丰富的寡核酸药物研发、临床、注册和商业化等产业转化经验,思合基因已打造新一代ASO药物开发平台,希望可以加速中国寡核酸药物全产业链发展。
ASO特殊机制带来三大优势,适应症更为广泛
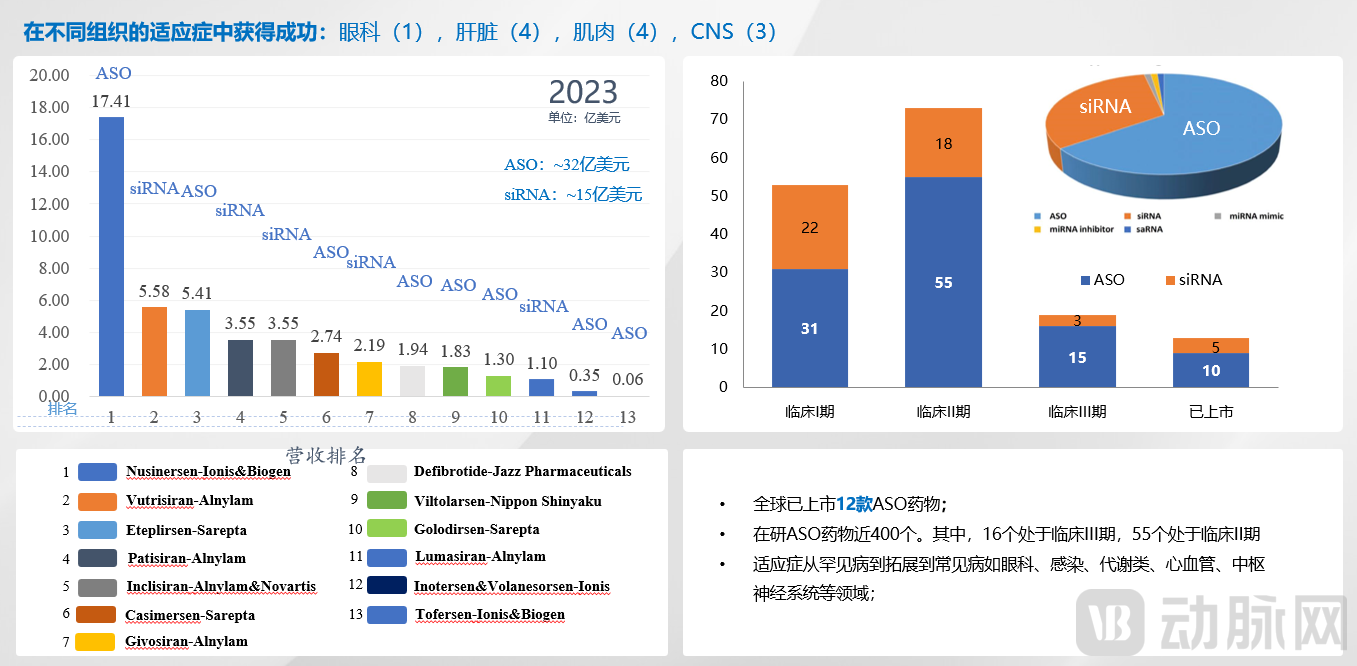
ASO药物经过多年发展,其适应症领域在2016年之后有了更广的拓展,商业化发展也较为成熟。2023年ASO药物销售额约为32亿美元,成为核酸药物领域的重要支柱,占比近70%。
其中Ionis的Nusinersen自2016年上市以来销售额爆发式增长,2023年全球销售额达17.41亿美元,是目前销售额最高的小核酸药物,充分展示了ASO药物的市场潜力。
思合基因创始人、CEO王海盛博士,是北京大学药物化学博士、美国UMSL和Auburn大学博士后,中欧国际工商学院EMBA。王博曾在保诺科技、百济神州、扬子江药业、哈药集团等国内外知名药企担任研发负责人;拥有20余年新药研发经验,熟悉新药研发法规及企业管理等。
基于丰富的药物化学和研发管理经验,王海盛博士第一时间关注到ASO药物的潜力以及背后巨大的临床需求,并联合三位在靶点筛选、序列设计、机制验证、生物信息学、修饰递送等方面都有相当丰富的经验的专家,组成了核心创始团队。
随后不久,思合基因(北京)生物科技有限公司(以下简称思合基因)正式成立于北京市贝伦产业园,定位为聚焦全球领先的反义寡核酸(ASO)药物开发的biotech公司,致力于自研ASO药物在化学修饰、生物学序列设计筛选等方面的关键技术壁垒,目前已有十余条核心管线在研。
据王海盛博士介绍,ASO药物具有三大优势,首先ASO是一个单链核酸分子,分子量比较小,可以通过自递送细胞内吞进到细胞内,对于递送系统的依赖性不是很大。
其次,从作用机制上来讲,ASO药物既有通过剪切调控上调蛋白功能的机制,又有通过RNAse H酶降解mRNA下调蛋白的作用机制,适应症更加广泛。
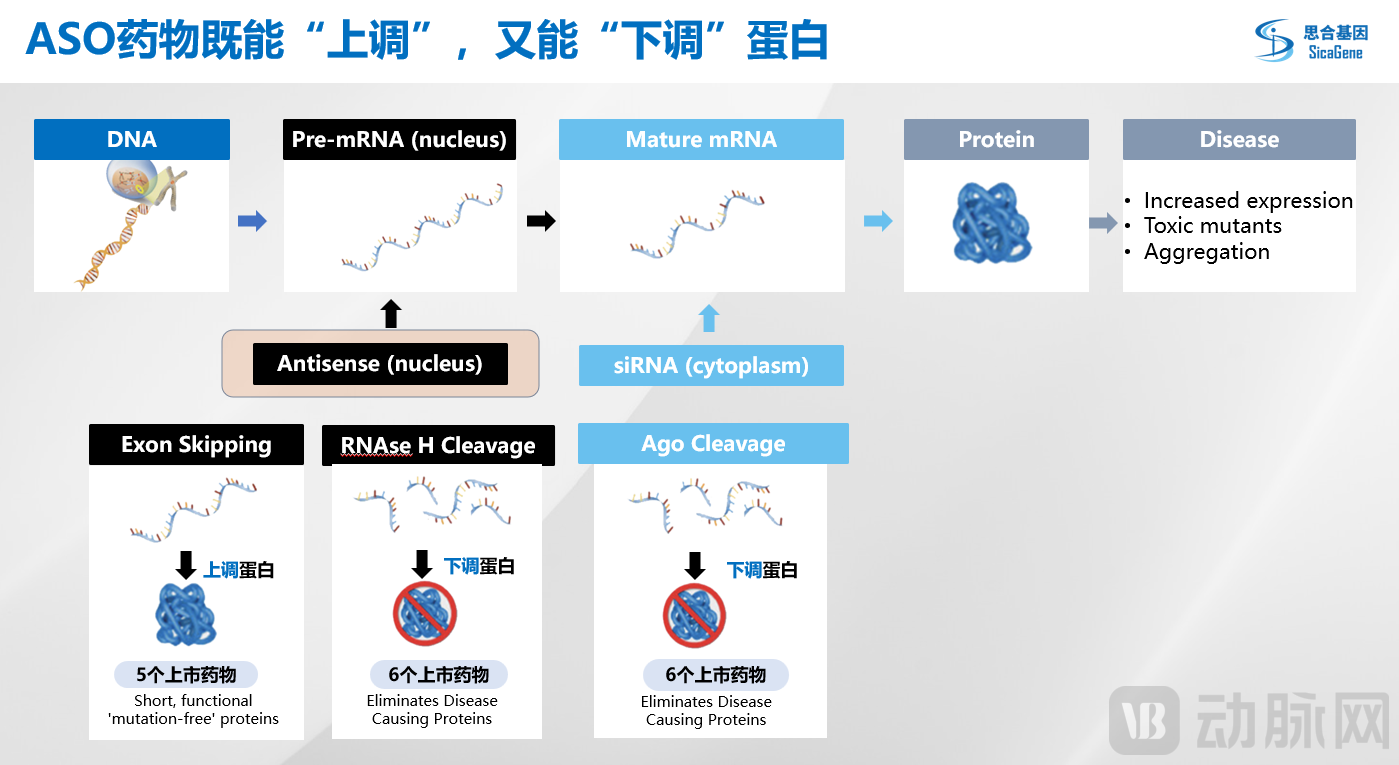
最后,通过今年3月诺和诺德收购Cardior的交易信息来看,其ASO候选药物CDR132L位于治疗心力衰竭的2期临床开发阶段,旨在通过选择性阻断microRNA分子miR-132的异常水平来停止和部分逆转细胞病理,用于心脏功能的长期改善。可以看到ASO药物的另一个重要的作用机制是可以调控microRNA,并应用于多种适应症,这也是它的突出优势之一。
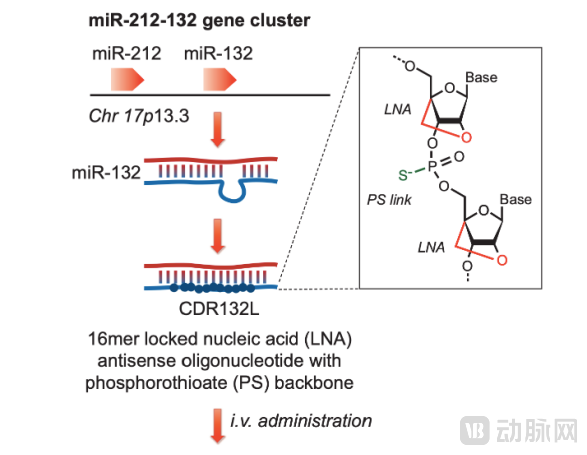
CDR132L治疗心衰的作用机制(Batkai S, et al. Eur Heart J. 2021 Oct 14)
瞄准序列设计、修饰及递送难题,构建完整ASO药物开发平台
虽然具有多重优势,但ASO药物的研发也有着多重技术难点,比如有效靶点筛选效率低、化学修饰局限、递送组织受限等。
针对上述技术难点,思合基因自主构建了SicaGene全球原创寡核酸药物开发平台,通过SicaScreenTM序列高效设计平台、SicaChemistryTM核酸组合修饰平台、SicaDeliveryTM创新多组织递送系统,实现了高效筛选成药靶点、降低开发难度和成本、规模化和程序化的寡核酸药物开发。
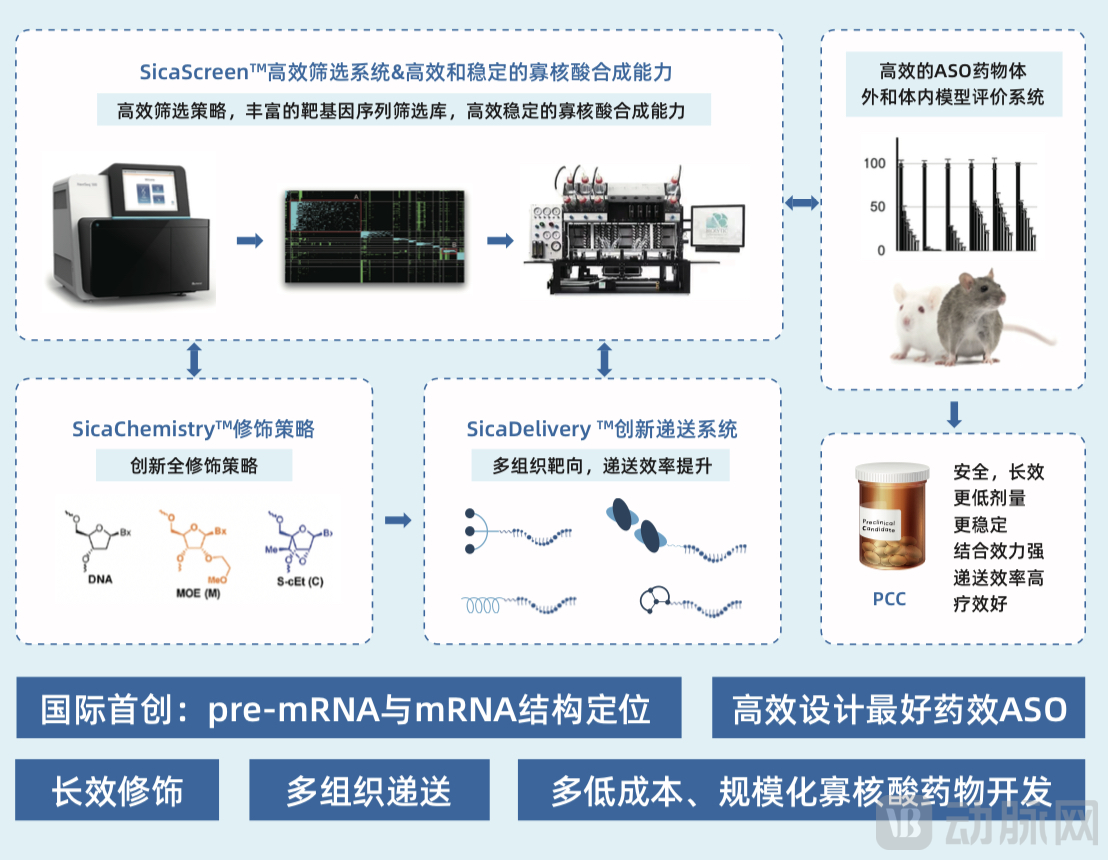 思合自研寡核酸药物设计开发平台
思合自研寡核酸药物设计开发平台
首先在序列设计方面,ASO是一个单链的寡核酸,进到细胞内之后,其与mRNA直接作用的活性与序列相关。因此,如何设计ASO的序列使其有较好的活性,是ASO药物设计首先需要克服的难点。
王海盛博士表示,过去大家通常利用高通量筛选的方式来解决这个问题,随着结构生物学的发展,人们对于蛋白结构的认知越来越多,结合ASO药物的序列设计难点和团队经验,思合基因采用“干湿结合”的方法构建了SicaScreenTM高效设计筛选系统。基于机器学习,高效构建了丰富的靶基因序列筛选库,可大大提升ASO药物序列设计的效率和成功率,相比传统的高通量筛选,可提升20-100倍以上的筛选效率提升,缩短研发周期。
其次,由于小核酸药物在人体循环系统中容易被血液核酸酶降解,稳定性较差,化学修饰和递送是小核酸药物一直以来面临的技术难点。基于长期以来的研究以及对核酸结构和生物化学的理解,ASO的骨架和核糖修饰是需要关注的重点。
思合基因建立的SicaChemistryTM创新组合修饰平台,通过对碱基、核糖和磷酸基团进行组合修饰,使得ASO分子在体内的稳定性大大提升,能一定程度上提升药物结合效力和稳定性,降低脱靶,降低给药剂量和频率。
最后在递送方面,思合基因针对眼底疾病的治疗开发了新的SicaDeliveryTM创新多组织递送系统,目前在模型动物体内已经实现了通过无创或者微创的方式将ASO药物递直接送到眼底视网膜。
“从治疗眼底疾病来说,这是一个革命性的突破,目前公司正在进一步优化递送系统,以期将来能够就是实现通过无创或者微创的方式,来替代原来需要玻璃体注射的有创的给药方式,更好地治疗眼底疾病。”王海盛博士说道。
聚焦三大ASO优势领域,核心产品处于临床前研究阶段
基于全球原创的ASO药物开发平台,思合基因聚焦肝脏、眼科及CNS三大领域,目前有10余条ASO药物管线在研,其中进展最快的抗病毒药物项目已经进入临床前阶段。
王海盛博士表示,选择布局肝脏、眼科和CNS领域,一方面是可以充分发挥ASO分子独特机制的优势,另一方面是基于领域内未被满足的临床需求。
一方面,目前全球已有许多研究证据支持ASO药物在HBV领域药物开发的潜在作用,ASO药物在乙肝治疗方面取得了很好的疗效并有着较宽的安全窗口。针对眼科和CNS领域只需局部给药的特点,ASO药物通过细胞内吞直接作用于致病蛋白的产生过程这一特殊机制,也有着很强的优势应用。
另一方面,从未被满足的临床需求角度来看,眼科和CNS存在着巨大的未满足临床需求。在眼科领域,现有抗VEGF药物如雷珠单抗、阿柏西普均为生物大分子,只能通过有创的玻璃体注射进行给药,并且约有40%患者应答不良及耐药,存在着突出的未满足临床需求。ASO药物可以通过细胞内吞进到细胞内,靶点选择更加多样化。同时由于ASO药物可以直接抑制致病蛋白的产生,能从根本上治疗一些原发性的疾病,针对抗VEGF无效或耐药人群,也有着很广泛的应用前景。
此外,ASO能够在基因水平抑制致病蛋白或者非编码RNA的生成,也具备治疗CNS疾病的巨大潜力。从全球CNS领域的研发进展来看,众多MNC都布局了创新的ASO疗法。
目前全球在研ASO药物近400个,其中16个处于临床III期,55个处于临床II期。从这些候选药物来看,ASO的适应症正在逐渐从罕见病扩展到常见病,比如眼科、感染、代谢类、心血管、中枢神经系统等领域。
随着技术的不断突破,ASO药物作为小核酸药物的中坚力量,正在逐步从罕见病和遗传病领域,走到更为广泛的常见病领域,未来有望成为人类对抗疾病的中坚力量。
“我们期望无论是投资机构还是药企,能够基于未满足的临床出发,更多地去关注ASO药物这种强有力的治疗modality,推动更多的ASO新药分子进入临床,满足更多病患的需求。”王海盛博士最后说到。
立足于未来,思合基因将继续夯实公司在寡核酸药物开发领域的核心技术优势,并积极推进产品管线进入到临床阶段,加强医院合作。针对未被满足的临床需求,思合未来将覆盖到更多适应症领域,为难治疾病提供更多的治疗手段。





























